Конспект урока «Уравнение состояния идеального газа» по физике для 10 класса
Уравнение состояния идеального газа.
Цель: сформировать умение описывать состояние термодинамической системы данной массы газа с помощью 3 макропараметров. Выяснить физический смысл универсальной газовой постоянной. Развить навыки решения задач.
Ход урока.
-
Организационный момент. Проверить готовность к уроку. Отметить отсутствующих.
-
Актуализация знаний. Ученики на экране видят вопрос. Ответы на вопросы пишут на доске 2 учеников, остальные их проверяют и дополняют ответы. Укажите формулы выражающие следующие утверждения: а) Основное уравнение МКТ связывает макроскопические величины с микроскопическими величинами.
Б) температура является мерой средней кинетической энергии.
В)при абсолютном нуле температуры давление газа становится равным нулю, что вытекает из формулы
Г) средняя кинетическая энергия поступательного движения молекул равна
Д)связь между температурными шкалами Цельсия и Кельвина
E=3/2*k*T, p=n*k*T, E=m*v^2/2, p=1/3*mo*n*v^2, T=t+273.
-
Изучение нового материала:
Какие параметры определяют состояние газа? (P,V,T,N). Можно ли изменить какой-либо из перечисленных параметров не меняя при этом других пааметров?(можно изменить 2 параметра не меняя остальные параметры).
Можно также изменить 3,4 параметра, но нельзя менять один параметр, не меняя при этом другие параметры. Это означает, что между четырьмя параметрами существует определенная связь. Выражение, описывающее эту связь, называют уравнением состояния идеального газа.
Вывод уравнения состояния газа. Целесообразно вывести уравнение состояния для любой массы газа, измеренной в молях. Для этого используют связь между двумя параметрами: p и T: p=n*k*T
Для того чтобы ввести в это уравнение обьем газа, надо использовать выражение для концентрации газа n=N/V, тогда p= (N/V)*k*T. Число молекул N надо выразить через массу вещества с помощью формул N=NA*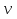 и ν=m/M
и ν=m/M
Подставив значение N в уравнение для давления, получим:
p= * k*T или p*V=
* k*T или p*V= 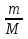 * NA*k*T
* NA*k*T
NA*k=R. R=8,31 Дж./К*моль.
Окончательно уравнение можно записать в виде: p*V= 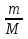 * R *T. (1)
* R *T. (1)
Необходимо отметить, что уравнение (1) характеризует состояние идеального газа при тепловом равновесии и его применяют не только к газам, но и к парам (до насыщения).
Из уравнения состояния вытекает связь между давлением, обьемом и температурой идеального газа, который может находиться в двух любых состояниях. Переход из одного состояния в другое сопровождается изменением обьема, давления и температуры и описывается уравнением Бенца-Клайперона.
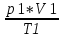 =
=
Знать уравнение состояния необходимо при исследовании тепловых явлений. Оно позволяет полностью или частично ответить сразу на 3 вопроса.
-
Уравнение состояния позволяет определить одну из величин, характеризующих состояние, например температуру, если известны две другие величины. Это и используют в термометрах.
-
Зная уравнение состояния, можно сказать, как протекают в системе различные процессы пи определенных внешних условиях: например, как будет меняться давление газа, если увеличивать его оббьем при неизменной температуре, и т.д.
-
Зная уравнение состояния, можно определить, как меняется состояние системы, если она совершает работу или получает теплоту от окружающих тел.
-
Углубление знаний, умений. Решение задач.
-
Каково давление сжатого воздуха, находящегося в баллоне вместимостью 20 л. При 12⁰ С, если масса этого воздуха 2 кг?
(p*V= 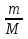 * R *T. P=
* R *T. P= * R *T)/V= (2*8,31*285)/(29*0,001*20*0,001)=8,6*10⁶Па)
* R *T)/V= (2*8,31*285)/(29*0,001*20*0,001)=8,6*10⁶Па)
-
Воздух обьемом 1,45 м^3, находящийся при температуре 20⁰С и давлении 100 КПа, перевели в жидкое состояние. Какой оббьем займет жидкий воздух, если его плотность 861 кг/м^3?
(p₁*V₁= 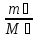 * R *T₁, m₁=p₁*V₁*M₁/ R *T₁,V₂=m₁/ρ₂= p₁*V₁*M₁/ R *T₁*ρ₂, V₂=20*10⁻⁴м^3)
* R *T₁, m₁=p₁*V₁*M₁/ R *T₁,V₂=m₁/ρ₂= p₁*V₁*M₁/ R *T₁*ρ₂, V₂=20*10⁻⁴м^3)
Если позволяет время можно рассмотреть еще несколько задач.
5.Итоги урока.
6. Домашнее задание. Параграф 68, упр.13(8,9)
Здесь представлен конспект к уроку на тему «Уравнение состояния идеального газа», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Физика (10 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

