Слайд 1Колпаков В.А. Равновесные электродные процессы
Классификация электродов. Гальванические элементы.
Слайд 2Растворы, обладающие электрической проводимостью (электролиты), по своим свойствам существенно отличаются от растворов неэлектролитов. Отличительной особенностью электролитов является наличие ионов (т. е. частиц, обладающих избыточным электрическим зарядом) в растворе. Наличие ионов приводит не только к существенному отклонению свойств растворов электролитов по сравнению с растворами неэлектролитов, но и приводит к совокупности новых свойств и явлений. Такая система называются электродом.
Слайд 3При протекании термодинамических процессов, участниками которых являются ионы, кроме механической работы совершается еще и электрическая работа, связанная с переносом заряженных частиц. Таким образом, в системах состоящих из проводников первого рода (обладающих электронной проводимостью), находящихся в контакте с проводниками второго рода (обладающих ионной проводимостью), происходит взаимное превращение химической и электрической форм энергий.
Слайд 4Проводники первого рода — это, как правило, металлы, проводники второго рода — электролиты. Перенос заряда через границу раздела фаз (электрический ток) в электроде осуществляется за счет электрохимической реакции. Между фазами электрода возникает некий определенный скачек потенциала, называемый электродным потенциалом, величина которого обусловлена природой составляющих его компонентов, их концентрациями и значениями внешних термодинамических параметров.
Слайд 5Зависимость электродного потенциала от активности участников электрохимической реакции выражается уравнением Нернста
где
называется стандартным электродным потенциалом
Слайд 6Для обратимой электродной реакции окисленная форма вещества переходит в восстановленную и наоборот Ox + z e– Red, тогда уравнение Нернста будет выглядеть
где z — число электронов, участвующих в электрохимической реакции, a Ox — активность окисленной формы вещества, aRed — активность восстановленной формы вещества
Слайд 7Комбинация констант R, F и температуры (RT / F) часто встречается в электрохимических уравнениях; она имеет размерность напряжения. Общепринято обозначать ее как b0. Часто уравнение Нернста записывается через десятичные логарифмы. Переход к десятичным логарифмам осуществляется путем умножения b0 на ln10 (это произведение обозначается как b). При 298 К значения b0 и b соответственно равны:
;
Слайд 8Следует отметить, что в общем случае при записи уравнения Нернста под логарифмом остаются только те величины, которые могут варьироваться. Таким образом, при записи уравнения Нернста для разных случаев необходимо соблюдать несколько правил, связанных с применением выражения для различных типов растворов и выбором стандартного состояния для чистых компонентов и растворителя:
Слайд 9Активности чистых компонентов, образующих отдельную фазу постоянного состава, (как правило, это твердые вещества) принимаются равными единице; Активность растворителя принимается равной единице; Вместо активностей газообразных веществ в уравнение входят относительные парциальные давления этих газов над раствором. Давление приводится относительно стандартного (1.01325 × 105 Па), т. о. эта величина является безразмерной, хотя численно она совпадает с парциальным давлением газа, выраженным в атмосферах (атм).

Слайд 10Правила схематической записи электродов
1. Для электродов (полуэлементов): вещества, находящиеся в растворе (можно только потенциалопределяющие ионы), указываются слева от вертикальной черты, справа указываются вещества, образующие другую фазу, или материал электрода. Состояния всех веществ указывается в скобках. Например, (р-р) — вещество находится в растворе (как правило жидком), (г) — вещество находится в газовой фазе, (т) — вещество образует твердую фазу (как правило обозначение состояния твердых фаз опускают).
Слайд 112. Если в растворе находится несколько веществ, то они разделяются запятыми. Вещества составляющие различные фазы разделяются с помощью вертикальной черты. Например: Cd2+(aq) Cd(т); Cl–(aq) AgCl(т) Ag(т); H+(aq) H2(г) Pt(т)
Слайд 123. Уравнение электродной реакции записывается так, чтобы слева располагались вещества в окисленной форме и электроны, а справа вещества в восстановленной форме: Cd2+(aq) + 2 e– = Cd(т); AgCl(т) + e– = Ag(т) + Cl–(aq); 2 H+(aq) + 2 e– = H2(г).
Слайд 13Классификация электродов
Электроды нулевого рода (окислительно-восстановительные электроды) Окислитель и восстановитель, как правило, находятся в растворе, а фаза проводника первого рода выполнена из инертного материала (например, Pt), которая выступает в качестве контакта и не участвует в электрохимической реакции. Примеры, Fe2+(aq), Fe3+(aq) Pt; C6H4O2, C6H4(OH)2, H+(aq) Pt (хингидронный электрод).
Слайд 14Электроды первого рода 1. Металл, погруженный в раствор, содержащий ионы этого металла Mz+(р-р) M(т). 2. Неметалл, погруженный в раствор, содержащий ионы этого неметалла Az–(р-р) A(т). Металлическая фаза может быть выполнена не только из чистого вещества, но представлять собой сплав (раствор). Например, амальгамные электроды (амальгама — раствор металла в ртути) Mz+(р-р) M(р-р в Hg).
Слайд 15Электроды второго рода Металл (A), погруженный в раствор, содержащий насыщенное соединение (малорастворимое или комплексное) иона этого металла (A+) и избытка аниона (B–). Таким образом, электрод второго рода обратим относительно аниона (т. е. его потенциал зависит от концентрации этого аниона). B–(р-р) AB(т) A(т) AB(т) + e– = A(т) + B–(р-р).
Например, Cl–(aq) AgCl Ag — хлоридсеребряный электрод
Слайд 16Газовые электроды Газовые электроды выделяет по признаку того, что один из участников окислительно-восстановительной пары находится в газовой фазе.
Например, H+(aq) H2(г) Pt(т) — водородный электрод; Cl–(aq) Cl2(г) Pt(т) — хлорный электрод.
Слайд 17Ион-селективные электроды Ион-селективные электроды основаны на использовании специальных мембран, способных пропускать специфические ионы. Они обратимы относительно этих ионов, находящихся в растворе. Наибольшее применение в практике получили фтор-селективный и стеклянный электроды. Стеклянный электрод изготавливается на основе мембран из специальных сортов стекла. Например, стеклянная мембрана разделяет внешний раствор, содержащий ионы водорода, и внутренний стандартный раствор соляной кислоты, в котором, в свою очередь, находится хлорид-серебряный электрод: H+(aq) | стекло | HCl(aq) | AgCl | Ag
Слайд 18Потенциал стеклянного электрода зависит от активности ионов водорода:
На использовании стеклянного электрода основан метод pH-метрии.
Слайд 19Гальванические элементы
Из двух электродов может быть составлена электрохимическая цепь — гальванический элемент, в которой электрическая энергия вырабатывается за счет протекания электрохимических реакций на электродах. Отдельный электрод в гальваническом элементе иногда называют полуэлементом. Основной электрической характеристикой электрохимической цепи является разность электрических потенциалов между электродами. Соединение электродов внешним проводником приводит к появлению в цепи электрического тока.

Слайд 20При схематической записи электрохимической цепи: 1. Левый электрод записывается в обратном порядке (вещества, находящиеся в растворе, указываются справа от вертикальной черты, слева указываются вещества, образующие другую фазу, или материал электрода). Правый электрод записывается в обычном порядке согласно правилам схематической записи электродов; 2. Растворы обоих электродов отделяются вертикальной пунктирной линией, если они контактируют друг с другом (диффузионный потенциал не устранен) или двумя пунктирными вертикальными линиями, если диффузионный потенциал между растворами устранен (например, с помощью солевого мостика).

Слайд 21В правильно разомкнутой цепи на концах условной записи элемента записывается один и тот же по природе металл. Для простоты часто в записи цепи его опускают. Разность электрических потенциалов гальванического элемента равна по знаку и значению электрическому потенциалу металлического проводника, присоединенного к правому электроду, минус потенциал идентичного проводника, присоединенного к левому электроду E = Еп – Ел , где Еп — потенциал правого электрода, Ел — потенциал левого электрода

Слайд 22Предельное значение разности электрических потенциалов при токе через элемент, стремящемся к нулю, называется электродвижущей силой (ЭДС) и обозначается E. Cогласно правилу записи электродной реакции, для каждого электрода окисленная форма вещества и электроны записываются слева. Суммарная реакция, протекающая в элементе, является разницей между реакциями на правом и левом электродах. Тогда, если разность потенциалов всего элемента положительна, то суммарная реакция и электрический ток в гальваническом элементе протекает слева направо, если же отрицательно, то — в обратном направлении.
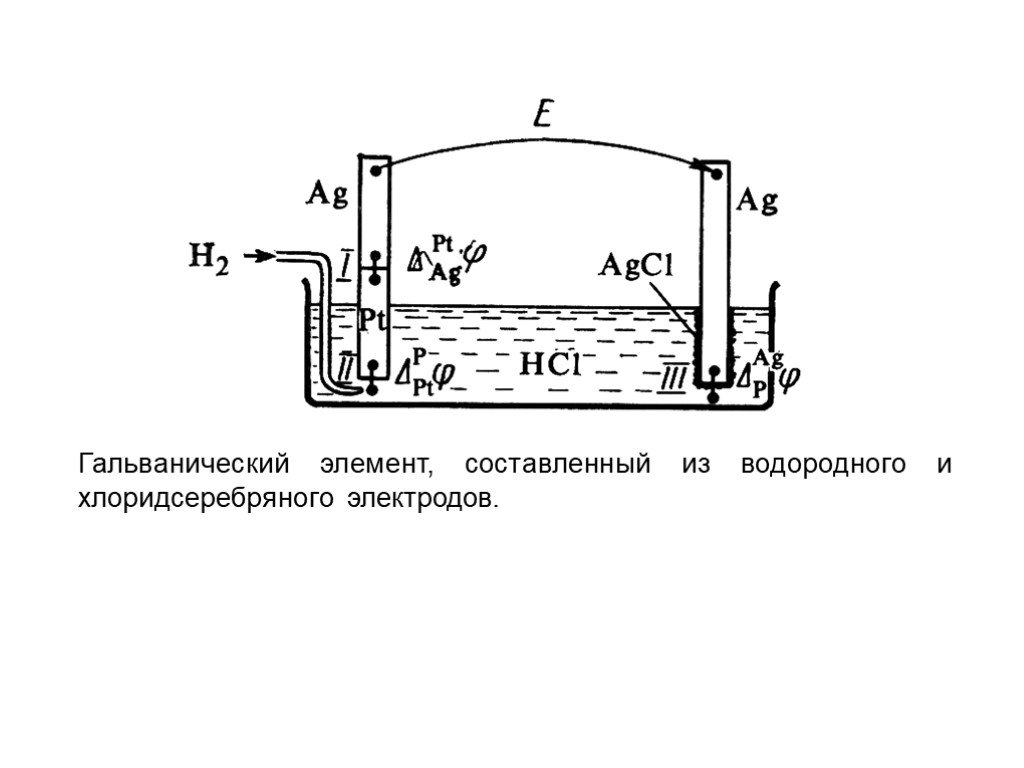
Слайд 23Рассмотрим в качестве примера три случая. 1. Оба электрода имеют общий раствор Pt, H2(г) HCl(aq) AgCl Ag На электродах протекают реакции: (1) AgCl + e– Ag + Cl–(aq); (2) 2H+(aq) + 2 e– H2(г). Суммарная реакция, протекающая в элементе AgCl + 0.5H2(г) Ag + HCl(aq).
Слайд 242. Растворы электродов различны и имеют контакт между собой через мембрану (диффузионный потенциал не устранен); Cd Cd(NO3)2(aq) NaCl(aq) AgCl Ag На электродах протекают реакции: (1) AgCl + e– Ag + Cl–(aq); (2) Cd2+(aq) + 2 e– Cd. Суммарная реакция, формально протекающая в элементе AgCl + 0.5Cd = Ag + 0.5Cd2+(aq) + Cl–(aq).
Слайд 253. Растворы электродов различны и соединены между собой солевым мостиком (диффузионный потенциал устранен). Pt H2(г) HCl(aq) NaCl(aq) AgCl Ag На электродах протекают реакции: (1) AgCl + e– Ag + Cl–(aq); (2) 2H+(aq) + 2 e– H2(г). Суммарная реакция, формально протекающая в элементе AgCl + 0.5H2(г)= Ag + H+(aq) + Cl–(aq).
Слайд 26Гальванический элемент, составленный из водородного и хлоридсеребряного электродов.
Слайд 27Условный электродный потенциал
ЭДС гальванического элемента складывается из скачков потенциала на границе всех фаз образующих элемент При этом в формировании ЭДС гальванического элемента участвуют не только разницы потенциалов между фазами электродов, но и разница потенциалов между металлами образующими электронопроводящую фазу электродов — так называемый контактный потенциал, а также разница потенциалов между фазами растворов электродов — диффузионный потенциал.

Слайд 28Диффузионный потенциал возникает на границе двух растворов из-за различных подвижностей ионов, содержащихся в электродных растворах и/или их концентраций. Гальванический элемент может иметь общий раствор электролита для обоих электродов. В этом случае диффузионный потенциал будет отсутствовать. В других случаях при проведении электрохимических измерений от диффузионного потенциала стараются по возможности избавиться. Существует несколько способов устранения диффузионного потенциала. Наиболее простым является использование для соединения растворов двух электродов солевого мостика, заполненного раствором соли, катионы и анионы которой обладают приблизительно одинаковыми подвижностями (KCl, KNO3).

Слайд 29Контактный потенциал возникает в случае, когда электронопроводящие фазы электродов выполнены из различных металлов. В связи с тем, что в настоящее время нет прямых экспериментальных и расчетных методов определения отдельных скачков потенциала на границе раздела фаз в гальваническом элементе, значение потенциала отдельных электродов приводят относительно потенциала какого-либо стандартного электрода — переход к условной шкале потенциалов. В этом случае при расчете ЭДС гальванического элемента компенсируется как сдвиг потенциалов отдельных электродов относительно абсолютной шкалы потенциалов, так и контактный потенциал, который входит в условный стандартный электродный потенциал.

Слайд 30Принято выражать потенциалы электродов относительно стандартного водородного электрода (условная водородная шкала потенциалов), потенциал которого принят за ноль при всех температурах. Для определения электродного потенциала электрода составляется гальванический элемент из этого электрода и стандартного водородного электрода — H+(aq, a± = 1) H2(г, p = 101325 Па) Pt (активность иона водорода поддерживается равной единице и парциальное давление водорода над раствором — 101325 Па).
Слайд 31Переход к условной шкале потенциалов позволяет избавиться от многих трудностей и неопределенностей при решении большинства электрохимических задач. Согласно правилам ИЮПАК условный электродный потенциал или просто электродный потенциал определяется как ЭДС элемента, в котором слева расположен стандартный водородный электрод, а справа — рассматриваемый электрод.
Слайд 32Например, потенциал кадмиевого электрода (Cd2+(aq) | Cd) будет равен ЭДС элемента Pt | H2(г, p = 101325 Па) | H+(aq, a± = 1) || Cd2+(aq) | Cd. Потенциал рассматриваемого электрода обозначается при этом символом E. В справочниках приводятся условные стандартные потенциалы электродов при некоторой температуре, которые измерены относительно стандартного водородного электрода при соотношении активностей веществ, участвующих в электродной реакции, равном единице.
Слайд 33Тогда, для рассмотренного примера, потенциал кадмиевого электрода будет записан как
стандартный электродный потенциал кадмиевого электрода
Запись и порядок применения уравнения Нернста сохраняется при переходе к условной шкале потенциалов с заменой °x на E°x
Выражения для ЭДС гальванического элемента через условные потенциалы будет иметь вид E = Eп – Eл . Разница между стандартными потенциалами гальванического элемента называется стандартной ЭДС гальванического элемента и обозначается Е0.