Слайд 11. Аминокислоты и белки
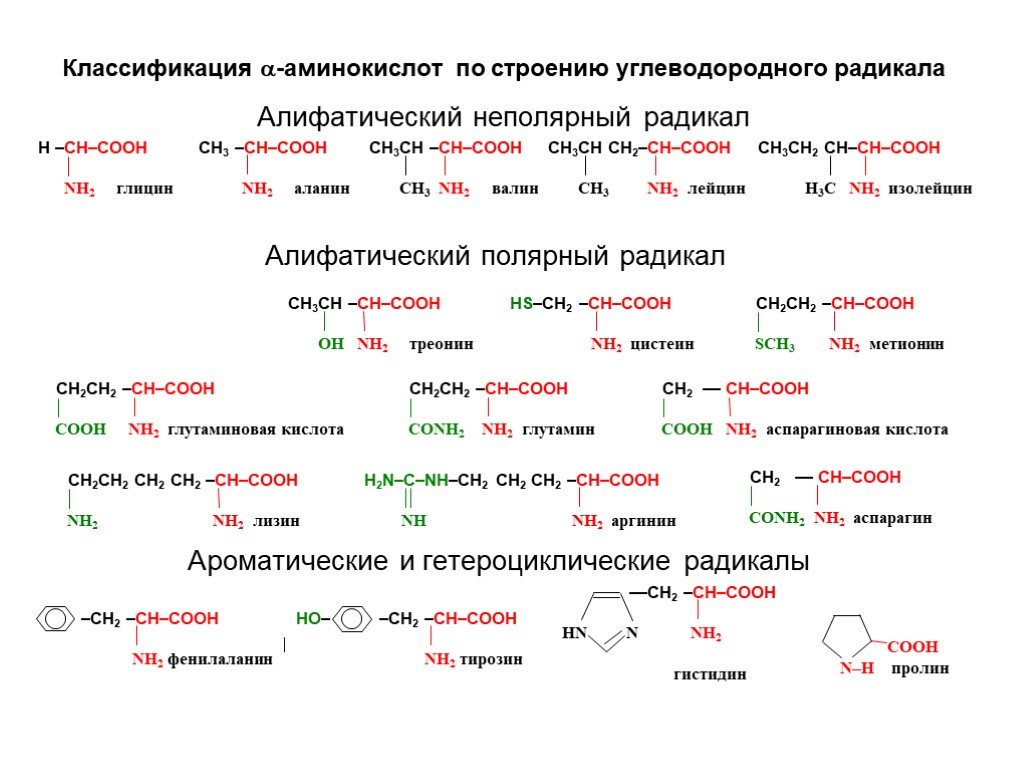
В состав природных полипептидов и белков входят -аминокислоты, в молекулах которых амино- и карбоксильная группы связаны с одним и тем же атомом углерода. H2N–СН–СООН R В зависимости от строения углеводородного радикала R природные аминокислоты разделяют на алифатические, ароматические и гетероциклические. Алифатические аминокислоты могут быть неполярными (гидрофобными), полярными незаряженными и полярными заряженными. В зависимости от содержания функциональных групп в радикале выделяют аминокислоты, содержащие гидроксильную, амидную, карбоксильную и аминогруппы. Обычно используются тривиальные названия -аминокислот, которые обычно связаны с источниками их выделения или свойствами.
Слайд 2Классификация -аминокислот по строению углеводородного радикала
Алифатический неполярный радикал Алифатический полярный радикал Ароматические и гетероциклические радикалы Гетероциклический радикал Карбоциклический радикал

Слайд 3Заменимые и незаменимые -аминокислоты
Все природные -аминокислоты делят на незаменимые, которые поступают в организм только из внешней среды, и заменимые, синтез которых происходит в организме. Незаменимые -аминокислоты: Заменимые -аминокислоты: валин, лейцин, изолейцин, глицин, аланин, пролин, лизин, метионин, треонин, серин, цистеин, аргинин, гистидин, триптофан, фенилаланин аспарагин, глутамин, аспарагиновая и глутаминовая кислоты В качестве исходных веществ при биосинтезе аминокислот могут выступать другие аминокислоты, а также вещества, относящиеся к другим классам органических соединений (например, кетокислоты) Катализаторами и участниками этого процесса являются ферменты. Анализ аминокислотного состава различных белков показывает, что на долю дикарбоновых кислот и их амидов в большинстве белков приходится 25-27 % всех аминокислот. Эти же аминокислоты вместе с лейцином и лизином составляют около 50 % всех аминокислот белков. В то же время на долю таких аминокислот, как цистеин, метионин, триптофан, гистидин приходится не более 1,5 – 3,5 %.

Слайд 4Стереоизомерия -аминокислот
Пространственные или стереоизомеры или оптически активные соединения – соединения, способные существовать в пространстве в виде двух изомеров, являющихся зеркальным отражением друг друга (энантиомеры). Все -аминокислоты, кроме глицина, являются оптически активными соединениями и способны вращать плоскость поляризации плоскополяризованного света (все волны которого колеблются в одной плоскости) вправо (+, правовращающие) или влево (-, левовращающие). Признаки оптической активности: - наличие в молекуле асимметричного атома углерода (атома, связанного с четырьмя разными заместителями); - отсутствие в молекуле элементов симметрии. Энантиомеры -аминокислот обычно изображают в виде относительной конфигурации и называют по D,L-номенклатуре.

Слайд 5Относительные конфигурации -аминокислот
В молекуле аланина второй атом углерода является асимметричным (у него 4 разных заместителя: атом водорода, карбоксильная, метильная и аминогруппы. Углеводородную цепь молекулы располагают вертикально, в зеркальном отражении изображают только атомы и группы, связанные с асимметричным атомом углерода. Для -аминокислот это, как правило, атом водорода и аминогруппа. Если аминогруппа располагается справа от углеродной цепи, это D-изомер; если слева – L-изомер. В состав природных белков входят только L-изомеры -аминокислот. Относительная конфигурация не определяет направление вращения плоскости поляризации плоскополяризованного света. Чуть больше половины L--аминокислот являются правовращающими (аланин, изолейцин, глутаминовая кислота, лизин и др.); немного меньше левовращающих кислот (фенилаланин, триптофан, лейцин и др.)

Слайд 6Конфигурация аминокислот определяет пространственную структуру и биологические свойства как самих аминокислот, биополимеров – белков, которые построены из остатков аминокислот. Для некоторых аминокислот наблюдается связь между их конфигурацией и вкусом, например L-Tрп, L-Фен, L-Tир, L-Лей имеют горький вкус, а их D-энантиомеры сладкие. Сладкий вкус глицина известен давно. L-изомер треонина одним людям кажется сладким, другим – горьким. Мононатриевая соль глутаминовой кислоты - глутамат натрия - один из важнейших носителей вкусовых качеств, применяемых в пищевой промышленности. Интересно заметить, что производное дипептида из аспарагиновой кислоты и фенилаланина обнаруживает интенсивно сладкий вкус. Все аминокислоты представляют собой белые кристаллические вещества, имеющие очень высокие температуры правления (более 230 °С). Большинство кислот хорошо растворимы в воде и практически не растворимы в спирте и диэтиловом эфире. Это, так же как и высокая температура плавления, указывает на солеобразный характер этих веществ. Специфическая растворимость аминокислот обусловлена наличием в молекуле одновременно аминогруппы (основный характер) и карбоксильной группы (кислотные свойства), благодаря чему аминокислоты принадлежат к амфотерным электролитам (амфолитам).

Слайд 7Кислотно-основные свойства -аминокислот
В аминокислотах одновременно присутствует как кислотная карбоксильная группа, так и основная аминогруппа. В водных растворах и твердом состоянии аминокислоты существуют только в виде внутренних солей – цвиттер-ионов или биполярных ионов. Кислотно-основное равновесие для аминокислоты может быть описано: анион биполярный ион катион В кислой среде молекулы аминокислот представляют собой катион. При пропускании электрического тока через такой раствор катионы аминокислот движутся к катоду и там восстанавливаются. В щелочной среде молекулы аминокислот представляют собой анион. При пропускании электрического тока через такой раствор анионы аминокислот движутся к аноду и там окисляются. Значение рН, при котором практически все молекулы аминокислоты представляют собой биполярный ион называется изоэлектрической точкой (рI). При этом значении рН раствор аминокислоты не проводит электрический ток.

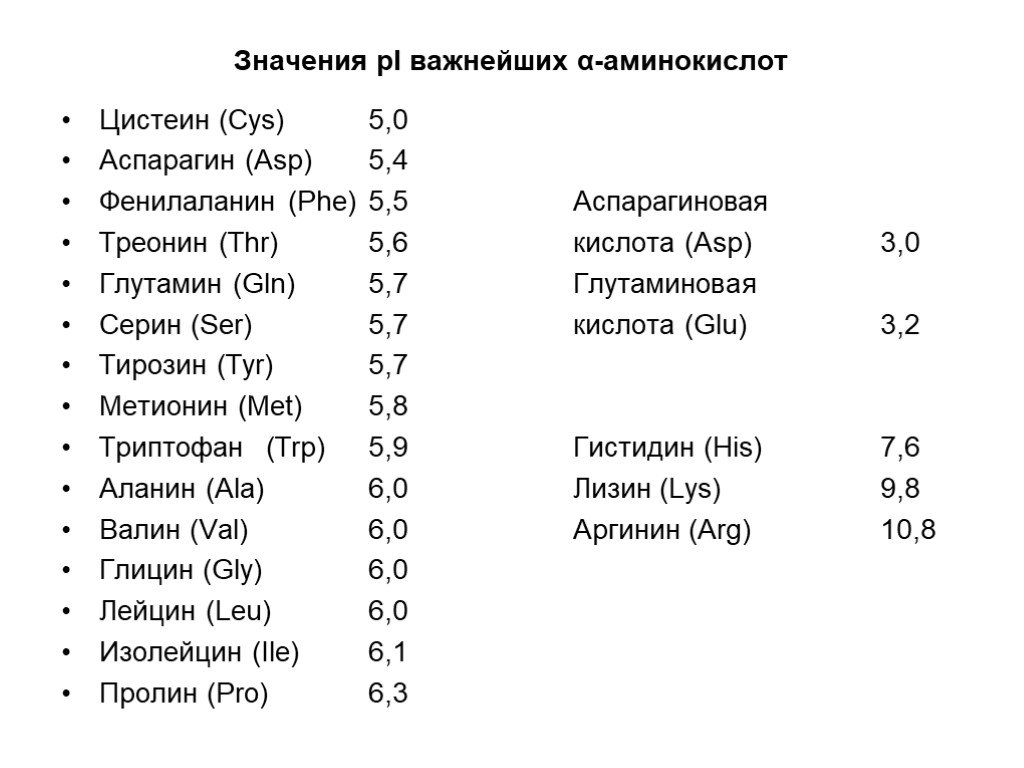
Слайд 8Значения pI важнейших α-аминокислот
Цистеин (Cys) 5,0 Аспарагин (Asp) 5,4 Фенилаланин (Phe) 5,5 Аспарагиновая Треонин (Thr) 5,6 кислота (Asp) 3,0 Глутамин (Gln) 5,7 Глутаминовая Серин (Ser) 5,7 кислота (Glu) 3,2 Тирозин (Tyr) 5,7 Метионин (Met) 5,8 Триптофан (Trp) 5,9 Гистидин (His) 7,6 Аланин (Ala) 6,0 Лизин (Lys) 9,8 Валин (Val) 6,0 Аргинин (Arg) 10,8 Глицин (Gly) 6,0 Лейцин (Leu) 6,0 Изолейцин (Ile) 6,1 Пролин (Pro) 6,3
Слайд 9Химические свойства -аминокислот
Все химические реакции, в которые вступают -аминокислоты, можно разделить на группы: Реакции с участием карбоксильной группы Реакции с участием аминогруппы Реакции с участием углеводородного радикала кислоты Реакции с одновременным участием карбоксильной и аминогруппы
Слайд 10Реакции с участием карбоксильной группы -аминокислот
Аминокислоты могут вступать в те же химические реакции и давать те же производные, что и другие карбоновые кислоты. Одна из важнейших реакций в организме – декарбоксилирование аминокислот. При отщеплении СО2 под действием особых ферментов - декарбоксилаз -аминокислоты превращаются в амины: Реакции по углеводородному радикалу: окисление, а точнее гидроксилирование фенилаланина:
Слайд 11Реакции с участием аминогруппы -аминокислот
Как и другие алифатические амины, аминокислоты могут реагировать с кислотами, ангидридами и хлорангидридами кислот, азотистой кислотой. При нагревании -аминокислот происходит реакция межмолекулярной дегидриратации с участием как амино-, так и карбоксильной группы. В результате образуется циклический дикетопиперазин.
Слайд 12Реакции дезаминирования. - окислительное дезаминирование - восстановительное дезаминирование - гидролитическое дезаминирование - внутримолекулярное дезаминирование Реакция трансаминирования.

Слайд 13Образование пептидной связи
Амино- и карбоксильные группы аминокислот могут реагировать друг с другом и без образования цикла: Возникающая при этом связь –СО–NН– называется пептидной связью, а продукт взаимодействия аминокислот – пептидом. Если в реакцию вступили 2 аминокислоты, получается дипептид; 3 аминокислоты – трипептид и т.д. Пептиды молекулярной массой не более 10 000 называют олигопептидами, молекулярной массой более 10 000 – полипептидами, или белками. Пептидные связи в составе пептидов по химической природе являются амидными. Полипептидная цепь состоит из регулярно повторяющихся участков, образующих остов молекулы, и вариабельных участков – боковых радикалов аминокислотных остатков. Началом полипептидной цепи считают конец, несущий свободную аминогруппу (N-конец), а заканчивается полипептидная цепь свободной карбоксильной группой (С-конец). Называют пептид, последовательно перечисляя, начиная с N-конца, названия аминокислот, входящих в пептид; при этом суффикс «ин» заменяют на суффикс «ил» для всех аминокислот, кроме С-концевой. Для описания строения пептидов применяют не традиционные структурные формулы, а сокращенные обозначения, позволяющие сделать запись более компактной.

Слайд 14Белки
В настоящее время общепризнанной является полипептидная теория строения белковой молекулы. Белки можно классифицировать: – по форме молекул (глобулярные и фибриллярные); – по молекулярной массе (низко- и высокомолекулярные); – по составу или химическому строению (простые и сложные); – по выполняемым функциям; – по локализации в клетке (ядерные, цитоплазматические и др.); – по локализации в организме (белки крови, печени и др.); – по возможности адаптивно регулировать количество данных белков: белки, синтезирующиеся с постоянной скоростью (конститутивные), и белки, синтез которых может усиливаться при воздействии факторов среды (индуцибельные); – по продолжительности жизни в клетке (от очень быстро обновляющихся белков, с периодом полупревращения менее 1 ч, до очень медленно обновляющихся белков, период полупревращения которых исчисляют неделями и месяцами); – по схожим участкам первичной структуры и родственным функциям (семейства белков).


Слайд 16Классификация простых белков
Альбумины. Примерно 75-80% осмотического давления белков сыворотки крови приходится на альбумины; еще одна функция – транспорт жирных кислот. Глобулины. -Глобулины содержатся в крови в комплексе с билирубином и с липопротеинами высокой плотности. Фракция β-глобулинов включает протромбин, являющийся предшественником тромбина - белка, ответственного за превращение фибриногена крови в фибрин при свертывании крови. -Глобулины выполняют защитную функцию. Протамины – низкомолекулярные белки, обладающие выраженными основными свойствами, обусловленными наличием в их составе от 60 до 85% аргинина. В ядрах клеток ассоциируются с ДНК. Гистоны также являются небольшими белками основного характера. В их состав входят лизин и аргинин (20-30%). Гистоны играют важную роль в регуляции экспрессии генов. Проламины - белки растительного происхождения, содержатся в основном в семенах злаков. Все белки этой группы при гидролизе дают значительное количество пролина. Проламины содержат 20-25% глутаминовой кислоты и 10-15% пролина. Наиболее изучены оризенин (из риса), глютенин (из пшеницы), зеин (из кукурузы), и др. Глютелины - простые белки, содержатся в семенах злаков, в зелёных частях растений. Для глютелинов характерно сравнительно высокое содержание глутаминовой кислоты и наличие лизина. Глютелины – запасные белки.

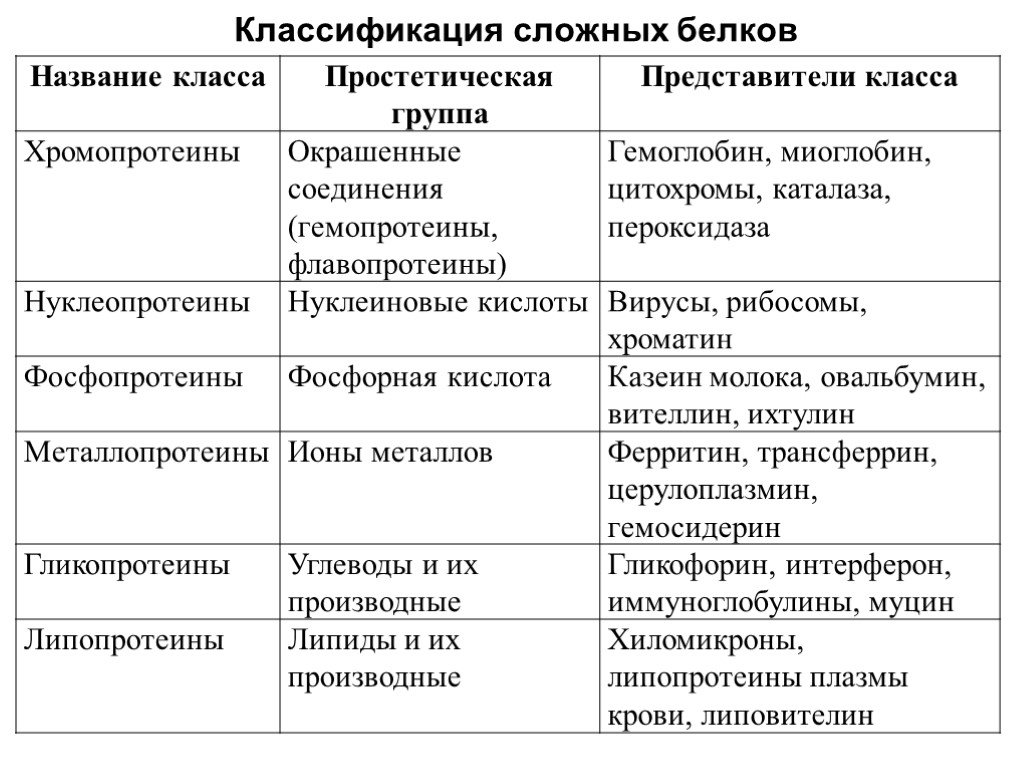
Слайд 17Классификация сложных белков
Слайд 18Первичная структура белка
Первичная структура белка – это последовательность расположения аминокислот в полипептидной цепи. Её определяют, последовательно отщепляя аминокислоты от белка путём гидролиза. Для отщепления N-концевой аминокислоты белок обрабатывают 2,4-динитрофторбензолом и после кислотного гидролиза только одна N-концевая кислота оказывается связанной с этим реактивом (метод Сэнджера). По методу Эдмана в процессе гидролиза отделяют N-концевую кислоту в виде продукта взаимодействия с фенилизотиоцианатом. Для определения С-концевой кислоты обычно используют гидролиз в присутствии специального фермента – карбоксипептидазы, которая разрывает пептидную связь с того конца пептида, где содержится свободная карбоксильная группа. Существуют и химические методы отщепления С-концевой кислоты, например с использованием гидразина (метод Акабори).
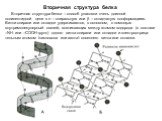
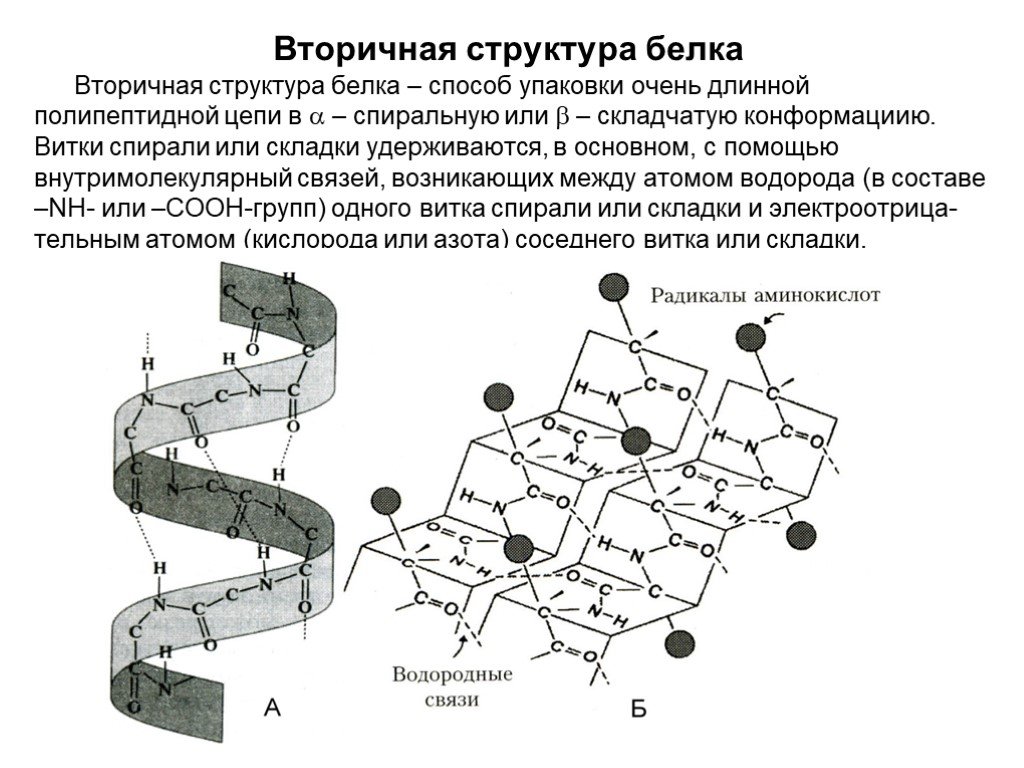
Слайд 19Вторичная структура белка
Вторичная структура белка – способ упаковки очень длинной полипептидной цепи в – спиральную или – складчатую конформациию. Витки спирали или складки удерживаются, в основном, с помощью внутримолекулярный связей, возникающих между атомом водорода (в составе –NН- или –СООН-групп) одного витка спирали или складки и электроотрица-тельным атомом (кислорода или азота) соседнего витка или складки.
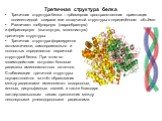
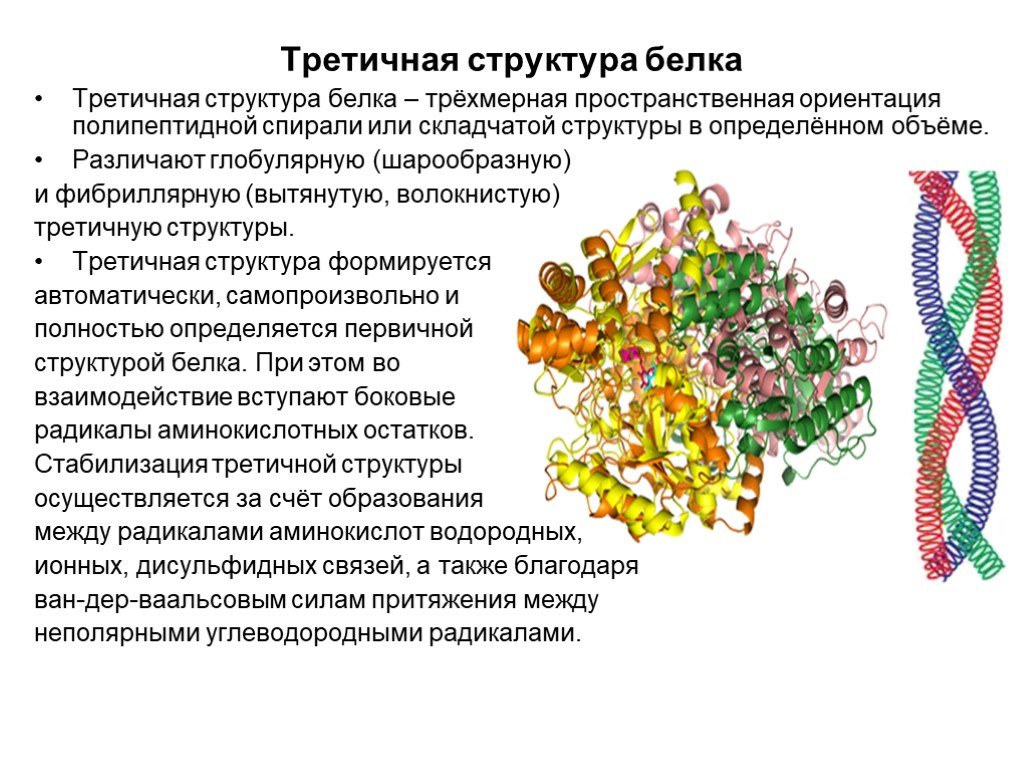
Слайд 20Третичная структура белка
Третичная структура белка – трёхмерная пространственная ориентация полипептидной спирали или складчатой структуры в определённом объёме. Различают глобулярную (шарообразную) и фибриллярную (вытянутую, волокнистую) третичную структуры. Третичная структура формируется автоматически, самопроизвольно и полностью определяется первичной структурой белка. При этом во взаимодействие вступают боковые радикалы аминокислотных остатков. Стабилизация третичной структуры осуществляется за счёт образования между радикалами аминокислот водородных, ионных, дисульфидных связей, а также благодаря ван-дер-ваальсовым силам притяжения между неполярными углеводородными радикалами.
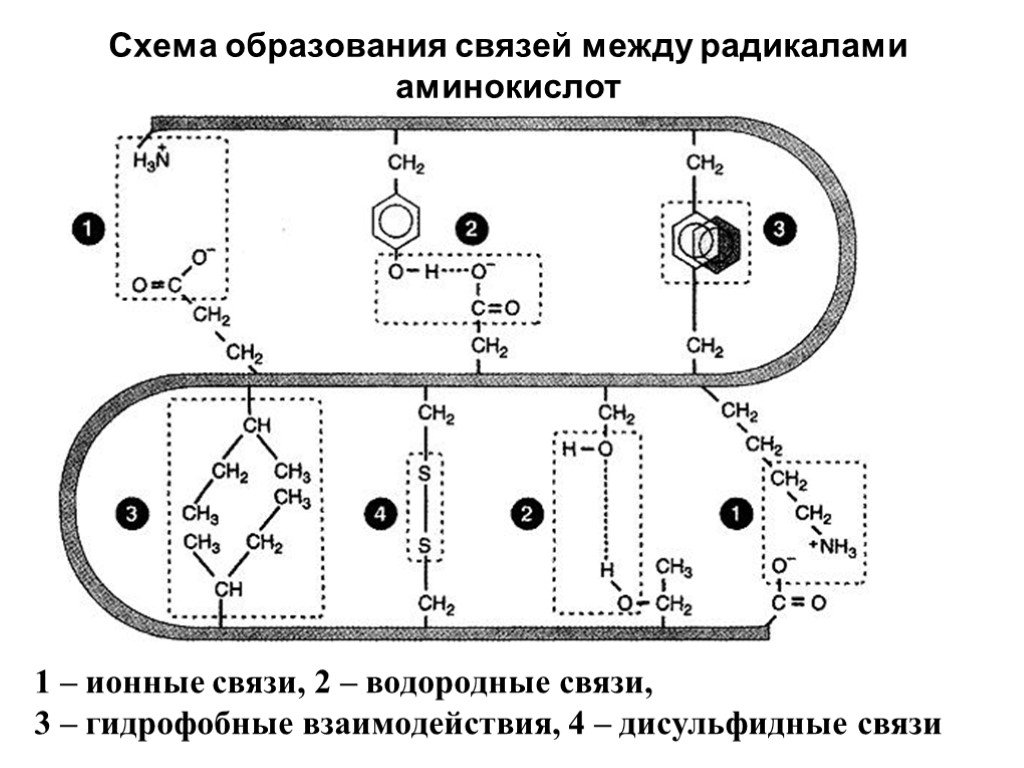
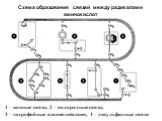
Слайд 21Схема образования связей между радикалами аминокислот
1 – ионные связи, 2 – водородные связи, 3 – гидрофобные взаимодействия, 4 – дисульфидные связи
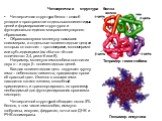
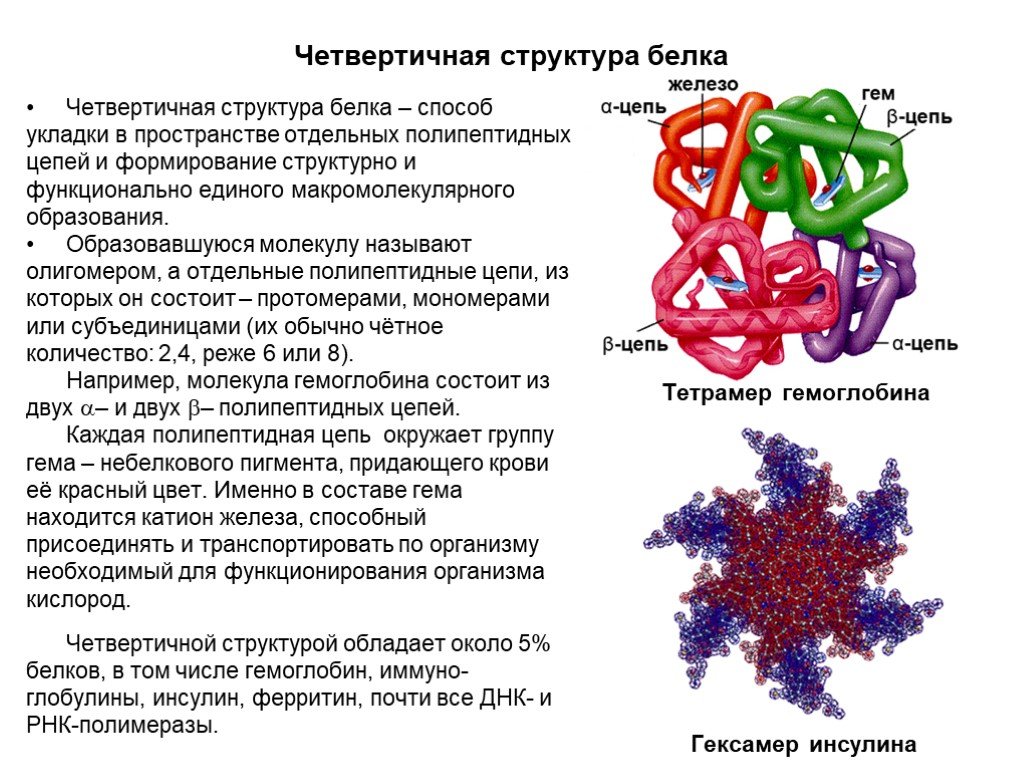
Слайд 22Четвертичная структура белка
Четвертичная структура белка – способ укладки в пространстве отдельных полипептидных цепей и формирование структурно и функционально единого макромолекулярного образования. Образовавшуюся молекулу называют олигомером, а отдельные полипептидные цепи, из которых он состоит – протомерами, мономерами или субъединицами (их обычно чётное количество: 2,4, реже 6 или 8). Например, молекула гемоглобина состоит из двух – и двух – полипептидных цепей. Каждая полипептидная цепь окружает группу гема – небелкового пигмента, придающего крови её красный цвет. Именно в составе гема находится катион железа, способный присоединять и транспортировать по организму необходимый для функционирования организма кислород. Четвертичной структурой обладает около 5% белков, в том числе гемоглобин, иммуно-глобулины, инсулин, ферритин, почти все ДНК- и РНК-полимеразы.
Гексамер инсулина
Тетрамер гемоглобина

Слайд 23Цветные реакции для обнаружения белков и аминокислот
Для идентификации пептидов, белков и отдельных аминокислот используют так называемые «цветные реакции». Универсальная реакция на пептидную группу – появление красно-фиолетовой окраски при добавлении к раствору белка ионов меди (II) в щелочной среде (биуретовая реакция). Реакция на остатки ароматических аминокислот – тирозина и фенилаланина – появление желтой окраски при обработке раствора белка концентрированной азотной кислотой (ксантопротеиновая реакция). Серусодержащие белки дают черное окрашивание при нагревании с раствором ацетата свинца(II) в щелочной среде (реакция Фоля). Общая качественная реакция -аминокислот — образование сине- фиолетового окрашивания при взаимодействии с нингидрином. Нингидриновую реакцию дают также и белки.

Слайд 24Значение белков и пептидов
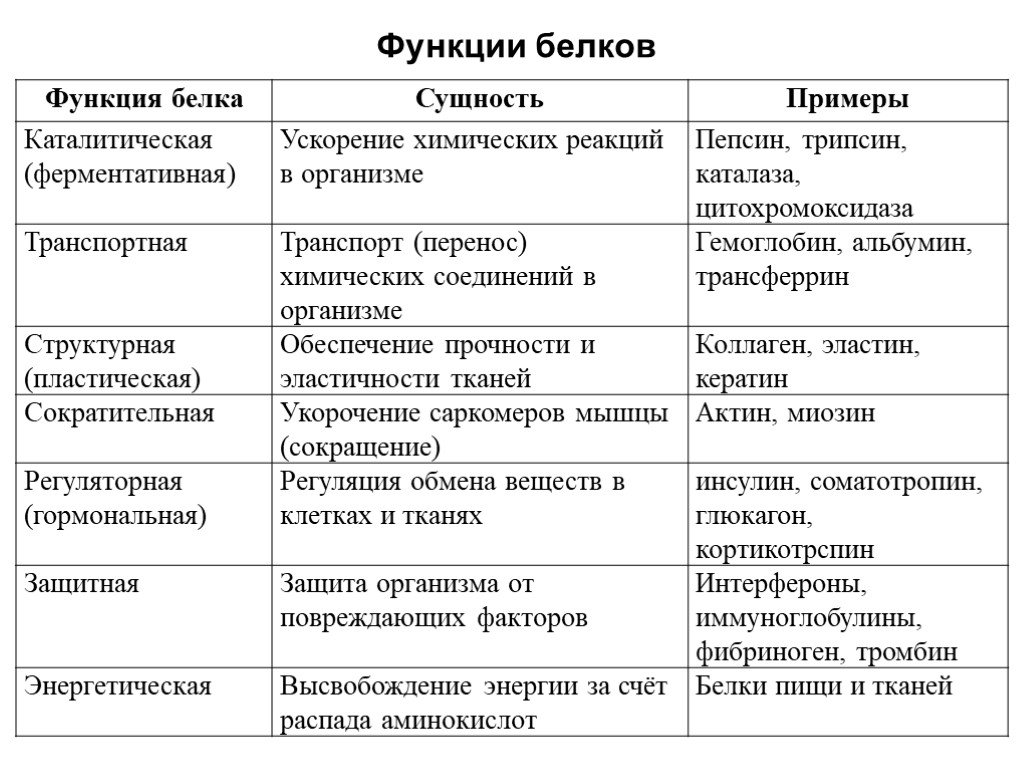
Белки составляют материальную основу химической деятельности клетки. Функции белков в природе универсальны. Среди них различают ферменты, гормоны, структурные (кератин, фиброин, коллаген), транспортные (гемоглобин, миоглобин), двигательные (актин, миозин), защитные (иммуноглобулины), запасные (казеин, яичный альбумин) белки, токсины (змеиные яды, дифтерийный токсин). В биологическом плане пептиды отличаются от белков более узким спектром функций. Наиболее характерна для пептидов регуляторная функция (гормоны, антибиотики, токсины, ингибиторы и активаторы ферментов, переносчики ионов через мембраны и т.д.). Недавно открыта группа пептидов головного мозга — нейропептидов. Они влияют на процессы обучения и запоминания, регулируют сон, обладают обезболивающей функцией; прослеживается связь некоторых нервно-психических заболеваний например шизофрении, с содержанием тех или иных пептидов в мозге. В настоящее время достигнуты успехи в изучении проблемы соотношения структуры и функций белков, механизма их участия в важнейших процессах жизнедеятельности организма, понимании молекулярных основ патогенеза многих болезней. К числу актуальных проблем относится химический синтез белка. Получение синтетическим путем аналогов природных пептидов и белков призвано способствовать решению таких вопросов, как выяснение механизма действия этих соединений в клетке, установление взаимосвязи их активности с пространственным строением, создание новых лекарственных средств и продуктов питания, а также позволяет подойти к моделированию процессов, протекающих в организме.

Слайд 25Кое-что интересное о белках
Белки являются основой разного рода биологических клеев. Так, ловчие сети пауков состоят в основном из фиброина – белка, выделяемого паутинными бородавками. Это сиропообразное вязкое вещество затвердевает на воздухе, превращаясь в прочную и нерастворимую в воде нить. Шелковинки, образующие спиральную нить паутины, содержат клей, удерживающий добычу. Сам паук свободно бегает по радиальным нитям. Благодаря специальным клеям мухи и др. насекомые способны проявлять просто чудеса акробатики. Бабочки приклеивают к листьям растений свои яйца, некоторые виды стрижей строят гнезда из застывающих выделений слюнных желез, осетровые крепят икру на придонных камнях. Некоторые виды улиток на зиму или в периоды засухи снабжают раковины специальной «дверью», которую сама улитка возводит из клейкого твердеющего протеина, содержащего известь. Отгородившись от внешнего мира достаточно твердой преградой, улитка пережидает неблагоприятные времена в раковине. Когда ситуация меняется, она просто съедает ее и перестает жить затворницей. Клеящие вещества, которыми пользуются подводные жители, должны застывать под водой. Поэтому в их состав входят несколько различных протеинов, отталкивающих воду и взаимодействующих между собой с образованием прочного клея. Клей, которым мидии прикрепляются к камню, не растворяется в воде и вдвое крепче эпоксидной смолы. Сейчас этот протеин пытаются синтезировать в лабораторных условиях. Большинство клеящих веществ не переносят влаги, а белковым клеем мидий можно было бы склеивать кости и зубы. Этот белок не вызывает отторжения организмом, что очень важно для медицинских препаратов.

Слайд 26У метилового эфира L--аспартил-L-фенилаланина очень сладкий вкус. СН3ООС—СН(СН2С6Н5)—NH—СО— СH(NН2)—СН2—СООН. Вещество известно под торговым названием «аспартам». Аспартам не только слаще сахара (в 100—150 раз), но и усиливает его сладкий вкус, особенно в присутствии лимонной кислоты. Сладки и многие из производных аcпартама. Из ягод Dioscoreophylum cumminsii (русского названия нет), найденных в дебрях Нигерии в 1895 году, выделен белок монелин, который слаще сахара в 1500 — 2000 раз. Еще сильнее — в 4000 раз — превзошел сахарозу белок тауматин, выделенный из ярко-красных мясистых плодов другого африканского растения Thaumatococcus daniellii. Интенсивность сладкого вкуса тауматина еще больше увеличивается при взаимодействии этого белка с ионами алюминия. Образующийся комплекс, получивший торговое название талин, слаще сахарозы в 35 000 раз; если же сравнивать не массы талина и сахарозы, а число их молекул, то талин окажется слаще уже в 200 тысяч раз! Еще один очень сладкий белок — миракулин был выделен в прошлом веке из красных плодов кустарника Synsepalum dulcificum daniellii, которые назвали «чудодейственными»: у пожевавшего эти плоды человека изменяются вкусовые ощущения. Так, у уксуса, появляется приятный винный вкус, лимонный сок превращается в сладкий напиток, причем эффект продолжается длительное время. Если когда-нибудь будут выращивать на плантациях все эти экзотические плоды, у сахарной промышленности будет куда меньше проблем с транспортировкой продукции. Ведь маленький кусочек тауматина сможет заменить целый мешок сахарного песка! В начале 70-х годов было синтезировано соединение, самое сладкое из всех синтезированных. Это дипептид, построенный из остатков двух аминокислот — аспарагиновой и аминомалоновой. В дипептиде две карбоксильные группы остатка аминомалоновой кислоты заменены на сложноэфирные группы, образованные метанолом и фенхолом (он содержится в эфирных маслах растений и добывается из скипидара). Это вещество в примерно в 33 000 раз слаще сахарозы. Чтобы плитка шоколада стала привычно сладкой, достаточно долей миллиграмма этой специи.

Слайд 27Химические и физические свойства кожи и волос определяются свойствами кератинов. У каждого вида животных кератин имеет некоторые особенности, поэтому это слово употребляют во множественном числе. КЕРАТИНЫ — нерастворимые в воде белки позвоночных, образующие их волосы, шерсть, роговой слой кожи, ногти. Под действием воды кератин кожи, волос, ногтей размягчается, разбухает, а после испарения воды снова затвердевает. Основная химическая особенность кератина заключается в том, что в его составе до 15% содержащей серу аминокислоты цистеина. Атомы серы, присутствующие в цистеиновой части молекулы кератина, легко образуют связи с атомами серы соседней молекулы, возникают дисульфидные мостики, которые соединяют эти макромолекулы. Кератины относятся к фибриллярным белкам. В тканях они существуют в виде длинных нитей — фибрилл, в которых молекулы расположены пучками, направленными в одну сторону. В этих нитях отдельные макромолекулы соединены между собой также химическими связями (рис. 1). Спиральные нити закручены в тройную спираль, а 11 спиралей объединены в микрофибриллу, которая составляет центральную часть волоса (см. рис. 2). Микрофибриллы объединяются в макрофибриллы. а) Водородные б) Ионные в) Неполярные г) Дисульфид- Рис. 2. Кератин волос — фибриллярный белок. связи связи взаимодействия ный мостик Рис. 1. Типы взаимодействия между цепочечными белковыми молекулами

Слайд 28Волос имеет неоднородную структуру в поперечном сечении. С точки зрения химии все слои волоса идентичны и состоят из одного химического соединения — кератина. Но в зависимости от степени и типа структурирования кератина существуют слои с различными свойствами: кутикула — поверхностный чешуйчатый слой; волокнистый, или корковый, слой; сердцевина. Кутикула образуется из плоских клеток, перекрывающих друг друга подобно рыбьей чешуе. С точки зрения косметики это наиболее важный слой волоса. Именно от его состояния зависит внешний вид волос: блеск, упругость или, наоборот, тусклость, посеченность. Состояние кутикулы влияет и на процессы окраски волос и их завивки, так как для проникновения препаратов в более глубокие слои волоса, к пигменту, необходимо размягчить кутикулу. Кератин, из которого состоят «чешуйки», разбухает под действием влаги, особенно если это сопровождается действием тепла и щелочных препаратов (мыло). С точки зрения химии это объясняется разрывом водородных связей в молекулах кератина, которые при высыхании волос восстанавливаются. При набухании пластинок их края встают вертикально, волос теряет блеск. Размягчение кутикулы уменьшает и механическую прочность волоса: во влажном состоянии его легче повредить. Пространство между краями чешуек заполнено кожным жиром, что придает волосам блеск, мягкость, эластичность. Волокнистый, или корковый, слой образован длинными веретенообразными ороговевшими клетками, расположенными в одном направлении; от него зависят эластичность и упругость волоса. В этом слое содержится пигмент меланин, «ответственный» за цвет волос. Окраска волоса зависит от присутствия в нем меланина и пузырьков воздуха. Светлые волосы содержат рассеянный пигмент, темные — зернистый. Сердцевина, или мозговой слой, состоит из не полностью ороговевших клеток.