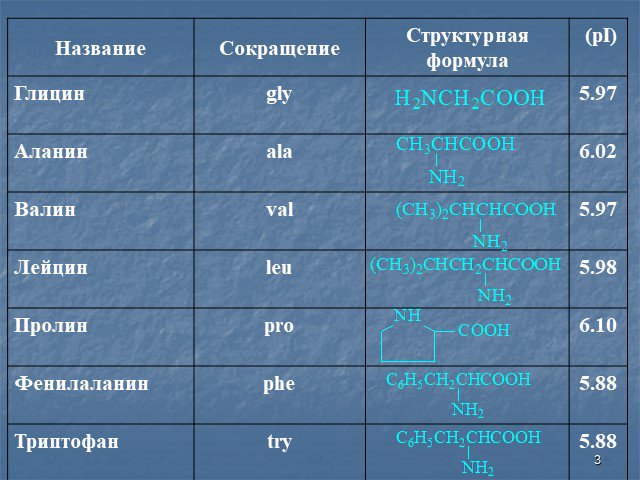
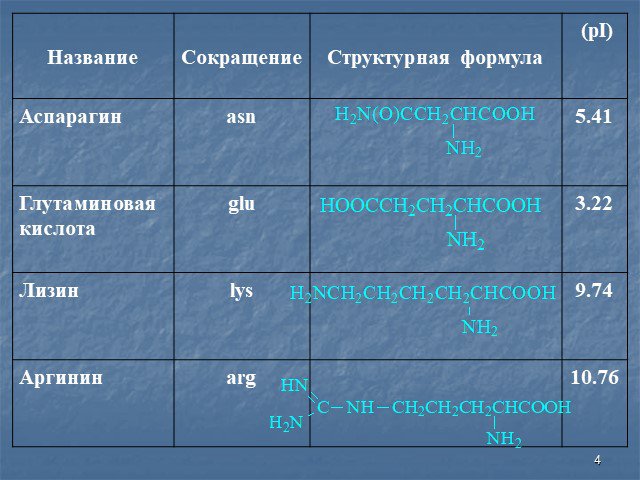
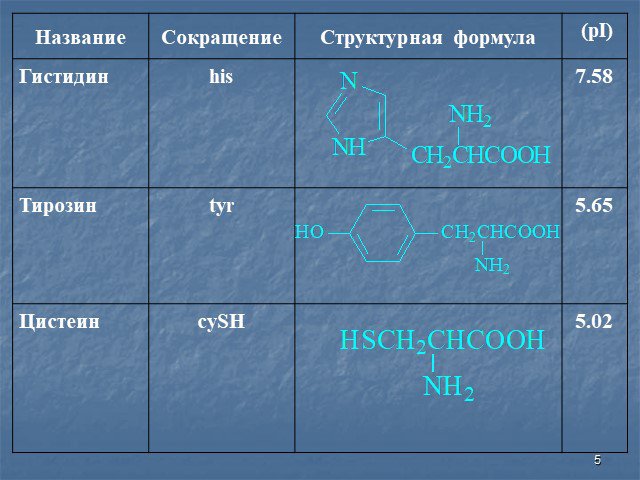
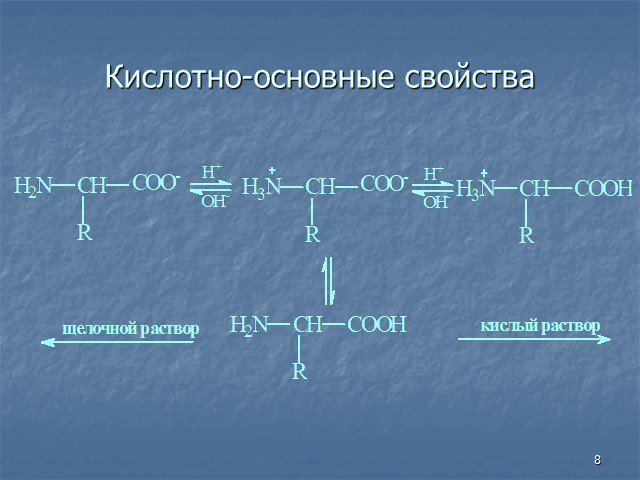
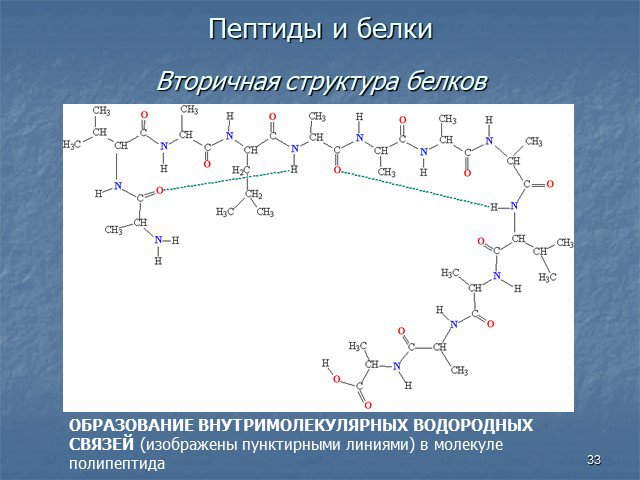
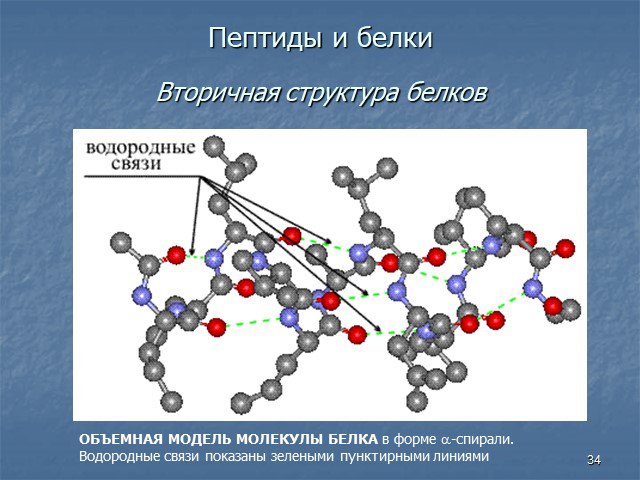
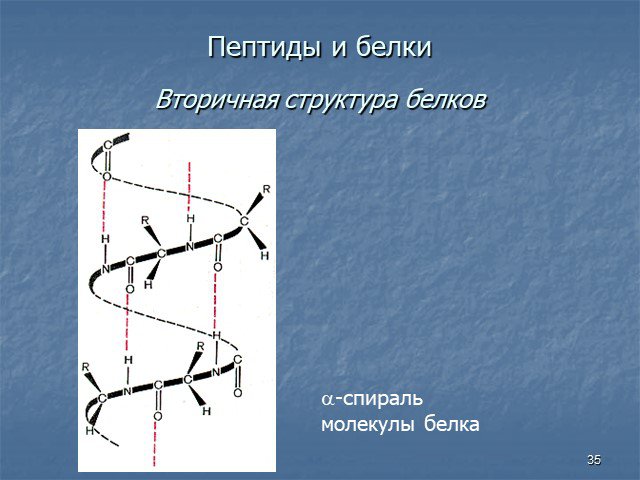
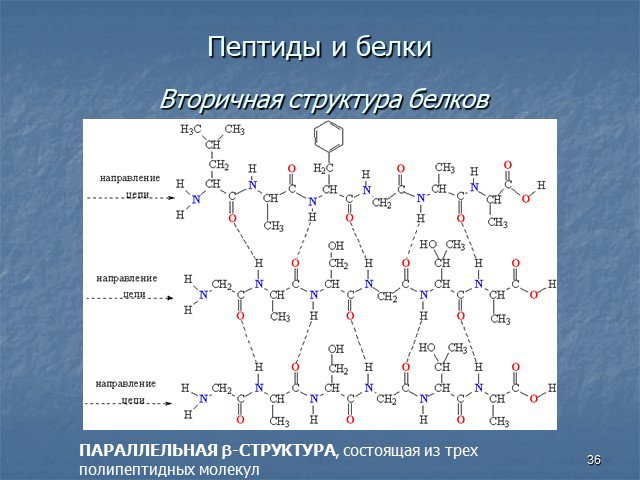
Презентация "Аминокислоты и белки. строение и свойства" по биологии – проект, доклад
Презентацию на тему "Аминокислоты и белки. строение и свойства" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Биология. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 50 слайд(ов).
Слайды презентации
Список похожих презентаций
Белки-состав, строение, свойства
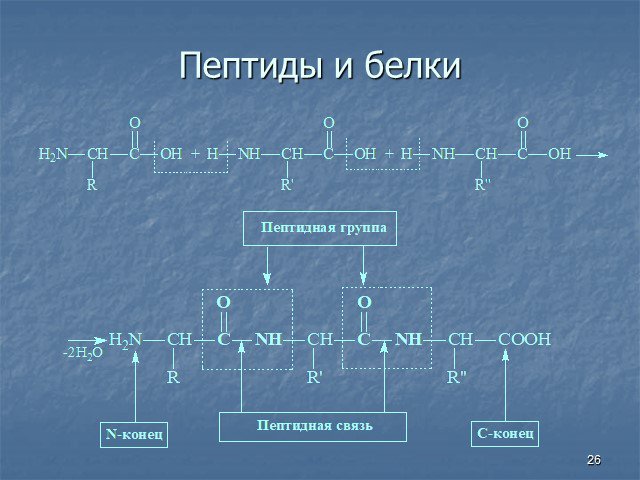
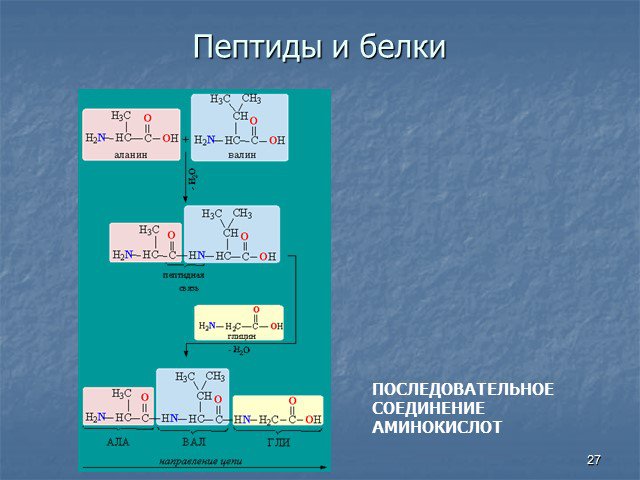
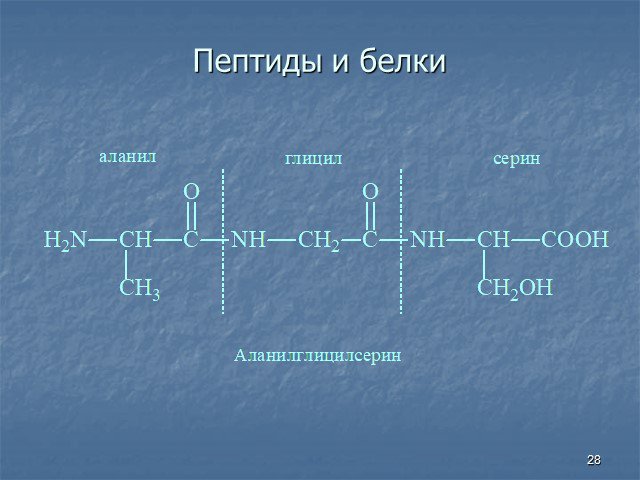
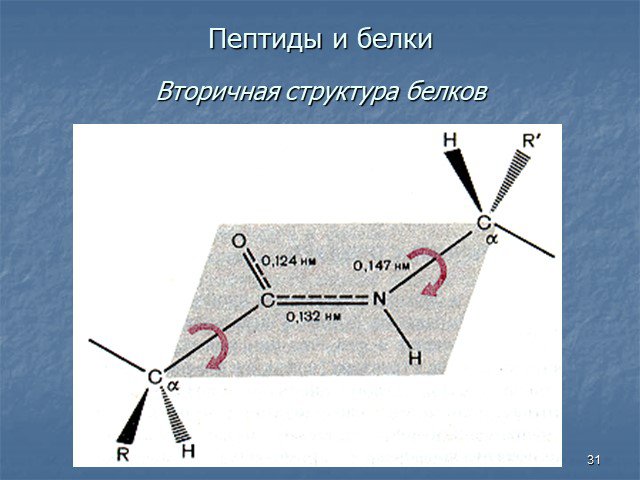
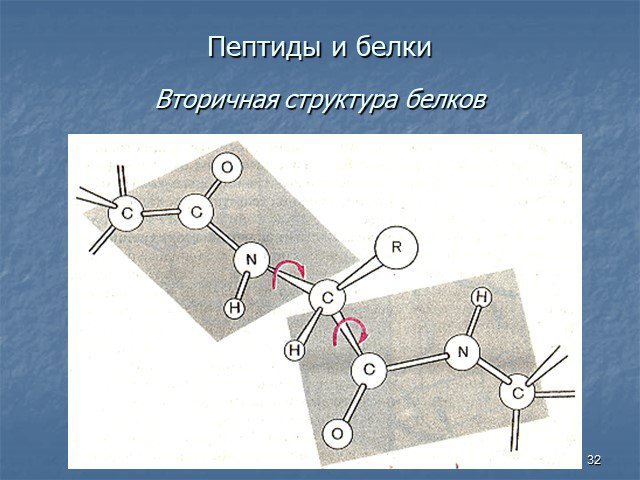
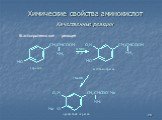
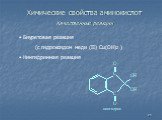
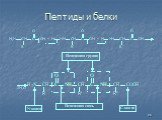
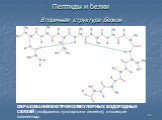
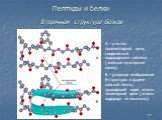
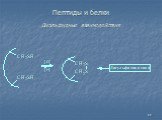
Белки - сложные высокомолекулярные природные соединения, построенные из остатков α-аминокислот. Аминокислоты в белках связаны пептидными связями. ...Белки, их строение, свойства, биологические функции
Цели урока:. Образовательная – познакомить учащихся с белками как высокомолекулярными соединениями, с их основными химическими свойствами на основе ...Биогеоценозы. экосистемы. строение и свойства
Термины. Биоценоз-сложная природная система, комплекс совместно живущих и связанных друг с другом видов («bios»-жизнь, «koinos»-общий). Надорганизменный ...Аминокислоты и белки
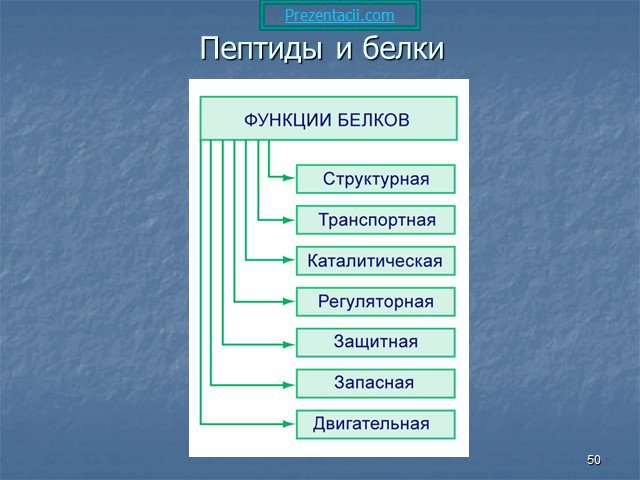
БЕЛКИ - высокомолекулярные органические вещества, построенные из остатков 20 аминокислот. Составляют основу жизнедеятельности всех органов Белки необходимы ...Клеточное строение корня
Рост проростка. Зоны корня. . Поперечный разрез корня. Тест. 1. Корень растет в длину за счет деления клеток образовательной ткани: а) верхушечной; ...Стебель внешнее и внутреннее строение стебля
Органы цветкового растения. Вегетативные корень побег стебель листья почки. Генеративные Цветок плод семена. Стебель- это осевая часть растения. Внешнее ...Семейство лилейных: строение цветка тюльпана
Загадка. На столе у нашей мамы В вазе красные ……….. Строение цветка тюльпана. Цветок тюльпана одиночный, с простым раздельнолепестным околоцветником. ...Побег и почки. Внешнее строение листа
Цели урока:. Строение побега Особенности листорасположения Строение почек Строение листовой пластинки. Листорасположение. Очередное Супротивное Мутовчатое. ...Организм и его свойства
Задание№1: Разделите данные тела на живые и неживые. Тела природы. ТЕЛА ПРИРОДЫ. ЖИВЫЕ ВЕРБЛЮД БЕЛКА ЗЕБРА ШМЕЛЬ ЛЕБЕДИ Задание №2. Сравните и выделите ...Микроскопическое строение тканей
Автор презентации. Васильева Татьяна Сергеевна, Санкт-Петербург, ГБОУ СОШ №268. Порядок выполнения работы:. Зарисовать изображения тканей, Подписать ...Кровообращение. строение и работа сердца
Задачи урока. Узнать что такое кровообращение, круги кровообращения; Выяснить строение сердце и его работу; Познакомиться со строением кровеносных ...Биополимеры – белки
Биополимеры – белки. Задачи урока. Обеспечить усвоение учащимися знаний о составе и строении аминокислот, принципе их объединения в полипептидную ...Бактерии, их строение и жизнедеятельность
БАКТЕРИИ – ЭТО ОДНОКЛЕТОЧНЫЕ ОРГАНИЗМЫ. ПРИЗНАКИ БАКТЕРИЙ: НЕТ ЯДРА. ЯДЕРНОЕ ВЕЩЕСТВО В ЦИТОПЛАЗМЕ ЕСТЬ ПЛОТНАЯ КЛЕТОЧНАЯ СТЕНКА, ИНОГДА ЖГУТИКИ. ...Бактерии строение и жизнедеятельность
Растительная клетка. Какие органоиды растительной клетки вам известны ? Вспомните. У каких организмов тело не состоит из клеток? На какие царства ...Анатомическое строение стебля
Стебель – это ось побега, несущая листья и почки. Основные функции – опорная, проводящая и связь между корнями и листьями; дополнительные: ассимиляция ...Клеточное строение организмов
Наблюдательные приборы. 1— лупа; 2 — световой микроскоп; 3 — электронный микроскоп; 4 — бинокль; 5 — телескоп; 6 — подзорная труба. Открытие клеточного ...Кожа: строение и значение
Это сложный орган со многими функциями; Масса этого органа достигает 2,7 кг; Это самый тяжёлый орган человеческого тела; Его называют “зеркалом здоровья ...Вирусы. строение и многообразие
Цели урока:. Изучить строение вируса; Рассмотреть классификацию вирусов; Познакомиться с жизненным циклом вируса и их значением. Понятие вируса. Вирус ...Лишайники: строение и практическое значение
В гостях у Берендея. Растения - симбионты. «Характеристика разных форм слоевищ». Накипной. Листовой. Кустистые. Лишайник – автогетеротрофный организм. ...Влияние подкормки на декоративные свойства петунии гибридной
Тема Изучение влияния подкормки на морфологические и декоративные свойства петунии гибридной. Актуальность проблемы:. современные агрономические исследования ...Конспекты
Белки: их строение, свойства и функции
МОУ «Куровская средняя общеобразовательная школа № 1». Интегрированный урок. по биологии и химии. в 10 классе. «Белки, их строение, ...Строение и свойства вещества
Контрольный урок по теме « Строение и свойства вещества» (5 класс).Цель урока:. . используя разнообразные задания проверить знания учащихся по теме ...Природный каучук, его строение и свойства
Калимуллина Халида Хабиловна, учитель химии МБОУ. «Средняя общеобразовательная русско-татарская школа № 87». г.Казани. Тема урока: «Природный ...Цветок и его строение
муниципальное бюджетное общеобразовательное учреждение. « Средняя общеобразовательная школа № 99». Заводского района г. Кемерово. Конспект ...Основные свойства живых организмов
. Конспект урока биологии для 6 классапо теме. . . «Основные свойства живых организмов». Мокеева Светлана Николаевна, учитель биологии. . ...Орган зрения, его строение и функции
Учитель биологии Капбасова Гульшат Беркимбаевнасш.№9,высшая категория. Тема: Орган зрения, его строение и функции. Цель урока: Изучить строение глаза. ...Обобщающий урок по теме корень, строение и функции
КГУ комплекс «Улкенбокен школа-детский сад» ВКО. Кокпектинский район. Урок биологии в 6 классе. Разработала учитель биологии-химии Болтовская Л.Л. ...Клеточное строение растений
Класс: 6. http://videouroki.net/filecom.php?fileid=98692968. Тема урока :. Клеточное строение растений. Цели урока:. . обучающие:. создать ...Клеточное строение листа
. Тема урока: Клеточное строение листа. 6 класс. Цель. : продолжить развивать понятия о клеточном строении растений, о растительных тканях, ...Внешнее и внутреннее строение лишайников
Тема урока: Внешнее и внутреннее строение лишайников. Цель. : познакомить учащихся с внешним и внутренним строением лишайников. Задачи:. Образовательные:. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 декабря 2012
Категория:Биология
Автор презентации:Неизвестен
Содержит:50 слайд(ов)
Поделись с друзьями:
Скачать презентацию