Конспект урока «Сероводород. Сульфиды» по химии
Дата_____________ Класс_______________
Тема: Сероводород. Сульфиды
Цели урока: рассмотреть сероводородную кислоту, средние соли кислоты – сульфиды.
Ход урока
1. Организационный момент урока
2. Изучение нового материала
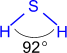
Физические свойства
Газ, бесцветный, с запахом тухлых яиц, ядовит, растворим в воде (в 1V H2Oрастворяется 3V H2S при н.у.); t°пл. = -86°C; t°кип. = -60°С.
Влияние сероводорода на организм:
Сероводород не только скверно пахнет, он еще и чрезвычайно ядовит. При вдыхании этого газа в большом количестве быстро наступает паралич дыхательных нервов, и тогда человек перестает ощущать запах – в этом и заключается смертельная опасность сероводорода.
Насчитывается множество случаев отравления вредным газом, когда пострадавшими были рабочие, на ремонте трубопроводов. Этот газ тяжелее, поэтому он накапливается в ямах, колодцах, откуда быстро выбраться не так-то просто.
Получение
1) H2 + S → H2S↑ (при t)
2) FeS + 2HCl → FeCl2 + H2S↑
Химические свойства
1) Раствор H2S в воде – слабая двухосновная кислота.
Диссоциация происходит в две ступени:
H2S → H+ + HS- (первая ступень, образуется гидросульфид - ион)
HS- → 2H+ + S2- (вторая ступень)
Сероводородная кислота образует два ряда солей - средние (сульфиды) и кислые (гидросульфиды):
Na2S – сульфид натрия;
CaS – сульфид кальция;
NaHS – гидросульфид натрия;
Ca(HS)2 – гидросульфид кальция.
2) Взаимодействует с основаниями:
H2S + 2NaOH(избыток) → Na2S + 2H2O
H2S (избыток) + NaOH → NaНS + H2O
3) H2S проявляет очень сильные восстановительные свойства:
H2S-2 + Br2 → S0 + 2HBr
H2S-2 + 2FeCl3 → 2FeCl2 + S0 + 2HCl
H2S-2 + 4Cl2 + 4H2O → H2S+6O4 + 8HCl
3H2S-2 + 8HNO3(конц) → 3H2S+6O4 + 8NO + 4H2O
H2S-2 + H2S+6O4(конц) → S0 + S+4O2 + 2H2O
(при нагревании реакция идет по - иному:
H2S-2 + 3H2S+6O4(конц) → 4S+4O2 + 4H2O)
4) Сероводород окисляется:
при недостатке O2
2H2S-2 + O2 → 2S0 + 2H2O
при избытке O2
2H2S-2 + 3O2 → 2S+4O2 + 2H2O
5) Серебро при контакте с сероводородом чернеет:
4Ag + 2H2S + O2 → 2Ag2S↓ + 2H2O
Потемневшим предметам можно вернуть блеск. Для этого в эмалированной посуде их кипятят с раствором соды и алюминиевой фольгой. Алюминий восстанавливает серебро до металла, а раствор соды удерживает ионы серы.
6) Качественная реакция на сероводород и растворимые сульфиды -образование темно-коричневого (почти черного) осадка PbS:
H2S + Pb(NO3)2 → PbS↓ + 2HNO3
Na2S + Pb(NO3)2 → PbS↓ + 2NaNO3
Pb2+ + S2- → PbS↓
Загрязнение атмосферы вызывает почернение поверхности картин, написанных масляными красками, в состав которых входят свинцовые белила. Одной из основных причин потемнения художественных картин старых мастеров было использование свинцовых белил, которые за несколько веков, взаимодействуя со следами сероводорода в воздухе (образуются в небольших количествах при гниении белков; в атмосфере промышленных регионов и др.) превращаются вPbS. Свинцовые белила – это пигмент, представляющий собой карбонат свинца (II). Он реагирует с сероводородом, содержащимся в загрязнённой атмосфере, образуя сульфид свинца (II), соединение чёрного цвета:
PbCO3 + H2S = PbS↓ + CO2 + H2O
При обработке сульфида свинца (II) пероксидом водорода происходит реакция:
PbS + 4H2O2 = PbSO4 + 4H2O,
при этом образуется сульфат свинца (II), соединение белого цвета.
Таким образом реставрируют почерневшие масляные картины.

7) Реставрация:
PbS + 4H2O2 → PbSO4(белый) + 4H2O
Получение сульфидов
1) Многие сульфиды получают нагреванием металла с серой:
Hg + S → HgS
2) Растворимые сульфиды получают действием сероводорода на щелочи:
H2S + 2KOH → K2S + 2H2O
3) Нерастворимые сульфиды получают обменными реакциями:
CdCl2 + Na2S → 2NaCl + CdS↓
Pb(NO3)2 + Na2S → 2NaNO3 + PbS↓
ZnSO4 + Na2S → Na2SO4 + ZnS↓
MnSO4 + Na2S → Na2SO4 + MnS↓
2SbCl3 + 3Na2S → 6NaCl + Sb2S3↓
SnCl2 + Na2S → 2NaCl + SnS↓
Химические свойства сульфидов
1) Растворимые сульфиды сильно гидролизованы, вследствие чего их водные растворы имеют щелочную реакцию:
K2S + H2O → KHS + KOH
S2- + H2O → HS- + OH-
2) Сульфиды металлов, стоящих в ряду напряжений левее железа (включительно), растворимы в сильных кислотах:
ZnS + H2SO4 → ZnSO4 + H2S
3) Нерастворимые сульфиды можно перевести в растворимое состояние действием концентрированной HNO3:
FeS2 + 8HNO3 → Fe(NO3)3 + 2H2SO4 + 5NO + 2H2O
3. Закрепление изученного материала
Задание №1
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Cu -> CuS -> H2S -> SO2
Задание №2
Составьте уравнения окислительно-восстановительных реакций полного и неполного сгорания сероводорода. Расставьте коэффициенты методом электронного баланса, укажите окислитель и восстановитель для каждой реакции, а так же процессы окисления и восстановления.
Задание №3
Запишите уравнение химической реакции сероводорода с раствором нитрата свинца (II) в молекулярном, полном и кратком ионном виде. Отметьте признаки этой реакции, является ли реакция обратимой?
Задание №4
Сероводород пропустили через 18%-ый раствор сульфата меди (II) массой 200 г. Вычислите массу осадка, выпавшего в результате этой реакции
4. Домашнее задание
П. 11, упр.1-2, задача 2 на стр.31
Здесь представлен конспект к уроку на тему «Сероводород. Сульфиды», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.
