Конспект урока «Электроотрицательность химических элементов» по химии
Урок.
Электроотрицательность химических элементов.
Цель урока: сформировать представление об электроотрицательности.
ЗАДАЧИ УРОКА:
-
Повторить и закрепить знания о строении атома;
-
Совершенствовать знания и умения характеризовать химические элементы.
-
Формировать умения анализировать изменение ЭО химических элементов внутри периода и группы, сравнивать ЭО атомов различных химических элементов.
-
Развивать умения делать выводы на основе изученного материала, умения работать с учебником.
-
Формирование навыков коммуникативного общения, навыков научной организации труда.
Тип урока: Усвоение новых знаний.
Методы: беседа, устный опрос, организация упражнений по применению знаний (групповая, индивидуальная), взаимопроверка, самопроверка обучающихся.
Ход урока
I Организационный момент
II Проверка изученного материала
-
Проверка д.з.
-
Индивидуальные карточки с заданиями
| . Расположите химические элементы в порядке увеличения атомного радиуса.
| |||||||||||
| Cоставьте формулы высшего оксида и летучего водородного соединения для:
|
-
Охарактеризовать строение и состав атома, а также составить электронную формулу в атоме алюминия и хлора .
III Изучение нового материала
-
Электроотрицательность химических элементов (Э.О.).
-
Знать определения понятий: «электроотрицательность», «относительная электроотрицательность»
-
Уметь анализировать изменение ЭО химических элементов внутри периода и группы.
-
Уметь сравнивать ЭО атомов различных химических элементов.
-
Уметь определять к какому атому будут смещаться электроны при образовании бинарных соединений
| В периоде слева направо: ослабление металлических через амфотерные. В гр: Сверху вниз – усиление металлических свойства. | |
| Используя текст учебника, сделайте обобщающий вывод о том, чем определяется принадлежность элементов к металлам или неметаллам. С точки зрения теории строения атомов принадлежность элементов к металлам и неметаллам определяется способностью их атомов отдавать или присоединять электроны при химических реакциях. Наиболее сильными металлическими свойствами обладают те элементы, атомы которых легко отдают электроны. Наоборот, неметаллические свойства особенно выражены v тех элементов, атомы которых энергично присоединяют электроны. Главные отличия в свойствах металлов и неметаллов в том, что металлы более склонны отдавать электроны своего внешнего электронного слоя, а неметаллы - наоборот, притягивать электроны, заполнять свой внешний слой до устойчивого октета электронов. | |
| это свойство атомов элемента оттягивать на себя электроны от атомов других элементов в соединениях называется электроотрицательнос-тью | На стр 140. |
| Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом. | |
| Для оценки способности того или иного элемента оттягивать на себя электроны пользуются относительной электроотрицательностыо (ЭО), так как абсолютная ЭО выражается неудобными числами. Относительная ЭО вычисляется относительно лития, величина абсолютной электроотрицательности которого принята за единицу. Наибольшее значение ЭО имеет элемент фтор, оно равно четырем. А элемент цезий Cs - наименьшей электроотрицательностью среди элементов 1-6 периодов. Чем больше электроотрицательность, тем сильнее притягивает к себе электроны тот или иной атом. | |
Ответьте на вопросы: Назовите элемент с максимальной ЭО; с минимальной ЭО. | Максимальная ЭО у фтора, равна 4; минимальная у цезия, равна 0,7. |
| Как изменяется ЭО в пределах периода? | ЭО закономерно изменяется в пределах периода: увеличивается слева направо от щелочного металла к галогену. В начале периода находятся элементы с минимальной ЭО, в конце - с максимальной ЭО для данного периода |
| Как изменяется ЭО в группе (в пределах главной подгруппы)? | ЭО закономерно изменяется в пределах А-группы: уменьшается сверху вниз. У галогенов (VII А-группа) ЭО фтора равна 4, ЭО йода равна 2,5. |
| Как электроотрицательность связана с атомным радиусом? | В периоде сл-напр – радиус ум, е притягиваюся сильнее, ЭО увел В групп св-вниз – радиус увел, Связь е с ядром ослабевает, способность отд е увеличивается, ЭО умен |
| Вывод: чем более типичным неметаллом является элемент, тем его ЭО выше; чем более типичным металлом является элемент, тем ниже его ЭО. | |
Закрепление 1. Используя таблицу 19 собери «команду»:
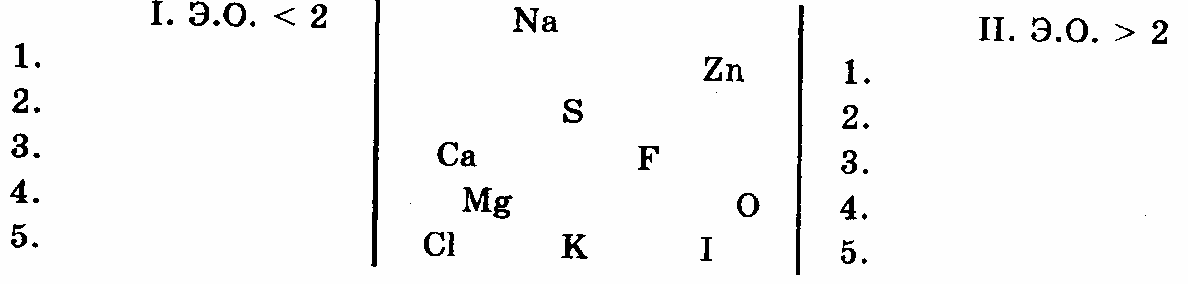
Проанализируйте составы обеих команд: команда 1 - …………………..
команда II - ……………………
I. ЭОII ЭО>2
1. Na 1. S
2. Zn 2. F
3. Ca 3. O
4. Mg 4. Cl
5.K 5. I
(В) Проанализируйте составы обеих команд: команда 1 – МЕТАЛЛЫ; команда II НЕМЕТАЛЛЫ.
Закрепление 2 В приведенных ниже формулах подчеркните атомы наиболее ЭО химического элемента:
СаСL2,
К2O,
N2,
H2S,
Al2O3.
IV Закрепление
-
Укажите к какому элементу сместятся электроны при образовании соединения:
NH3; HCl; P2O5; CH4.
NH3; HCl; P2O5; CH4.
-
С помощью знаков >или
H Cl S O Na Cl Cu O
O F Mg Al
H
O
| а) +14 и +17 Это элементы кремний и хлор. ЭО хлора больше электроотрицательности кремния, так как ОЭ химических элементов в периодах слева направо увеличивается ( атом хлора, находясь в одном периоде с атомом кремния, имеет больший заряд ядра, а следовательно сильнее притягивает электроны). б) +7 и +15 Это элементы азот и фосфор. ЭО азота больше электроотрицательности фосфора, так как ОЭ химических элементов в главных подгруппах сверху вниз уменьшается (атом фосфора , находясь в одной подгруппе с атомом азота, имеет большее число электронных оболочек , а следовательно его ядро слабее притягивает электроны). |
-
Не пользуясь таблицей электроотрицательностей, а только руководствуясь положением химических элементов в периодической таблице, расположите перечисленные элементы в порядке возрастания электроотрицательности их атомов:
а) O, P, S …………………….. б)Mg, Si, Al …………………………..
в) S, Cl, Br ……………………… г) C, Si, N ……………………………
а) P, S, O. б)Mg, Al, Si. в) S, Br, Cl. г) Si, C, N.
Домашнее задание.
Параграф 40,
1. Сравните значения ЭО элементов в парах:
бром и хлор,
кислород и углерод,
натрий и магний,
магний и литий.
2. Не пользуясь таблицей электроотрицательностей, а только руководствуясь положением химических элементов в периодической таблице, расположите перечисленные элементы в порядке возрастания электроотрицательности их атомов:
а) S, Cl, Br ………………………
б) C, Si, N ……………………………
3. Объясните причину большей электроотрицательности одного из химических элементов в паре, если известны заряды их атомных ядер:
-
а) +6 и +8…………….
-
б) +12 и +20…………
Здесь представлен конспект к уроку на тему «Электроотрицательность химических элементов», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

