Слайд 1Иммуногистохимическое исследование при раке молочной железы.
Астана, 2016г.
АО «Медицинский университет Астана» Кафедра онкологии
Проверил: Жакипбаев К.А. Подготовила: Качулина А., 143 АиГ
Слайд 2План:
ИГХ: история открытия. Возможности ИГХ. Техника проведения. Определение факторов опухолевого роста и прогрессии. Оценка результатов. Методы, выявляющие амплификацию гена (FISH, CISH). Исследование рецепторов к стероидным гормонам - эстрогенам (РЭ) и прогестерону (РП). Определение пролиферативной активности опухолевых клеток. Список литературы.

Слайд 3Иммуногистохимия (ИГХ) — это метод выявления точной локализации того или иного клеточного или тканевого компонента (антигена) благодаря связыванию его с мечеными антителами. Albert Coons в 1941 г. впервые получил меченые флюоресцеином антитела и применил их в диагностических целях. Однако большая сложность получения антител, их визуализации с низкой воспроизводимостью результатов ограничила распространение метода. В 1970 г. Ludwig Sternberger изобрёл пероксидаза-антипероксидазный метод, а в 1975 г. Georges Kuhler и Ceisar Milstein впервые добились слияния короткоживущих лимфоцитов, продуцирующих антитела, и постоянно растущих клеток плазмоцитомы и полученные, теоретически «бессмертные», культивируемые клоны гибридных клеток позволили получать разнообразные моноклональные антитела в больших количествах (в 1984 г. авторы были удостоены нобелевской премии «за открытие принципа синтеза моноклональных антител»).
Альберт Кунс (1912 – 1978)

Слайд 4В клиническом аспекте метод ИГХ анализа на современном этапе позволяет:
1) осуществлять гистогенетическую диагностику опухолей; 2) определять нозологический вариант новообразования; 3) выявлять первичную опухоль по метастазу с неизвестным первичным очагом; 4) определять прогноз опухолевого заболевания; 5) определять злокачественную трансформацию клеток; 6) определять возможности таргетной терапии; 7) выявлять как резистентность, так и чувствительность опухолевых клеток к химиотерапевтическим препаратам; 8) определять чувствительность опухолевых клеток к лучевой терапии.

Слайд 5При раке молочной железы наиболее важными прогностическими показателями являются пролиферативная активность, экспрессия эстрогенов и прогестеронов и, безусловно, экспрессия белка HER2/neu (c–erbB–2). Последняя характеристика, по данным многих исследователей, не только позволяет оценить прогноз болезни, особенно при наличии метастазов в регионарных лимфатических узлах, но и, что особенно важно, включить в лечебный комплекс новый патогенетический препарат «Герцептин» (транстузамаб) – высокоэффективный препарат направленного действия . Этот препарат представляет собой рекомбинантное гуманизированное моноклональное антитело, связывающееся с рецептором HER2/neu на поверхности опухолевых клеток. Высокая эффективность Герцептина обусловлена на только иммуноопосредованной цитотоксичностью, но и непосредственным блокированием пролиферации, стимуляцией апоптоза, антиангиогенной активностью . HER2/neu – тирозинкиназный трансмембранный рецептор из семейства ERBB, состоящего из четырех функционально связанных рецепторных молекул, играющих важную роль в клеточной дифференцировке, пролиферации, апоптозе. Под действием лигандов HER2/neu образует гетеродимеры с другими рецепторами данного семейства и регулирует работу соответствующих сигнальных каскадов . HER2/neu экспрессируется в небольшом количестве и в клетках нормальных тканей. Однако в процессе злокачественного роста происходит его гиперэкспрессия и/или амплификация кодирующего его гена, что доказывается только специальными методами исследования. Установлено, что онкопротеин c–erbB–2 суперэкспрессирован в 20–30% случаев инвазивного рака молочной железы.

Слайд 6Техника проведения:
Иммуногистохимическое исследование проводится на биопсийном и операционном материале, фиксированном 10%–м нейтральным формалином, забуференным фосфатным буфером, в течение 24 часов. Адекватность фиксации и проводки материала является важнейшим фактором получения достоверного результата иммуногистохимического исследования. Гистологическая проводка материала может осуществляться в ручном или автоматическом режиме с использованием проводящих аппаратов. После гистологической проводки материал заливается в парафин и затем готовятся срезы толщиной 4 мкм. Срезы монтируются на специальные высокоадгезивные стекла (Polysine, Histobond, Sialinised Slaid DAKO) и высушиваются в течение 18 часов при температуре 37°С.

Слайд 7Проведение исследования на цитологическом материале не допускается, т.к. количества материала недостаточно для правильной оценки. Следует подчеркнуть, что оценка результатов проводится только в инвазивном раке, т.к. структуры рака in situ, несмотря на выраженную гиперэкспрессию белка, учету не подлежат. Желательно использовать на гистологический материал опухоли, не подвергнутые предоперационной лучевой и/или химиотерапии, поэтому при планировании лечения с предоперационной терапией необходима толстоигольная трепанобиопсия и проведение иммуногистохимического исследования на этом материале. В случае отсутствия материала первичной опухоли возможна оценка гиперэкспрессии на метастатических лимфатических узлах, т.к. в метастазах герцепт–статус опухоли обычно сохраняется.

Слайд 8Иммуногистохимическое исследование (ИГХ) в ручном режиме или с использованием иммуногистостейнера рекомендуется проводить с набором реактивов, готовых к употреблению – DAKO HerceptTest. Возможно также применение концентрированных антител к белку HER2/neu (c–erbB2) и детекционной системы EnVision (DAKO). Для ИГХ определения гиперэкспрессии HER2/neu при использовании антител как в рабочем разведении, так и концентрированных антител, необходимым этапом является демаскировка антигена. Восстановление антигенной активности с помощью набора «HercepTest» проводится в водяной бане, в растворе Epitope Retrieval Solution (DAKO), pH 6,0 при температуре 95–99°С. Депарафинированные и регидратированные срезы погружают в чашку Коплина с подогретым буфером, помещают в водяную баню при температуре 95–99°С и инкубируют в течение 40 мин. Затем остужают стекла в буфере до комнатной температуры в течение 20 мин. и промывают промывочным буфером 2 мин.

Слайд 9Демаскировку антител можно также проводить в специализированном мини–автоклаве Retrival 2000 (Pick Cell) или в специальной кастрюле под давлением (DAKO) в соответствии с инструкцией к этим приборам в течение 20 мин. при температуре 121 °С или в микроволновой печке – 20 мин. при мощности 500–750 W. После демаскировки антигена приступают непосредственно к постановке ИГХ реакции, подробно описанной в ряде методических рекомендаций. Стандартизация подготовки материала и самого иммуногистохимического исследования становится важнейшим фактором, определяющим достоверность полученного результата и адекватность назначения или неназначения препарата. При использовании для исследования концентрированных антител применяется та же методика, только предварительно готовится рабочее разведение первичных антител с применением специального разбавителя антител (DAKO). Исследование всегда проводится с обязательным использованием контрольных стекол с уже известным результатом для контроля правильности реакции и качества реагентов.

Слайд 10Определение факторов опухолевого роста и прогрессии:
К факторам опухолевого роста относится HER-2/neu-белок (р185) (c-erb-B2), производство которого в норме строго регулируется геном HER-2/neu. Ген HER-2/neu локализуется в 17q-хромосоме и кодирует тирозинкиназный рецептор фактора роста, который расположен на поверхности клетки. В норме через НЕR-2/neu рецепторы организм контролирует процесс роста, деления и самовостановления здоровых клеток молочной железы. При нарушении регуляции ген HER-2/neu производит слишком много одноименных рецепторов и после связывания их с белком HER-2/neu клетка получает сигнал на неконтролируемый рост и деление, и превращается в раковую. Повышенное содержание белка HER-2/neu(р185) и амплификация гена HER-2/neu с повышенной выработкой рецептора HER-2/neu характеризует HER-2 позитивный рак молочной железы. Рак молочной железы с нормальным содержанием гена HER-2/neu, рецептора HER-2/neu и белка HER-2/neu(р185) называется HER-2 - негативным. HER-2 позитивный рак молочной железы отличается агрессивным течением, растет и распространяется быстрее, чем HER-2 негативный рак молочной железы. Блокирование HER-2/neu может существенно замедлить или остановить рост опухолей, однако эффективное использование биологически активных препаратов предусматривает предварительную оценку индивидуальной чувствительности больных к данному виду лечения, включающую использование иммуногистохимического окрашивания опухолевых тканей на белок HER-2/neu (р185) с последующей оценкой амплификации гена c-erbB-2 методом флуоресцентной гибридизации in situ (FISH).

Слайд 11Оценка результатов:
Оценка проводится с использованием светового микроскопа, в основном при увеличении объектива 10х и лишь в пограничных случаях 1+/2+ – объектива 20х. Если отмечается реакция более чем в 10% клеток при увеличении 20х, то такой результат оценивается как 1+. Учитывается только мембранное окрашивание, и никогда не принимается во внимание наличие окрашенной цитоплазмы. Цитоплазматическое окрашивание может быть связано как с ошибками в подготовке материала или в постановке реакции, так и нарушением процессов транспорта и формирования рецепторов на клеточной мембране опухолевой клетки. Хотя в этом случае наличие цитоплазматической реакции представляет несомненный научный интерес для назначения лечения герцептином, эта реакции не должна учитываться.

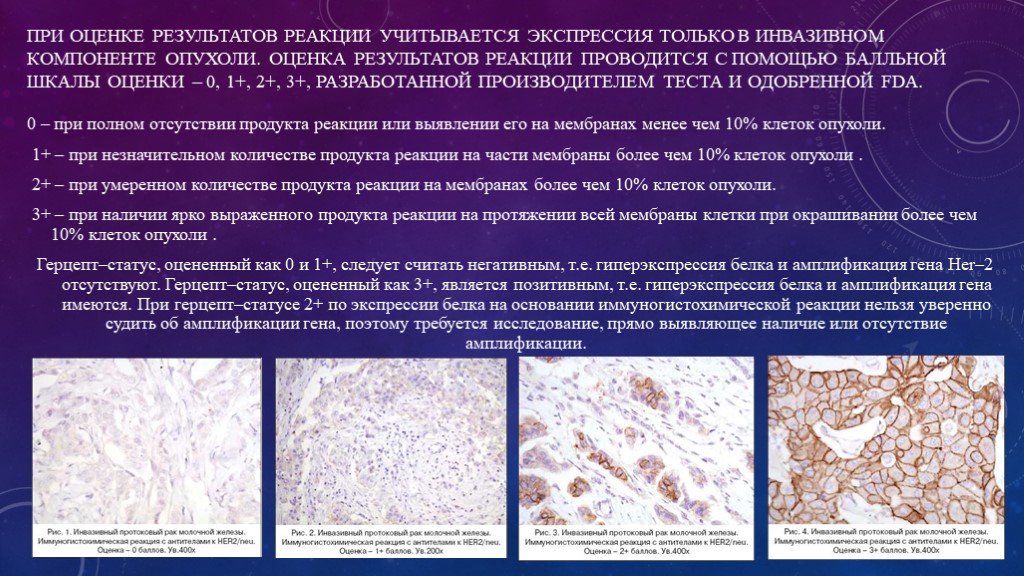
Слайд 12При оценке результатов реакции учитывается экспрессия только в инвазивном компоненте опухоли. Оценка результатов реакции проводится с помощью балльной шкалы оценки – 0, 1+, 2+, 3+, разработанной производителем теста и одобренной FDA.
0 – при полном отсутствии продукта реакции или выявлении его на мембранах менее чем 10% клеток опухоли. 1+ – при незначительном количестве продукта реакции на части мембраны более чем 10% клеток опухоли . 2+ – при умеренном количестве продукта реакции на мембранах более чем 10% клеток опухоли. 3+ – при наличии ярко выраженного продукта реакции на протяжении всей мембраны клетки при окрашивании более чем 10% клеток опухоли . Герцепт–статус, оцененный как 0 и 1+, следует считать негативным, т.е. гиперэкспрессия белка и амплификация гена Her–2 отсутствуют. Герцепт–статус, оцененный как 3+, является позитивным, т.е. гиперэкспрессия белка и амплификация гена имеются. При герцепт–статусе 2+ по экспрессии белка на основании иммуногистохимической реакции нельзя уверенно судить об амплификации гена, поэтому требуется исследование, прямо выявляющее наличие или отсутствие амплификации.

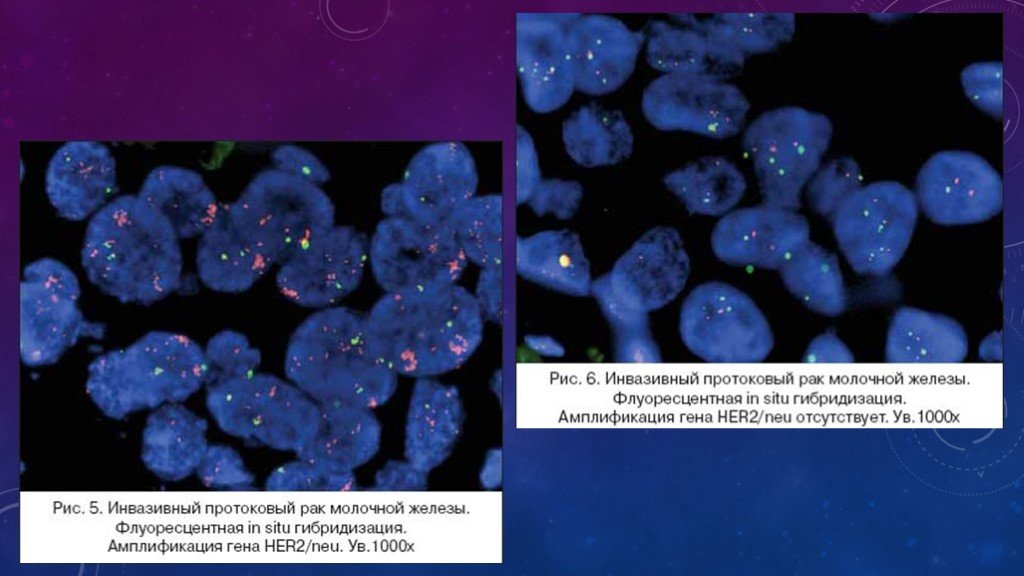
Слайд 13При использовании FISH метода требуется специализированное дорогостоящее оборудование и наборы реагентов, выпускающиеся фирмами Dako и Vysis. Оценка наличия амплификации гена HER2/neu проводится путем подсчета сигналов, которыми помечен центромерный участок 17 хромосомы, и сигналов, метящих ген HER/neu. Если их соотношение больше 2, то это свидетельствует о наличии амплификации.
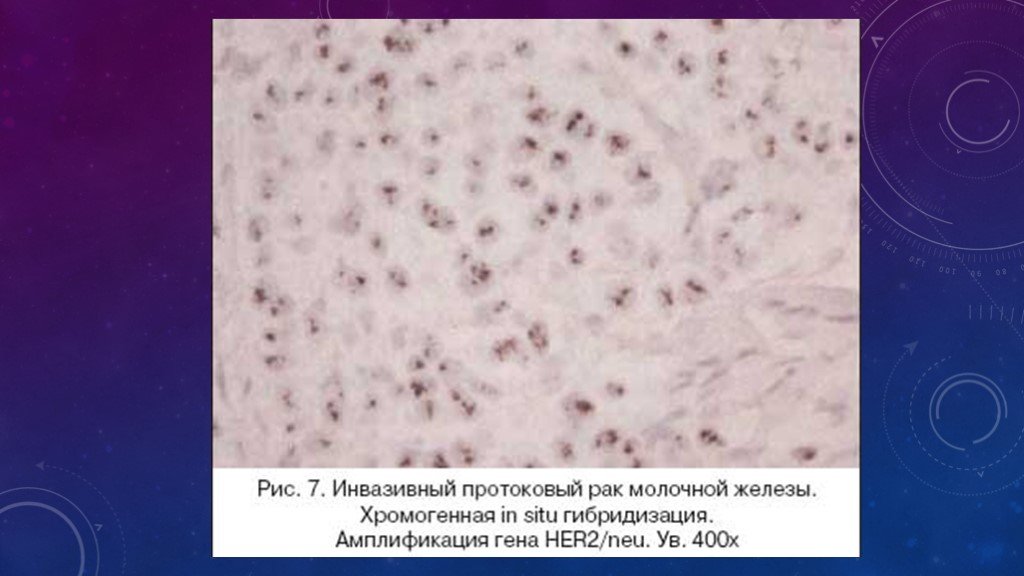
При использовании CISH метода (тест–набор фирмы Zymed) используется зонд только к гену HER2/neu и проводится подсчет сигналов, метящих только количество копий амплифицированного гена. При количестве сигналов более 6 результат оценивается как положительный. При пограничных состояниях (3–5 сигналов) применяется дополнительно еще и FISH метод, позволяющий определить количество хромосом, поскольку в опухолевых клетках возможна как анеуплоидия, так и полиплоидия.
In situ гибридизация: при использовании флуоресцентной метки – FISH (флуоресцентная in situ гибридизация) и при использовании хромогенной метки – СISH (хромогенная in situ гибридизация). Оба метода выполняются на срезах с того же образца (блока), на котором проводилось иммуногистохимическое исследование. Эти методы также чувствительны к условиям фиксации и проводки материала.

Слайд 16Исследование рецепторов к стероидным гормонам - эстрогенам (РЭ) и прогестерону (РП).
Рецепторы стероидных гормонов представляют собой белки, специфически и избирательно связывающие соответствующие стероиды, после их проникновения в клетку и опосредующие их биологические эффекты. Присутствие РЭ в первичной опухоли молочной железы свидетельствует о ее потенциальной чувствительности к лечебным мероприятиям, направленным на противодействие эффектам эстрогенов. Считается, что наличие в опухоли рецепторов к эстрогенам (РЭ) и рецепторов к прогестерону (РП) свидетельствует о ее чувствительности к экзогенным гормонам и является прогностически благоприятным фактором. РП синтезируются в клетке под влиянием эстрогенов и, следовательно, являются показателем функциональной активности РЭ. Содержание рецепторов эстрогена и прогестерона всегда выше в высокодифференцированных опухолях, а также у больных, находящихся в постменопаузе, по сравнению с женщинами репродуктивного и пременопаузального возраста. Известно, что при отсутствии гормонорецепторов в опухоли прогноз менее благоприятен и риск возникновения рецидивов выше. Показано, что в рецептор-негативных опухолях пролиферация опухолевых клеток в 10 раз активнее. В рецептор-положительных опухолях эстрогены тоже стимулируют процессы пролиферации, однако они не достигают уровня, свойственного рецептор-негативным опухолям.

Слайд 17Известно, что гормонозависимые опухоли молочной железы, содержащие оба или хотя бы один из рецепторов, имеют более благоприятное течение и лучший прогноз, независимо от проводимого адъювантного лечения, чем больные с рецептор-отрицательными опухолями. В.Ф. Семиглазов с соавт. (2001) установили, что опухоли, содержащие более 10% окрашенных на рецепторы к эстрогенам или прогестерону клеток, оказываются чувствительными к гормонотерапии. Больные, у которых опухоль не содержит рецепторов к стероидным гормонам, только в 5-10% случаев отвечают на гормональную терапию. У этих пациентов можно получить более выраженный лечебный эффект от цитостатической терапии. Прогностическое значение рецепторного статуса опухоли отражает влияние эстрогенов на характер и течение заболевания. Известно, что РЭ(+)- опухоли обладают меньшей склонностью к прогрессированию, чем РЭ(-)- опухоли, но этот факт отчетливо проявляется лишь в первые годы наблюдения и заметно сглаживается к 10-летнему сроку. Определение рецепторов к стероидным гормонам также важно для выбора тактики лечения и оценки эффективности проводимой гормонотерапии. Чувствительность опухоли к гормонам определяется сохранением в опухоли рецепторов, способных воспринять гормональный сигнал и транслоцировать его в ядро. Есть сведения о существовании различных форм рецепторов к эстрогенам и прогестерону: РЭ-альфа, РЭ-бета, РП-А и РП-B. Оба вида РЭ обладают практически одинаковым сродством к эстрадиолу. С присутствием РЭ-альфа в опухолях молочной железы связана чувствительность к тамоксифену. Рецепторы прогестерона, представленные изоформами А и В, играют различные роли в проникновении стероидов внутрь клетки. При наличии в опухоли рецепторов двух видов (РЭ и РП) эффективность метода гормонотерапии составляет 50–70%. Если присутствуют только рецепторы одного вида (РЭ или РП), то эффективность снижается до 33–39%.

Слайд 18Определение пролиферативной активности опухолевых клеток:
Маркер пролиферации Ki-67 позволяет определить "скрытый" пролиферативный потенциал опухоли (скорость деления опухолевой клетки) и судить о степени злокачественности. Выявляет только делящиеся клетки. Позитивная реакция с Ki-67 имеет обратные отношения с рецепторным статусом и является предсказательным фактором для лучевой и химиотерапии. Пролиферативная активность в опухолях молочной железы в соответствии с рекомендациями M.D. Fitzgibbons et al оценивается по градациям (≥ 1%, ≥ 10%, ≥ 20% опухолевых клеток), в связи с чем экспрессия Ki-67 более чем в 20% опухолевых клеток рассматривается как высокоагрессивная опухоль с более высокой вероятностью ответа на химиотерапевтическое лечение. При низком уровне Ki-67 и наличии позитивных рецепторов к эстрогенам и прогестерону, опухоль в большей мере отреагирует на гормонотерапию.

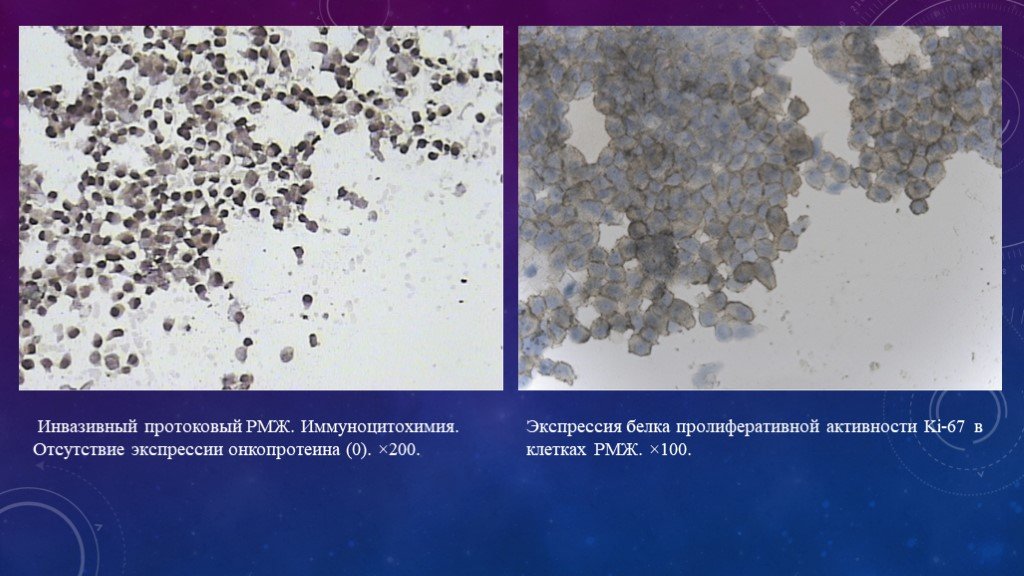
Слайд 19Инвазивный протоковый РМЖ. Иммуноцитохимия. Отсутствие экспрессии онкопротеина (0). ×200.
Экспрессия белка пролиферативной активности Ki-67 в клетках РМЖ. ×100.

Слайд 20Список литературы:
А.О. Иванц.ов, Д.Е. Мацко. «ВОЗМОЖНОСТИ ИММУНОГИСТОХИМИЧЕСКОГО ИССЛЕДОВАНИЯ В ДИАГНОСТИКЕ ОПУХОЛЕЙ». ФГБУ НИИ онкологии им. Н.Н. Петрова, Минздравсоцразвития России, Санкт/Петербург. 2011г. Завалишина Л.Э., Франк Г.А.Морфологическое исследование HER2 статуса. Методика и атлас.// М.Media Medica. – 2006. 98с. Оригинальная статья опубликована на сайте РМЖ (Русский медицинский журнал): Завалишина Л.Э., Франк Г.А. Морфологическое тестирование HER2–статуса при раке молочной железы // РМЖ. 2006. №24. Криволапов Ю. А. Первый опыт проведения внешнего контроля качества иммуногистохимических исследований в диагностике лимфопролиферативных заболеваний / Криволапов Ю. А., Пешков М. В., Леенман Е. Е. с соавт. //Арх. патол. – 2011. Герштейн Е.С., Кушлинский Н.Е. Тканевые маркеры как факторы прогноза при раке молочной железы. Практич онкол 2002. Пожарисский К.М., Леенман Е.Е. Значение иммуногистохимических методик для определения характера лечения и прогноза опухолевых заболеваний. Арх патол 2000.