Презентация "Строение атома опыт Резерфорда" по физике – проект, доклад
Презентацию на тему "Строение атома опыт Резерфорда" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 10 слайд(ов).
Слайды презентации
Список похожих презентаций
Строение атома. Опыт Резерфорда
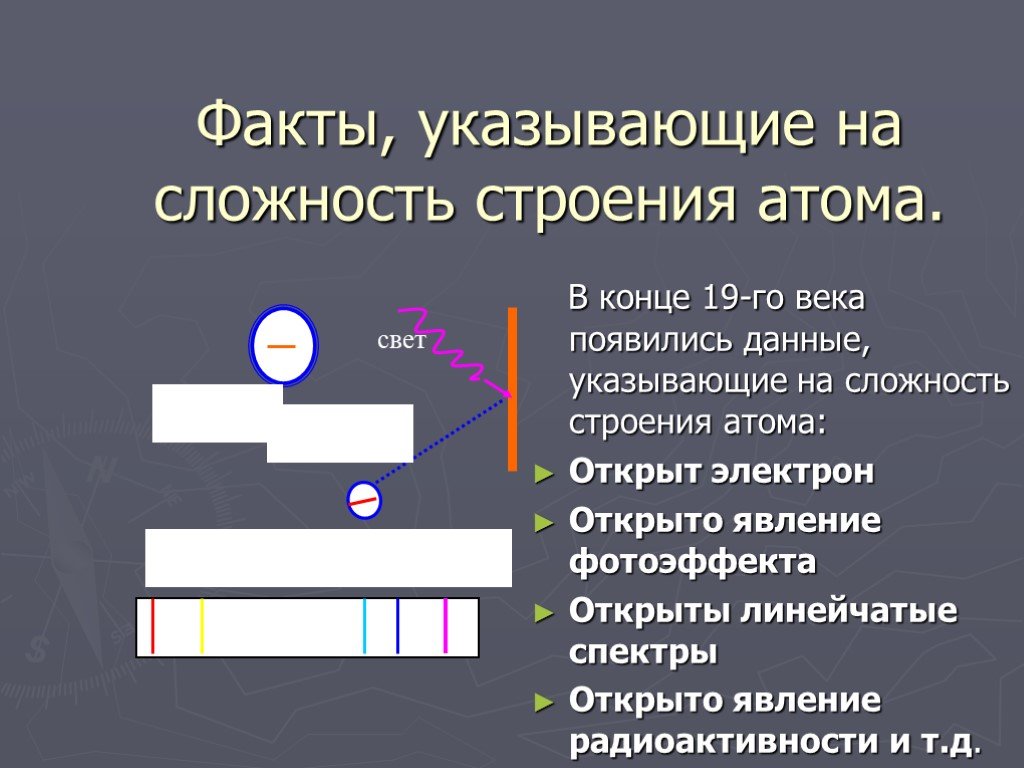
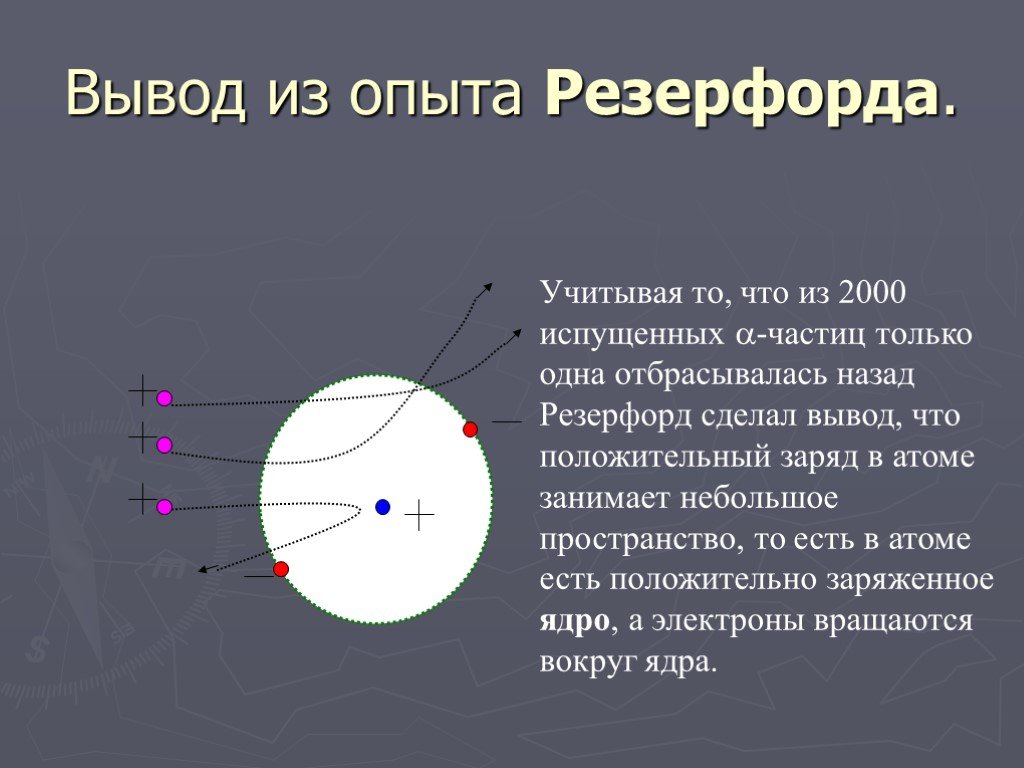
1896г. -Дж.Дж.Томсон - выдающийся ученый, директор знаменитой Кавендишской лаборатории, лауреат Нобелевской премии. открыл электрон. 1903г. - Дж.Дж.Томсон ...Строение атома. Опыт Резерфорда
Строение атома. Что знаю о строении атома. Что узнал о строении атома. АТОМ-. Наименьшая частица химического элемента, являющаяся носителем его свойств. ...Строение атома и опыты
Автор презентации «Строение атома» Помаскин Юрий Иванович - учитель физики МОУ СОШ№5 г. Кимовска Тульской области. Презентация сделана как учебно-наглядное ...Электронное строение атома
Порядок заполнения орбиталей электронами. VII – 7s5f6d7p 32 VI – 6s4f5d6p 32 V – 5s4d5p 18 IV – 4s3d4p 18 III – 3s3p 8 II – 2s2p 8 I – 1s 2. Е. p+ ...Строение атома элемента
Строение атома. Кто открыл явление радиоактивности? Кто ввел в физику термин «радиоактивность»? Какой химический элемент стал первым известным радиоактивным ...Строение атома Квантовая физика
строение атома 11 квантовая физика ФИЗИКА КЛАСС. Данный урок проводится по типу телевизионной передачи…. Квантовая физика. Строения атома. ВЫХОД. ...Строение атома и его электронных оболочек
Тема урока "Строение атома и его электронных оболочек». Цель урока: сформировать у учащихся понятия о строении атома и электронных оболочек, познакомить ...Строение атома. Квантовая теория строения атома
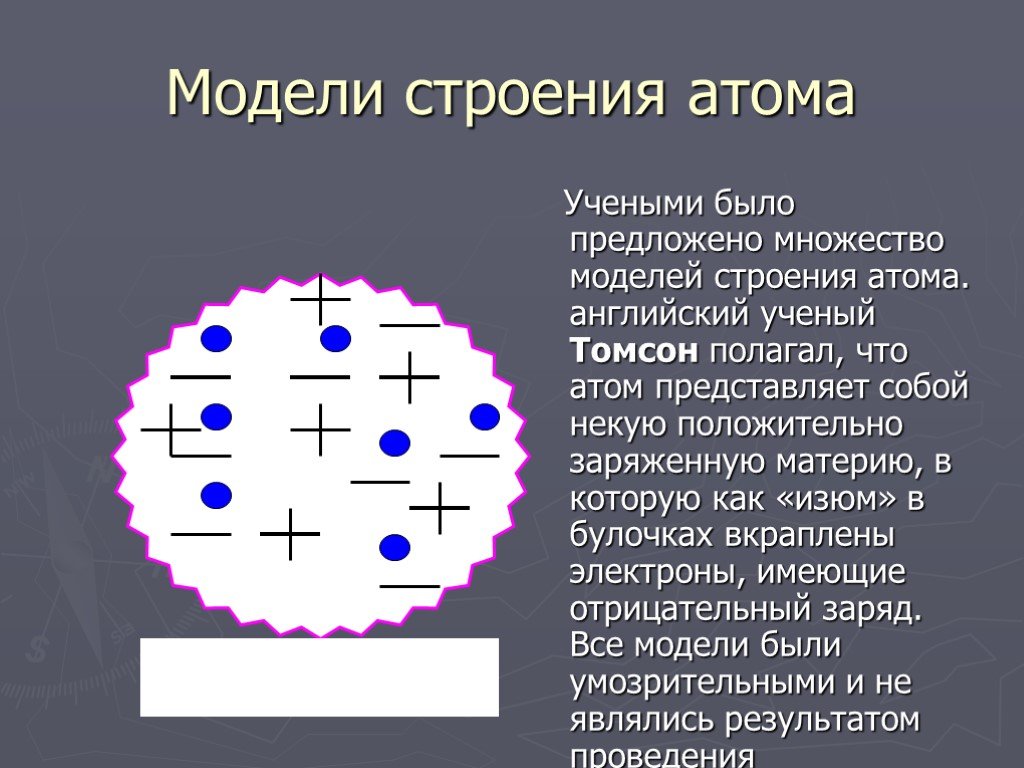
Модели атома. Модель атома Томсона Модель атома Резерфорда Модель атома Бора Модель атома Шрёдингера. Модель атома Томсона. «Пудинг с изюмом». Джозеф ...Механическая модель движения альфа-частиц в опыте Резерфорда
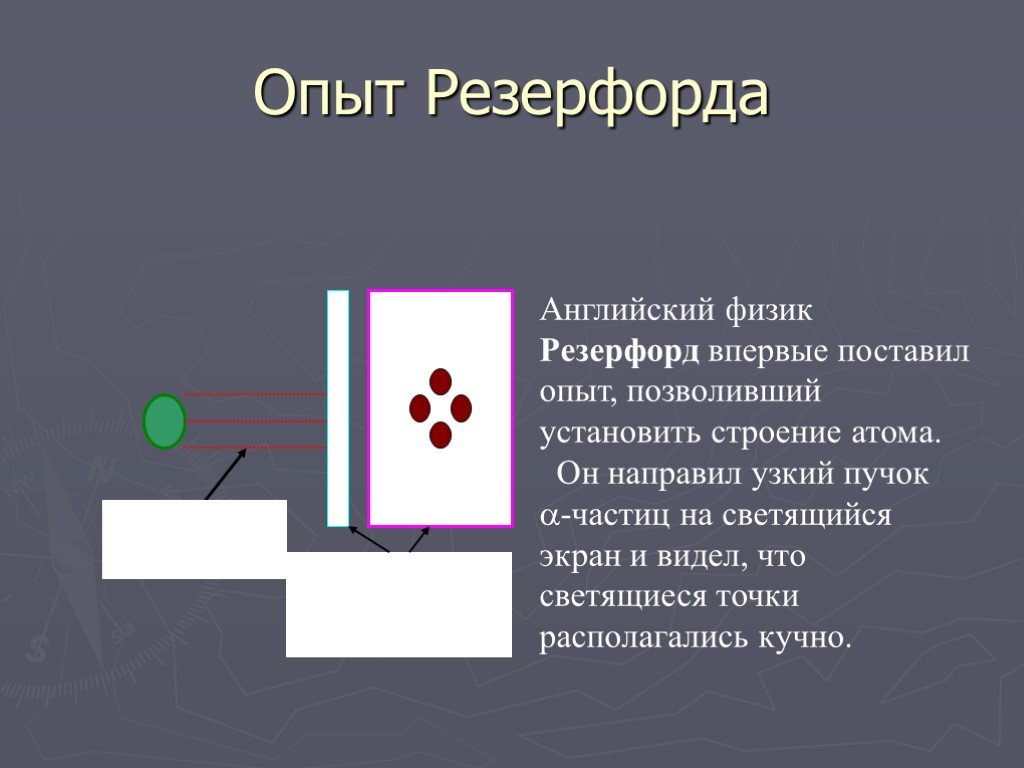
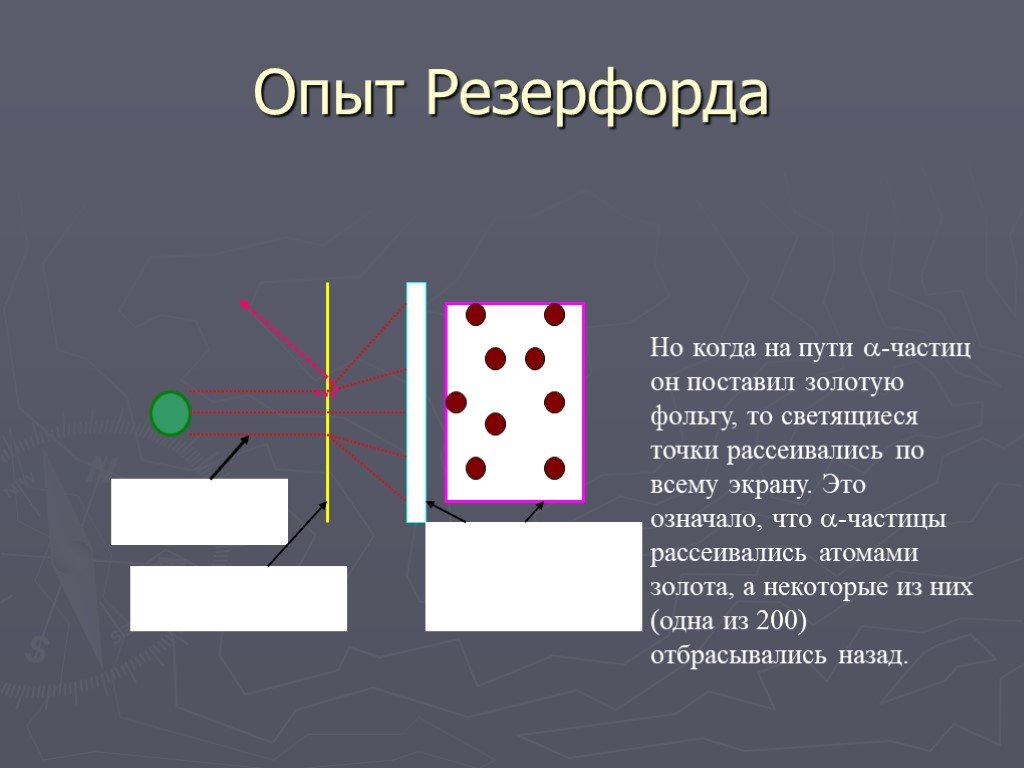
Условия опыта Резерфорда:. ОПЫТ РЕЗЕРФОРДА. 1 – радиоактивное вещество, 2 – свинцовая диафрагма, 3 – мишень, 4 – лиминесцирующий экран, 5 – микроскоп. ...Строение атома
КЛАСС Участковые Криминалисты Оперативники Эксперты - физики Следователи. Эксперты - графики. Аналитики Патологоанатомы. 1. Установление места преступления ...Строение атома
Модель атома Томсона. Джозеф Джон Томсон (1856 – 1940). Атом представляет собой непрерывно заряженный положительным зарядом шар радиуса порядка 10-10м, ...Модели атомов. Опыт Резерфорда
Проверка домашнего материала:. Как назвали способность атомов некоторых химических элементов к самопроизвольному излучению? Как были названы частицы, ...Радиоактивность . Строение атома
Левкипп Демокрит. Атом – «неделимый». 2500 лет назад. 1896 г. – открытие радиоактивного излучения «Лучи Беккереля». Анри Беккерель (1852-1908). Особые ...Строение атома
Английский физик Джозеф Джон Томсон (1856-1940). Лауреат Нобелевской Премии 1906 года. Английский физик Эрнст Резерфорд (1871 – 1937). Лауреат Нобелевской ...Опыт Резерфорда
Модель атома Томсона. Далее. ? Схема опыта Резерфорда. Фольга. Радиоактивное вещество. Скорость a- частиц - 1/30 скорости света в вакууме. На экране. ...Модель атома Резерфорда
В 1903 году английским ученым Томсоном была предложена модель атома, которую в шутку назвали «булочкой с изюмом». По его версии атом представляет ...Модели атомов Опыт Резерфорда
Гипотезы о строении вещества. Гипотеза о том, что все вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий назад. Позиция ...Электризация тел. Два ряда зарядов. Электрон. Строение атома
Как обнаружить электрические заряды? Почему гильзы разошлись? Почему… изгибается струя воды? Притягиваются легкие бумажки к палочке из стекла? Получит ...Строение вещества, молекулы
Окружающие нас тела называются физическими телами. Всё то, из чего состоят физические тела, называют веществом. Из чего состоят вещества? Тема урока:. ...Строение вещества
Из чего состоит вещество? ? Твердые тела:. -при нагревание расширяются -при охлаждении сжимаются. Газы. При нагревание расширяются При охлаждении ...Конспекты
Строение атома. Опыт Резерфорда
. Муниципальное общеобразовательное учреждение. Заозерская. средняя общеобразовательная школа. Угличского района Ярославской области. ...Строение атома: планетарная модель и модель Бора. Квантовые постулаты Бора. Принцип действия и использование лазера. Экспериментальные методы регистрации заряженных частиц
Урок № 59-169 Строение атома: планетарная модель и модель Бора. Квантовые постулаты Бора. Принцип действия и использование лазера. Экспериментальные ...Строение атома и атомного ядра
9 класс. . Урок № 8 в теме « Строение атома и атомного ядра». Ядерные силы, ядерные реакции. Энергия связи. Дефект масс. Цели урока : ...Строение атома
Тема. «Строение атома». . 8 класс. Цели для ученика:. Общая цель. :. совершенствовать. знания об электрических явлениях. Образовательные задачи. ...Строение атома
Муниципальное бюджетное общеобразовательное учреждение. «Авнюгская средняя общеобразовательная школа». Верхнетоемского района Архангельской области. ...Строение вещества. Молекулы
Конспект открытого урока по физике в 7-м классе. . Тема: "Строение вещества. Молекулы". . ЦЕЛИ:. Образовательна. я. :. Познакомить учащихся ...Строение вещества. Молекулы
План-конспект урока физики в 7 классе. по теме «Строение вещества. Молекулы». Автор:. Беркалиева Ирина Петровна,. учитель физики МОУ СОШ №2 ...Строение вещества. Молекулы
6. . . План-конспект урока физики в 7 классе. Тема: Строение вещества. Молекулы. Образовательные:. вызвать объективную необходимость изучения ...Строение вещества
Урок физики в 7 классе. Строение вещества. Цель урока:. . Сформировать у обучающихся детальное представление о строении вещества. Ход урока. ...Строение вещества
Урок-исследование. Изучение нового материала. Строение вещества. 7-й класс. . Тип урока: комбинированный урок. Цели урока: сформировать представление ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:2 ноября 2018
Категория:Физика
Содержит:10 слайд(ов)
Поделись с друзьями:
Скачать презентацию