Презентация "Модели атомов. Опыт Резерфорда" по физике – проект, доклад
Презентацию на тему "Модели атомов. Опыт Резерфорда" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 12 слайд(ов).
Слайды презентации
Список похожих презентаций
Модели атомов Опыт Резерфорда
Гипотезы о строении вещества. Гипотеза о том, что все вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий назад. Позиция ...Механическая модель движения альфа-частиц в опыте Резерфорда
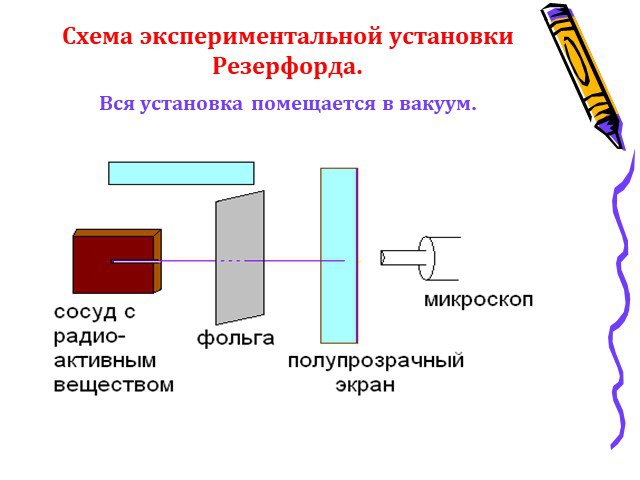
Условия опыта Резерфорда:. ОПЫТ РЕЗЕРФОРДА. 1 – радиоактивное вещество, 2 – свинцовая диафрагма, 3 – мишень, 4 – лиминесцирующий экран, 5 – микроскоп. ...Строение атома. Опыт Резерфорда
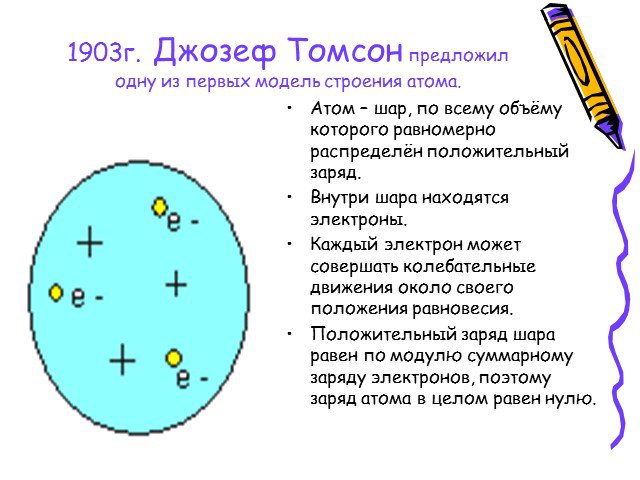
1896г. -Дж.Дж.Томсон - выдающийся ученый, директор знаменитой Кавендишской лаборатории, лауреат Нобелевской премии. открыл электрон. 1903г. - Дж.Дж.Томсон ...Опыт Резерфорда
Модель атома Томсона. Далее. ? Схема опыта Резерфорда. Фольга. Радиоактивное вещество. Скорость a- частиц - 1/30 скорости света в вакууме. На экране. ...Строение атома опыт Резерфорда
Ученые древности о строении вещества. Древнегреческий ученый Демокрит 2500 лет назад считал, что любое вещество состоит из мельчайших частиц, которые ...Строение атома. Опыт Резерфорда
Строение атома. Что знаю о строении атома. Что узнал о строении атома. АТОМ-. Наименьшая частица химического элемента, являющаяся носителем его свойств. ...Опыт Штерна
Опыт Штерна – итог…? 10 класс. БРОУН Роберт (1773-1858), английский ботаник. Описал ядро растительной клетки и строение семяпочки. В 1828 Броун опубликовал ...Опыт Торричелли
Цели урока:. Познакомиться с атмосферой, её составом и способами измерения атмосферного давления. Развивать навыки в применение различных тестирующих ...Опыт Торричелли
Стеклянную трубку Длиной около метра, запаянную с одного конца. ртуть. чаша с ртутью. "столбик" ртути примерно 76 см высотой. ...Опыт Торричели
Цель: РАСКРЫТЬ СУЩНОСТЬ ОПЫТА ТОРРИЧЕЛИ И ДОКАЗАТЬ СУЩЕСТВОВАНИЕ АТМОСФЕРНОГО ДАВЛЕНИЯ. Эванджелиста Торричелли. В 1643 году он провел опыт, помогающий ...Взаимодействие атомов элементов-неметаллов между собой
Два одинаковых атома элемента-неметалла могут объединяться в молекулу только одним способом:. обобществив свои внешние электроны, т.е. сделав их общими ...Радиоактивность как свидетельство сложного строения атомов
Радиоактивность – это способность атомов некоторых химических элементов самопроизвольно испускать невидимые лучи. Явление радиоактивности доказывает ...Опыт Паскаля
Блез Паскаль(1623-1662). Французский математик, физик и философ. Первый научный трактат написал в 16 лет. Изобрёл счётную машину. Плодотворно занимался ...Опыт Карла Рикке
Содержание. Историческая справка. Цель опыта Рикке Схема установки Результаты опыта Вывод. Рикке Карл Виктор Эдуард (1.12.1845-11.06.1915) - немецкий ...Модель атома Резерфорда
В 1903 году английским ученым Томсоном была предложена модель атома, которую в шутку назвали «булочкой с изюмом». По его версии атом представляет ...Модели строения атома
Цели и задачи. Познакомить учащихся с моделями строения атома; Выяснить принципиальные отличия в строении этих моделей; Показать с помощью экспериментальных ...Модели самолётов
АННОТАЦИЯ. Проект выполнен на основе Тематического плана по трудовому обучению учащихся 5-6х классов в разделе «Технология обработки древесины. Элементы ...Модели планеров
Словарная работа. Планер, киль, крыло, аэроплан, самолет, иллюминатор. Отгадайте загадку. Летит, как стрела, Жужжит, как пчела. Летательные аппараты. ...Особенности строения атомов
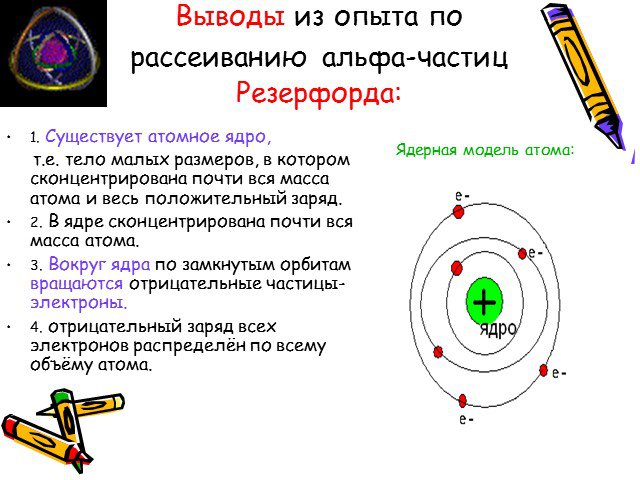
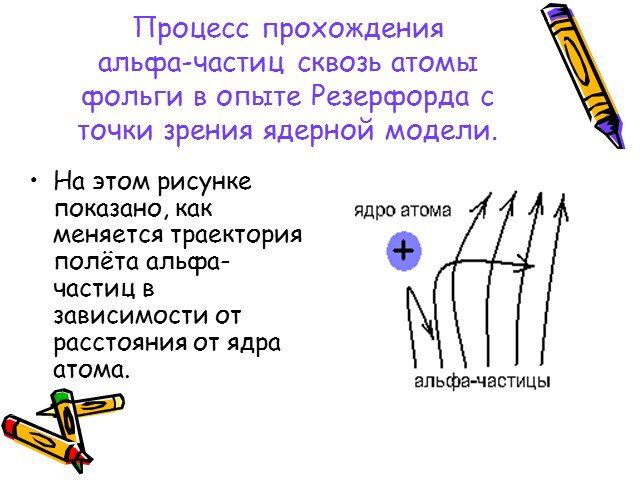
Какую модель атома предложил Томсон? Чем исследовал атом Резерфорд? Каковы результаты опыта Резерфорда? Чем можно было объяснить такие результаты? ...Отто Штерн. Опыт Штерна
Родился в Зорау (Польша), учился в Бреславле (Вроцлав). В 1933 стал профессором физики в Технологическом институте Карнеги, позднее - почётным доктором ...Конспекты
Строение атома. Опыт Резерфорда
. Муниципальное общеобразовательное учреждение. Заозерская. средняя общеобразовательная школа. Угличского района Ярославской области. ...Явление электромагнитной индукции. Модели и моделирование в среде электронных таблиц Exсel
Интегрированный урок (физика + информатика) по теме:. " Явление электромагнитной индукции. Модели и моделирование в среде электронных таблиц. Ex. ...Строение атомов
МБОУ СОШ №3 г. Навашино. Нижегородская область. УРОК ПО ФИЗИКЕ. . ТЕМА «Строение атомов». (8 класс, 13-14 лет). ...Измерение атмосферного давления. Опыт Торричелли
Измерение атмосферного давления. Опыт Торричелли. . . (Методика использования модуля открытой мультимедиа среды на уроке). Цель урока. : учащиеся ...Измерение атмосферного давления. Опыт Торричелли
Урок физики «Измерение атмосферного давления. Опыт Торричелли» 7 класс. Автор: Шепелина Светлана Леонидовна,учитель физики. ГБОУ «Чистопольская ...Атмосферное давление. Опыт Торричелли
Предмет:. Физика. Класс:. 7. УМК:. Физика. 7 класс. Учебник для учащихся общеобразовательных учреждений/ А.В. Перышкин – 15-е изд., стер. - М.:Дрофа, ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 января 2015
Категория:Физика
Содержит:12 слайд(ов)
Поделись с друзьями:
Скачать презентацию