Конспект урока «Строение атомов» по физике для 8 класса
МБОУ СОШ №3 г. Навашино
Нижегородская область
УРОК ПО ФИЗИКЕ
ТЕМА «Строение атомов»
(8 класс, 13-14 лет)
Выполнила :
учитель физики
МБОУ СОШ №3 г.Навашино
Федорова И.Ю.
г.Навашино
2012
УРОК ПО ТЕМЕ «Строение атомов» (8 класс)
ЦЕЛЬ:
- обеспечить усвоение учащимися знаний о строении атома и атомного ядра;
- сформировать умение извлекать информацию из разных источников и представлять ее в разных видах;
- расширить кругозор учащихся.
Задачи:
Обучающая:
Повторить и отработать понятия: электризация тел, электрический заряд, взаимодействие зарядов, два вида зарядов, электрическое поле, электрон, единицу электрического заряда. Побудить учащихся к объяснению строение атома и ядра, положительного и отрицательного иона, формировать у них умение осуществлять самоконтроль; осуществить синтез со знаниями, полученными на уроке химии, для формирования целостного представления об атоме.
Развивающая:
Совершенствовать навыки самостоятельной работы; развивать речь; способствовать развитию умений прослеживать междисциплинарные связи на уроке физики; способствовать развитию знаний об атоме, пробудить у учащихся интерес к научно-популярной литературе, к изучению предпосылок открытия конкретных явлений; заинтересовать процессом мышления первооткрывателей, полетом их мысли. Продолжить развитие мышления, умение анализировать, сравнивать, делать логические выводы, способствовать развитию творческих способностей учащихся, формирование универсальные учебные действия (УУД), умение учиться, способность к саморазвитию и самосовершенствованию путем сознательного и активного усвоения нового материала, формирование умений воспринимать, перерабатывать предъявлять информацию в словесной, образной, символической формах, анализировать и перерабатывать полученную информацию в соответствии с поставленными задачами, выделять основное содержание прочитанного текста, находить ответы на поставленные вопросы и излагать его;
Воспитывающая:
Способствовать развитию познавательного интереса к предмету, расширению кругозора учащихся, развитие навыков коллективной работы; развитие навыков культуры общения; толерантного отношения друг к другу; умение излагать свою точку зрения и отстаивать свою правоту; создание условий для самовыражения личности учащегося.
ОБОРУДОВАНИЕ:
Палочка эбонитовая, шерсть, таблица Менделеева, карточки с конспектом, заданиями, таблица «модели атомов», ватман, фломастеры, проектор, компьютер, экран.
ЗАПИСИ НА ДОСКЕ:
Строение атома, число.
ХОД УРОКА:
-
ОРГ. МОМЕНТ.
Здравствуйте, ребята! Приготовили к уроку все принадлежности: дневник, учебник, ручку, тетрадь. Садитесь.
2.ПОДГОТОВКА К АКТИВНОМУ И СОЗНАТЕЛЬНОМУ УСВОЕНИЮ ЗНАНИЙ.
А теперь мне хочется, чтобы вы размялись, (опыт с руками). Почему у меня получилось, а у вас нет? Физика-это наука для любознательных и наблюдательных.
Поэтому следующее задание для вас на наблюдательность.
Посмотрите ролик и ответьте, какие 3 физических термина встречаются в нем, запишите их. ( Просмотр, 15 секунд на обдумывание и запись), а теперь каждый из вас скажет по очереди в своей группе эти термины. Теперь 1 член группы назовет все термины, которые нашла его группа. ( Дети перечисляют)
Молодцы, хорошо поработали. А какие явления были показаны на видео. ( Электрические) вот их- то мы и продолжаем изучать сегодня на уроке.
Приближается новый год, а это время чудес, их вам я сейчас и покажу. ( Фокусы - бумажные домики, шарики из пенопласта, мыльные пузыри, кораблик в воде). Подумайте, 1 из группы выскажет предположения по очереди, почему так, получается, озвучьте версии вслух 1 человек. ( Электризация)
Явление электризации невозможно без объяснения строения атома. Так какова же цель нашего урока? (выяснить каково строение атома)
Учение об атомах стало важнейшей областью физики. Мир атома никто не видел, но, тем не менее, он реален. И мы с вами в течение урока должны ответить на эти вопросы, и создать свою модель строения атома. И тема сегодня на уроке такая « СТРОЕНИЕ АТОМА» (запись в тетрадь)
3.УСВОЕНИЕ НОВЫХ ЗНАНИЙ.
Для этого мы должны найти факты сложного строения вещества и в конечном итоге атома. Я вам раздаю карточки, с помощью которых мы и попытаемся сформулировать эти факты. ( карточки распределяются по рядам )В карточках описаны факты доказывающие сложное строение вещества, объясните их?
Объяснение фактов:
-
Химические реакции: C+O2=CO2.
-
Электризация.
-
Фотография кристаллическая решетки алмаза
-
Химические реакции говорят о существовании атомов, входящих в состав вещества.
-
Процесс электризации трением объясняет существование двух видов зарядов, а также тот факт, что атом электронейтрален.
-
Маленькие шарики – это атомы. Они занимают место в пространстве.
-
Выводы:( запись в тетрадь)
Вещество – молекула – атом - ?
Атом электронейтрален.
Атом имеет массу
Атом имеет размер
Итак, мы выяснили, что атом должен быть электронейтральным, но мы точно знаем, что в его состав входят отрицательные электроны в частности вы это уже узнали из курса химии, делаем вывод: внутри атома есть и положительно заряженные частицы. Что можно сказать о количестве отрицательных и положительных частиц в электронейтральном атоме? Запишем еще один вывод:
Суммарный отрицательный заряд электронов равен суммарному положительному заряду.
Что же из себя представляет атом? Каково его строение?
В начале века в физике бытовали самые разные и часто фантастические представления о строении атома. Например, Фердинанд Линдеман утверждал, что «атом кислорода имеет форму кольца, а атом серы – форму лепешки», Кельвин говорил, что атом устроен подобно кольцам дыма, выпускаемого изо рта курильщика.
Сейчас каждый из вас пройдет также этап родителя идеи. Вы все получите распечатки с описанием модели строения атома так называемых родителей (Резерфорд, Томсон, Чедвик). (В таблице приведены тексты для каждой группы.)
| Эрнест Резерфорд 30.08.1871–19.11.1937
| Джеймс Чедвик 20.10.1891–24.07.1974
| |
| Английский физик, член Лондонского королевского общества. В 1897 году экспериментально доказал существование – электрона, мельчайшей частицы, которая в 2000 раз меньше атома, определил массу и заряд электрона. В 1903–1904 годах выдвинул гипотезу, что атом представляет собой положительно заряженную сферу, внутри которой находятся электроны. Ученые назвали эту модель “пудингом с изюмом” | Английский физик, основоположник ядерной физики, член Лондонского королевского общества. В 1911 году экспериментально обосновал ядерную модель атома: в центре атома находится положительное ядро, а вокруг него вращаются электроны. В 1919 году осуществил опыт, в котором из ядра вылетали ядра водорода, получившие названия протонов, имеющие положительный заряд | Английский физик – экспериментатор, член Лондонского королевского общества. В 1920 году подтвердил теорию атома Резерфорда и вывод о том, что заряд ядра равен порядковому номеру элемента. В 1932 году обнаружил частицы, которые отличаются от протонов электрическими свойствами, но очень близки к ним по массе и размеру. Он назвал эти частицы нейтронами. И доказал, что ядра атомов тоже делимые! Они состоят из протонов и нейтронов, которые связаны между собой мощным ядерным воздействием. |
Сначала каждый из вас внимательно читает текст.
У вас на столе есть набор: белый лист (А3), фломастеры. По описанию в тексте создайте модель атома на большом листе.
Расскажите о своей модели другим группам. (Каждая группа представляет свою модель у доски, предварительно прикрепив ее.)
Перед нами три модели, которые созданы по описанию ученых.
А сейчас сравним каждую модель с реальной моделью атома
Найдем ошибки или недочеты в ваших моделях.
Итак, что мы можем сказать?
По своему строению атом напоминает Солнечную систему, поэтому атомная модель называется планетарной.
Что находится в атоме между ядром и электроном? (эл. поле)
вывод.( готовые конспекты раздать)
Атом состоит из ядра и электронов. Ядро состоит из протонов и нейтронов. Заряд протона равен по модулю заряду электрона. Нейтрон не имеет заряда. Масса протона приблизительно равна массе нейтрона.(запись в тетрадь)
Атомы разных элементов в обычном состоянии отличаются друг от друга числом электронов. Но все же химические свойства атома определяются зарядом ядра. Посмотрим на таблицу Менделеева: порядковый номер показывает число протонов в ядре, следовательно, он показывает и число электронов, т.к. атом в целом нейтрален. А число нейтронов, входящих в ядро можно найти таким образом: из массового числа вычесть число протонов.
Например: Кислород, порядковый номер – 8 – число протонов 8, число электронов 8, а число нейтронов найдем, если вычтем из 16-8=8
А теперь встаньте ребята и подойдите ко мне. Давайте с вами построим модель атома кто- то из вас будет одними частицами, кто-то другими.
1.Задание каждой группе:
1 - создать модель атома гелия (лития);
А теперь у нас остались ребята, которые не участвовали в модели, я попрошу их подойти к электронам.
4. ПЕРВИЧНАЯ ПРОВЕРКА ЗНАНИЙ. А теперь вопрос - правильно ли мое утверждение, что атом остался электрически нейтральным. ( нет), а если уберем все электроны, то какой заряд преобладает у атома (+)
Такие атомы называют ионами, итак, что такое ион? Посмотрим учебник на стр.69.
Работа на местах по группам: задание для закрепления материала:
Лист с заданием из выражений: вычеркнуть лишнее (неверное). Поменяйтесь листами и проверьте задание соседней группы.
Явление электризации невозможно без объяснения строения атома. Так я начинала свой урок, так чем же объясняется те опыты, которые я вам демонстрировала в начале урока? (подвижностью электронов)
5.РЕФЛЕКСИЯ
Ребята вам понравилось занятие? Нарисуйте на смайликах свое отношение к уроку, (Удовлетворены ли занятием).
Так что же мы узнали?
Вещества состоят из молекул, молекулы из атомов, атомы из ядра, вокруг которого вращаются электроны.
Ядро в свою очередь состоит из протонов и нейтронов.
Протоны заряжены положительно, электроны отрицательно.
В атоме число электронов равно числу протонов.
6. ДОМ. ЗАДАНИЕ: §30, упражнение.11.
Творческое задание по желанию:
1.Представьте себя каким-либо физическим объектом – атомом, электроном– и напишите небольшой рассказ о своем состоянии, окружении и о том, что происходит с вами, что вы наблюдаете.
Тысячи неразгаданных тайн таит в себе физика, и без вас, и без вашей молодости, смелости, энтузиазма, они не будут разгаданы.
Поэтому хочется закончить урок словами Брюсова
Быть может эти электроны-
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков!
Еще быть может, каждый атом-
Вселенная, где сто планет,
Там все, что здесь в объеме сжатом,
Но так же то, чего здесь нет.
Дополнительно
-
Во что превратится атом натрия, если «убрать» из его ядра один протон, не изменяя количество электронов?
-
Что имеет большую массу: атом лития или положительный ион лития? Атом хлора или отрицательный ион хлора?
-
Может ли атом водорода или другого вещества лишиться заряда, равного 0,5 заряда электрона?
Список литературы:
-
Перышкин А.В. физика 8 М.:Дрофа,2008
-
Интернет ресурсы.
-
http://cendomzn.ucoz.ru/index/0-15783
Приложение
-
Химические реакции: C+O2=CO2.
-
Электризация.
-
Фотография кристаллическая решетки алмаза.
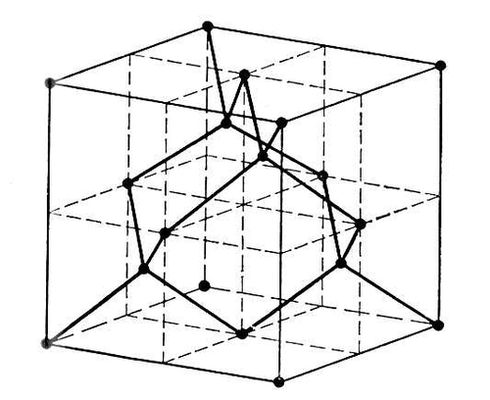 кристаллическая решетка алмаза
кристаллическая решетка алмаза
| Эрнест Резерфорд 30.08.1871–19.11.1937
| Джеймс Чедвик 20.10.1891–24.07.1974
| |
| Английский физик, член Лондонского королевского общества. В 1897 году экспериментально доказал существование – электрона, мельчайшей частицы, которая в 2000 раз меньше атома, определил массу и заряд электрона. В 1903–1904 годах выдвинул гипотезу, что атом представляет собой положительно заряженную сферу, внутри которой находятся электроны. Ученые назвали эту модель “пудингом с изюмом” | Английский физик, основоположник ядерной физики, член Лондонского королевского общества. В 1911 году экспериментально обосновал ядерную модель атома: в центре атома находится положительное ядро, а вокруг него вращаются электроны. В 1919 году осуществил опыт, в котором из ядра вылетали ядра водорода, получившие названия протонов, имеющие положительный заряд | Английский физик – экспериментатор, член Лондонского королевского общества. В 1920 году подтвердил теорию атома Резерфорда и вывод о том, что заряд ядра равен порядковому номеру элемента. В 1932 году обнаружил частицы, которые отличаются от протонов электрическими свойствами, но очень близки к ним по массе и размеру. Он назвал эти частицы нейтронами. И доказал, что ядра атомов тоже делимые! Они состоят из протонов и нейтронов, которые связаны между собой мощным ядерным воздействием. |
Здесь представлен конспект к уроку на тему «Строение атомов», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Физика (8 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.




