Слайд 1Теплотехника 190603 Сервис транспортных и технологических машин и оборудования (Автомобильный транспорт)
Презентация учебного курса Составил доцент кафедры СТЭА, Юхименко Владимир Федорович Курс читается студентами в течение 1 семестра в объеме 64 часа аудиторных занятий (32 часа лекций, 16 часов лабораторных работ и 11 часов практических занятий) и 36 часов для самостоятельного изучения материала.
Слайд 2Введение
«Теплотехника» является общеинженерной дисциплиной, позволяющей сформировать у студентов современное представление о методах получения, преобразования, передачи и использования тепловой энергии, а также о машинах и аппаратах, в которых тепловые процессы происходят. Изложены основные законы термодинамики и тепломассообена, свойства рабочих тел, термодинамические процессы, термодинамические циклы тепловых двигателей и холодильных машин; приведен анализ работы компрессора, основы расчета теплообменных аппаратов, вопросы энергосбережения, системы теплоснабжения.

Слайд 3Цели и задачи изучения дисциплины
Теоретически и практически подготовить будущих специалистов методам получения, преобразования, передачи и использования теплоты в такой степени, чтобы они могли выбирать и эксплуатировать необходимое технологическое оборудование при максимальной экономии топливно-энергетических ресурсов и материалов, интенсификации технологических процессов и выявления использования вторичных энергоресурсов , защиты окружающей среды.

Слайд 4Знания, умения и навыки, которые должен приобрести студент в результате изучения дисциплины.
Студент должен знать основные законы термодинамики и теплообмена, способы переноса теплоты, принципы действия и устройство теплообменных аппаратов, теплосиловых установок и других теплотехнических устройств, применяемых на транспорте; уметь рассчитывать термодинамические процессы и циклы, теплообменные процессы, аппараты и другие технические устройства, определять меры по тепловой защите и организации систем охлаждения; иметь навык в проведении теплотехнических исследований.

Слайд 5РАЗДЕЛ 1. Техническая трмодинамика.
ТЕМА № 1. Предмет технической термодинамики. Рабочие тела. 1.1. ТЕХНИЧЕСКАЯ ТЕРМОДИНАМИКА КАК ТЕОРЕТИЧЕСКАЯ ОСНОВА ТЕПЛОЭНЕРГЕТИКИ В классической (феноменологической) термодинамике изучаются законы взаимных превращений различных видов энергии. Техническая термодинамика рассматривает закономерности взаимного превращения теплоты и работы. Здесь разрабатывается теория тепловых двигателей и даются пути их усовершенствования. Коэффициент использования топлива в большинстве отраслей промышленности обычно не превышает 30 ... 35%. В связи с этим в настоящее время ставится вопрос о создании энерготехнологических агрегатов, в которых требования технологии и энергетики взаимно дополняли бы друг друга.

Слайд 6Разработать энерготехнологию, создать нетрадиционные и усовершенствовать существующие системы энергосбережения, оценить их эффективность можно лишь с помощью термодинамического анализа. Поэтому для инженера–энергетика термодинамика является теоретической основой его практической деятельности. При изучении термодинамики особое внимание следует уделить усвоению термодинамического метода исследования, который имеет следующие особенности. Во–вторых, термодинамика имеет дело только с макроскопическими величинами. Микроструктура веществ здесь не рассматривается. Это с одной стороны обеспечивает достоверность общих выводов термодинамики, а с другой – приводит к некоторой ее ограниченности и требует привлечения дополнительных сведений из физики, химии и т.д. И, наконец, описание процессов в термодинамике основывается на понятии о макроскопическом равновесии. Процессы здесь рассматриваются как непрерывная последовательность состояний равновесия (квазистатические процессы).

Слайд 71.2. ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ СОСТОЯНИЯ Каждое равновесное состояние термодинамической системы характеризуется определенными физическими величинами – равновесными параметрами состояния. Внутренние параметры характеризуют внутреннее состояние системы. К ним относятся давление, температура, объем и др. Внешние параметры характеризуют положение системы (координаты) во внешних силовых полях и ее скорость. Внутренние параметры, в свою очередь, подразделяются на интенсивные и экстенсивные. Интенсивные – это те параметры, величина которых не зависит от размеров (массы) тела. Например, давление, температура, удельный объем, но не объем, удельная теплоемкость. Экстенсивные параметры зависят от количества вещества в системе (объем, масса и др.). В термодинамике существует также деление параметров на термические (давление, температура, объем) и калорические (удельная энергия, удельная теплоемкость, удельные скрытые теплоты фазовых переходов).

Слайд 8Для характеристики конкретных условий, в которых находится данная система, или процесса, идущего в системе, необходимо, прежде всего, знать такие внутренние параметры состояния, как удельный объем, абсолютное давление, абсолютная температура. Удельный объем (v, м3/кг) – это объем единицы массы или величина, определяемая отношением объема к его массе , (1.1) где V – объем произвольного количества вещества, м3; т – масса этого вещества, кг. Величина, обратная удельному объему, называется плотностью (r, кг/м3); или это есть масса вещества, содержащаяся в единице объема. (1.2)

Слайд 9Давление – величина, определяемая отношением силы (нормальной составляющей силы), действующей на поверхность, к площади этой поверхности (р, Па=Н/м2), (1.3) где Fн – нормальная составляющая силы, Н; S – площадь поверхности, нормальной к действующей силе, м2. Согласно Международной системе единиц (СИ) давление замеряют в Ньютонах на один квадратный метр (Н/м2). Эта единица измерения давления называется Паскалем (Па). Один мегапаскаль равен 106 Па (1 МПа = 106 Па).

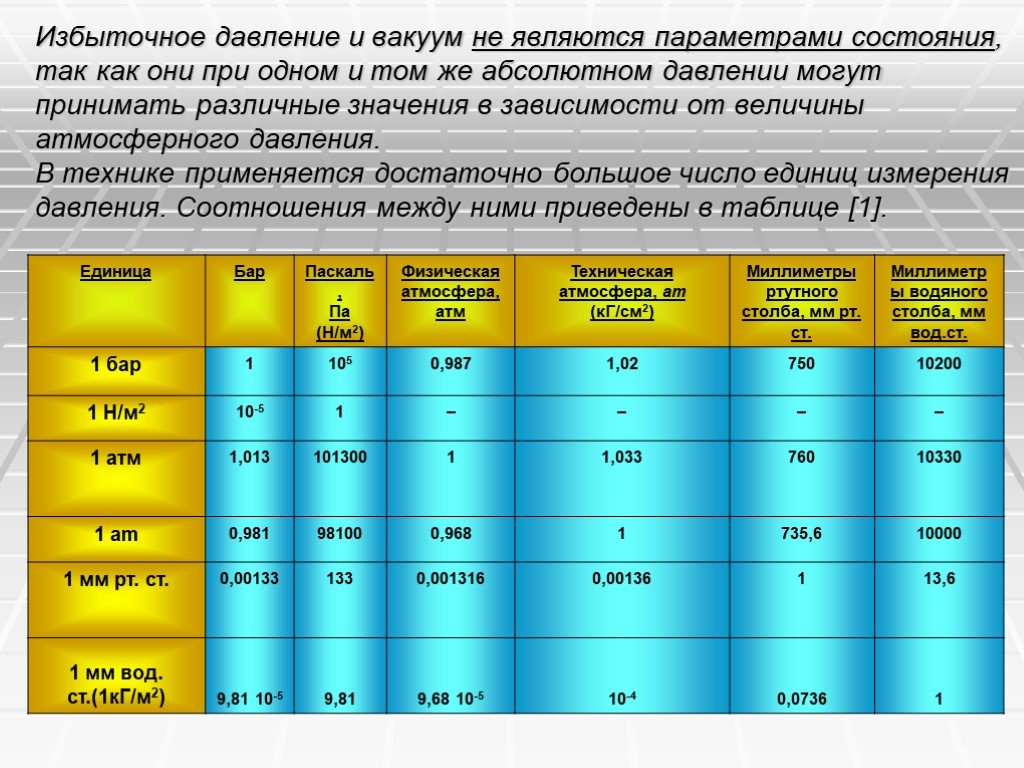
Слайд 10Различают давления атмосферное, избыточное и разрежение (вакуум). Атмосферным называется давление атмосферного воздуха на уровне моря. За величину атмосферного давления принимается давление столба ртути высотой 760 мм (одна физическая атмосфера – обозначается атм). Таким образом, 1 атм = 760 миллиметров ртутного столба (мм. рт. ст.). Давление, которое больше атмосферного, называется избыточным, а которое меньше – разрежением. Для измерения давления применяют манометры, атмосферного давления – барометры, разрежения – вакуумметры. Термодинамическим параметром состояния является только абсолютное давление, которое отсчитывается от абсолютного нуля давления или абсолютного вакуума. Избыточное давление и вакуум не являются параметрами состояния, так как они при одном и том же абсолютном давлении могут принимать различные значения в зависимости от величины атмосферного давления.

Слайд 11Избыточное давление и вакуум не являются параметрами состояния, так как они при одном и том же абсолютном давлении могут принимать различные значения в зависимости от величины атмосферного давления. В технике применяется достаточно большое число единиц измерения давления. Соотношения между ними приведены в таблице [1].

Слайд 12Температура (Т, К) – величина, характеризующая степень нагретости тел. Она представляет собой меру средней кинетической энергии поступательного движения молекул. Чем больше средняя скорость движения молекул, тем выше температура тела. В настоящее время используются две температурные шкалы. Международная практическая температурная шкала Цельсия (°С), в которой за основные реперные точки принимаются точка таяния льда (t0 = 0°С) при нормальном атмосферном давлении (р0 = 760 мм рт. ст.) и точка кипения воды при том же давлении – tк = 100°С. Разность показаний термометра в двух этих точках, деленная на 100, представляет собой 1° по шкале Цельсия. Термодинамическая шкала температур, основанная на втором законе термодинамики. Началом отсчета здесь является температура T0 = 0К= – 273,15°С. Измерение температур в каждой из этих двух шкал может производиться как в Кельвинах (К), так и в градусах Цельсия (°С) в зависимости от принятого начала отсчета.

Слайд 13Температура (Т, К) – величина, характеризующая степень нагретости тел. Она представляет собой меру средней кинетической энергии поступательного движения молекул. Чем больше средняя скорость движения молекул, тем выше температура тела. Между температурами, выраженными в Кельвинах и градусах Цельсия, имеется следующее соотношение. ( 1.4) В так называемой тройной точке, где жидкая, твердая и газообразная фазы находятся в устойчивом равновесии, температура в Кельвинах равна T=273,16К, а в градусах Цельсия t = 0,01°С.

Слайд 141.3. ТЕРМОДИНАМИЧЕСКИЙ ПРОЦЕСС Под термодинамическим процессом понимается совокупность последовательных состояний, через которые проходит термодинамическая система при ее взаимодействии с окружающей средой. Состояние термодинамической системы может быть равновесным и неравновесным. Равновесным называют такое состояние системы, при котором во всех точках ее объема все параметры состояния и физические свойства одинаковы (давление, температура, удельный объем и др.). В термодинамике постулируется, что изолированная система с течением времени всегда приходит в состояние термодинамического равновесия и никогда не может самопроизвольно выйти из него. Все процессы, происходящие в термодинамической системе, подразделяются на равновесные и неравновесные. Равновесными называются такие процессы, когда система в ходе процесса проходит ряд последовательных равновесных состояний.

Слайд 15Если процесс протекает настолько медленно, что в каждый момент времени устанавливается равновесие, то такие процессы называются квазистатическими. Эти процессы обладают свойствами обратимости. Неравновесными называются такие процессы, при протекании которых система не находится в состоянии равновесия. Процесс перехода системы из неравновесного состояния в равновесное называется релаксацией, а время перехода в состояние равновесия – временем релаксации. Все реальные процессы, протекающие в природе, являются неравновесными. Это определяется тем, что при протекании процесса с конечной скоростью в рабочем теле не успевает установиться равновесное состояние. Однако термодинамика в первую очередь рассматривает равновесные процессы и равновесные состояния, так как только равновесные состояния могут быть описаны количественно с помощью уравнений состояния. Лишь равновесные процессы изменения состояния термодинамической системы можно изображать графически.

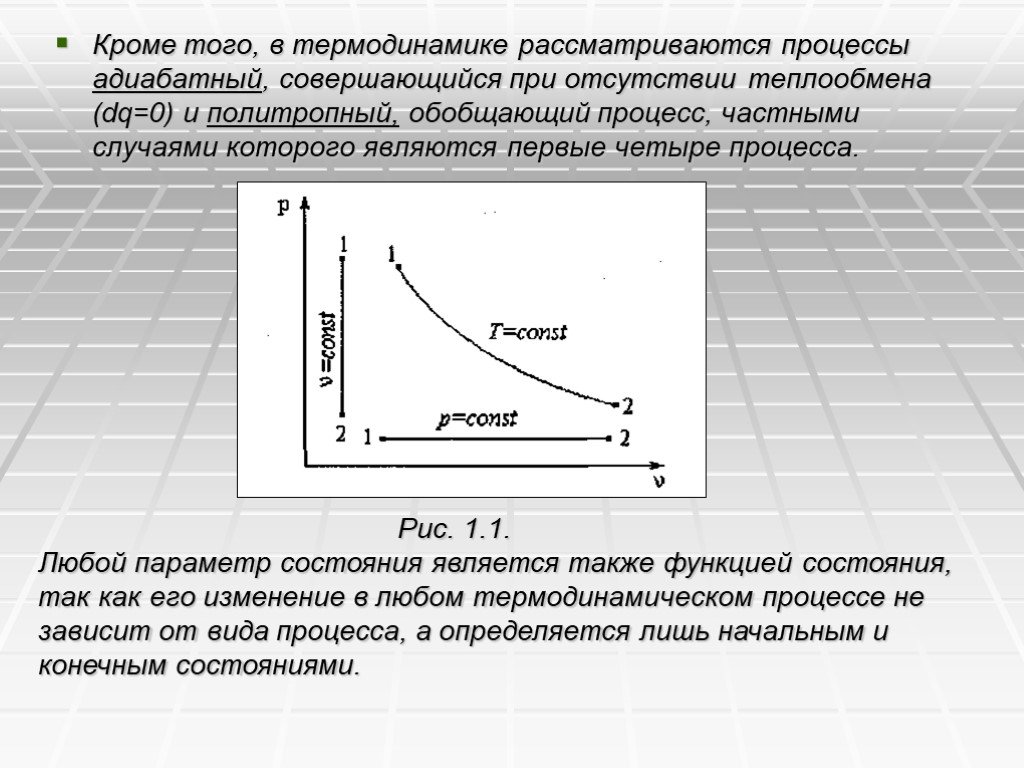
Слайд 16Всякое произвольно взятое равновесное состояние в трехосной системе координат pvT изображается точкой, а совокупность этих точек при непрерывном изменении состояния – некоторой кривой, представляющей собой графическое изображение равновесного процесса. Однако использовать трехосную систему координат затруднительно, поэтому на практике пользуются проекциями кривых трехосной системы на плоскости в прямоугольной системе координат. В технической термодинамике для исследования равновесных термодинамических процессов наиболее часто применяют двухосную систему координат p–v. В этой системе координат вертикаль изображает изохорный процесс, горизонталь – изобарный, кривая вида гиперболы – изотермический (рис. 1.1).

Слайд 17Кроме того, в термодинамике рассматриваются процессы адиабатный, совершающийся при отсутствии теплообмена (dq=0) и политропный, обобщающий процесс, частными случаями которого являются первые четыре процесса.
Рис. 1.1. Любой параметр состояния является также функцией состояния, так как его изменение в любом термодинамическом процессе не зависит от вида процесса, а определяется лишь начальным и конечным состояниями.
Слайд 18К термодинамическим процессам относится также круговой процесс или цикл. Циклом называется совокупность процессов, возвращающих систему в первоначальное состояние. На диаграммах цикл изображается замкнутым контуром, вид которого полностью определяется числом и формой составляющих цикл процессов. Графическое изображение и изучение циклов в пространственной системе координат было бы еще более трудным, чем изображение отдельных процессов. Поэтому цикл точно также проектируется на одну из координатных плоскостей.

Слайд 191.4. УРАВНЕНИЕ СОСТОЯНИЯ
Уравнение, устанавливающее связь между давлением, температурой и удельным объемом среды постоянного состава, называется термическим уравнением состояния. Общий вид этого уравнения. (1.5) Уравнение (1.5) в пространстве отображает поверхность, которая характеризует все возможные равновесные состояния однородной термодинамической системы. Эта поверхность называется термодинамической поверхностью или поверхностью состояния. На термодинамической поверхности каждому состоянию системы соответствует определенная точка.

Слайд 20Теория уравнения состояния пока разработана лишь для идеального газа, для газов, имеющих небольшую плотность, и в меньшей степени для плотных газов. Уравнение состояния идеального газа впервые было получено Клапейроном в 1834 г. путем объединения уравнений законов Бойля–Мариотта и Гей–Люссака – pv/T = const. Обозначая константу через R, получим (1.6) где R – удельная газовая постоянная, отнесенная к массе газа, равной 1 кг; Дж/(кг.К). Уравнение (1.6) записано для 1 кг газа. Для m кг уравнение состояния будет иметь вид (1.7) где V – объем газа, м3.

Слайд 21Газ, состояние которого точно описывается уравнением (1.6), называется идеальным. Многие реальные газы при малых плотностях и при достаточно высоких температурах по своим свойствам приближаются к идеальным. Поэтому для их расчетов может быть применено уравнение (1.6). Умножая обе части уравнения (1.6) на молекулярный вес m получим (1.8) где – объем, занимаемый одним молем газа. Молекулярный вес представляет собой сумму атомных весов атомов, образующих молекулу. Следовательно, молекулярный вес характеризует массу молекулы. Количество газа, вес которого в килограммах численно равен его молекулярному весу, называется молем или киломолем. В соответствии с законом Авогадро при одинаковых давлениях и температурах в каждом моле газа содержится одинаковое количество молекул NA = 6,022 1023 моль-1 (постоянная Авогадро).

Слайд 22Если, например, молекулярный вес водорода , азота , кислорода , то, взяв эти газы соответственно в количествах 2 кг, 28 кг и 32 кг при одинаковых температуре и давлении, получим, что объемы этих количеств газов равны. Объем одного моля газа при нормальных физических условиях (T0 = 273,15К, р0 = 101332 Па) м3/моль. Подставляя эту величину в (1.8), получим Дж/(моль К), (1.8а) где – универсальная газовая постоянная, одинаковая для любого газа. Отсюда уравнение состояния для одного моля идеального газа будет (1.9) Уравнение (1.9) было выведено Д.И. Менделеевым в 1874 году и называется уравнением состояния Клапейрона– Менделеева.

Слайд 231.5. ГАЗОВЫЕ СМЕСИ
В технике довольно часто приходится иметь дело с газообразными веществами, представляющими механическую смесь отдельных газов, по своим свойствам приближающуюся к идеальным газам. Например, атмосферный воздух представляет газовую смесь, включающую азот, кислород, углекислый газ, водяные пары и ряд других газов. Определение параметров необходимо для решения многих практических задач. Газовой смесью называется смесь отдельных газов, химически не реагирующих между собой, т.е. каждый газ в смеси полностью сохраняет все свои свойства и занимает весь объем смеси. Давление, которое создают молекулы каждого отдельного газа смеси, при условии, что этот газ находится один в том же количестве в том же объеме и при той же температуре, что и в смеси, называется парциальным (частичным) давлением. Будем считать, что каждый отдельный газ смеси подчиняется уравнению (2.7), т.е. является идеальным газом. Поэтому параметры газовой смеси так же могут быть вычислены по уравнению Клапейрона , где все величины в этом уравнении относятся к смеси газов.

Слайд 24Согласно закону Дальтона общее давление смеси идеальных газов равно сумме парциальных давлений газов, входящих в смесь , где р – давление смеси; р1, р2,…, pn – парциальные давления отдельных газов смеси. Газовая смесь может быть задана массовыми, объемными и молярными долями. Массовая доля – отношение массы каждого отдельного газа к суммарной массе смеси , где g1, g2,…, gn – массовые доли отдельных газов; т – суммарная масса всей смеси Сумма массовых долей равна единице Объемная доля – отношение парциального (приведенного) объема каждого газа к общему объему смеси где r1, r2,…, rn – объемные доли; V1, V2, Vn – парциальные объемы каждого газа; V– объем смеси газов.

Слайд 25Парциальный объем – это объем, который занимал бы газ, если бы его давление и температура равнялись параметрам смеси газов. Парциальный объем каждого газа при постоянной температуре находится по закону Бойля-Мариотта . Сложив почленно эти уравнения, получим, что сумма парциальных объемов равна объему смеси (закон Амага) . Если сложить объемные доли, то получим . Из закона Бойля-Мариотта (при постоянной температуре) следует . Отсюда или . Последняя формула позволяет определять парциальные давления компонентов смеси, если известен ее объемный состав.

Слайд 26Последняя формула позволяет определять парциальные давления компонентов смеси, если известен ее объемный состав. Задание смеси молярными долями заключается в следующем. Сначала находим количество молей каждого компонента смеси по соотношениям , где М1, М2,..., Мп – количество молей каждого компонента; m1, m2,ююю, mn – молекулярные веса соответствующих компонентов смеси. Отсюда вся газовая смесь будет содержать М молей . Мольные доли yi (i=1,2,3,...,n) находятся в виде отношений . Очевидно, что . Так как , то молекулярный вес смеси m будет определяться по формуле

Слайд 27Полученное значение называется средним кажущимся значением молекулярного веса смеси. Знание молекулярного веса позволяет по формуле (2.9а) находить газовую постоянную смеси R (ниже будет приведена формула для определения m по известной R). По закону Авогадро мольные объемы различных газов при одинаковых давлениях и температурах равны (в равных объемах различных газов содержится одинаковое количество молекул). Отсюда для i–го газа смеси справедливо соотношение , где Vm – объем, занимаемый одним молем газа. Для всей смеси получим . Отсюда или . Следовательно, мольные и объемные доли численно равны между собой. Выведем формулу для определения молекулярного веса смеси по ее объемному составу. Из предыдущего для i–го компонента можно записать или для всей смеси .

Слайд 28Учитывая, что , получим Заменяя в последнем уравнении молекулярные веса их плотностью (на основании закона Авогадро), получим , так как . В случае, когда газовая смесь задана массовым составом, то с помощью уравнения состояния выразим парциальные давления компонентов . Для давления всей смеси в соответствии с законом Дальтона получим формулу . Или . Учитывая, что , получим . По известной газовой постоянной смеси, используя формулу (1.8а), можно найти молекулярный вес смеси.