Презентация "Молекулярная физика и термодинамика" – проект, доклад
Презентацию на тему "Молекулярная физика и термодинамика" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 16 слайд(ов).
Слайды презентации
Список похожих презентаций
Молекулярная физика и термодинамика
Содержание:. Структура и содержание МКТ. Основные положения МКТ. Опытные обоснования МКТ. Роль диффузии и броуновского движения в природе и технике. ...Молекулярная физика и термодинамика
Литература: 1. Кудрявцев Б.Б., Курс физики: Теплота и молекулярная физика. – М.: Учпедгиз, 1960. 210 с. 2. Савельев И.В. Курс общей физики Т. 1, Механика, ...Молекулярная физика и термодинамика
Тепловое равновесие. Температура. Молекулярная физика и термодинамика изучают свойства и поведение макроскопических систем, т.е. систем, состоящих ...Раздел молекулярная физика
Молекулярная физика – раздел физики, в котором изучаются физические свойства тел в различных агрегатных состояниях на основе рассмотрения их молекулярного ...Статистическая физика и термодинамика
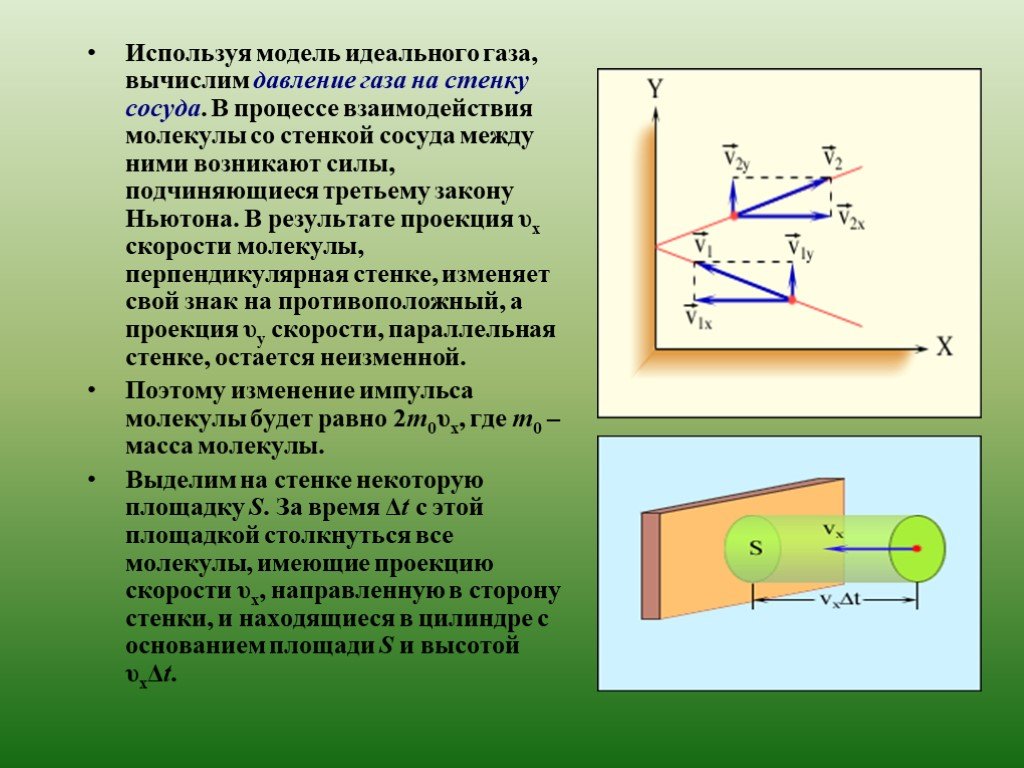
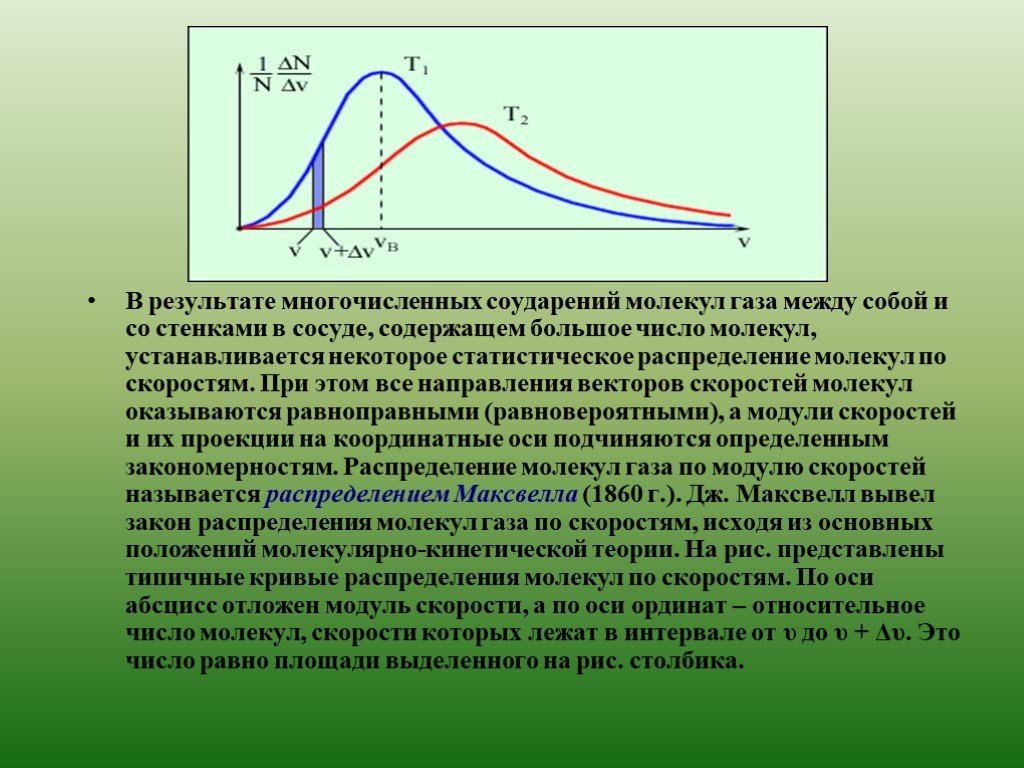
На первый взгляд кажется, что изучение свойств любого макроскопического тела может быть сведено к решению механической задачи – нужно проследить за ...Молекулярная физика
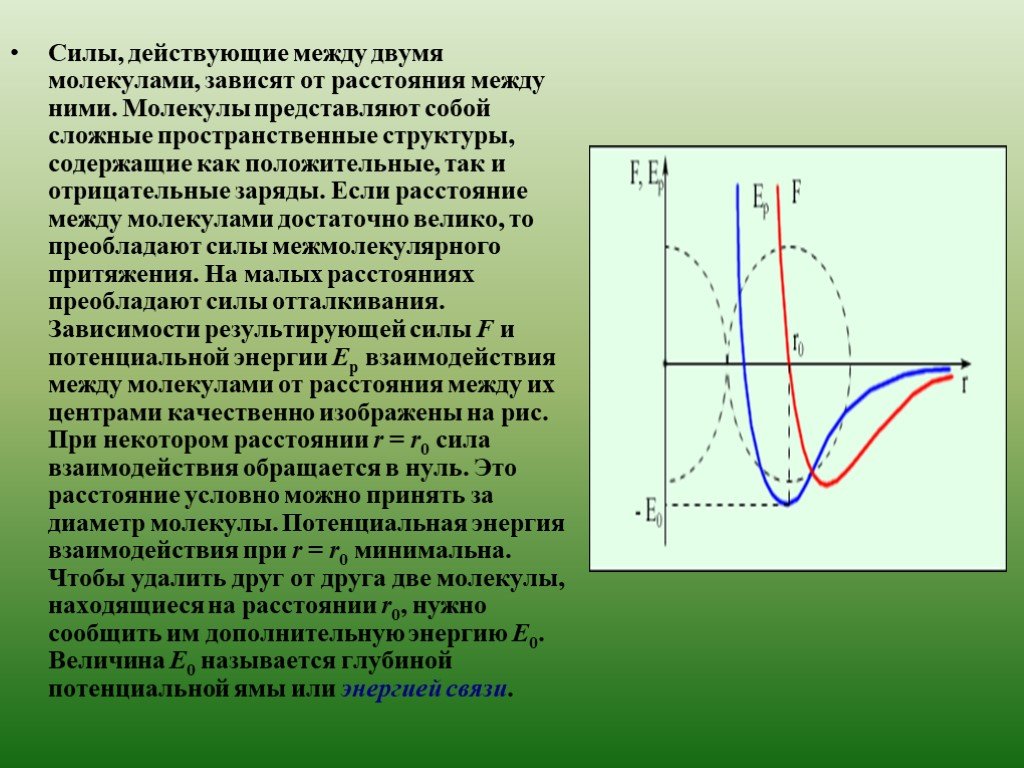
Основные положения МКТ. Все вещества состоят из молекул, которые разделены промежутками. Молекулы беспорядочно движутся. Между молекулами есть силы ...Молекулярная физика. Ученые и их открытия
Демокрит. Первой наиболее перспективной научной гипотезой о строение вещ-ва была идея атомизма. Атомизм- учение о прерывистом, дискретном строение ...Молекулярная физика
Цель: повторение основных понятий, законов и формул МОЛЕКУЛЯРНОЙ ФИЗИКИ в соответствии с кодификатором ЕГЭ. Элементы содержания, проверяемые на ЕГЭ ...Атомная физика
План урока 1. Из истории физики 2. Модель Томсона 3. Опыт Резерфорда 4. Противоречия 5.Постулаты Бора 6.Энергетическая диаграмма атома водорода 7. ...Лампы накаливания физика
Актуальность. 2 июля 2009 года Президент России Дмитрий Медведев, выступая на заседании президума Госсовета по вопросам повышения энергоэффективности ...«Электромагнит» физика
2. Как располагаются железные опилки в магнитном поле прямого тока? 3. Что называют магнитной линией магнитного поля? 4. Для чего вводят понятие магнитной ...Техническая термодинамика
Введение. «Теплотехника» является общеинженерной дисциплиной, позволяющей сформировать у студентов современное представление о методах получения, ...Оптика и атомная физика
В основу настоящего конспекта лекций положен курс лекций по оптике, разработанный профессором кафедры оптики Н.К. Сидоровым и заведующим кафедры оптики ...Простая и интересная физика у Вас дома
Содержание. Эксперименты на тепловые явления. Эксперимент на плотность. Научные забавы и прочие опыты. Как будут отпадать гвозди??? Вы ответили неверно!!! ...Атомная физика от А до Я
А Б В Г Д Е Ё Ж З И Й К Л М Н О П Р С Т У Ф Х Ц Ш Щ Ъ Ы Ь Э Ю Я. Атом. Бета-распад. Водород. Гамма-лучи. Дейтерий. Естественная радиоактивность. Жёсткая ...Виды излучений физика
Открытие радиоактивности. РАДИОАКТИВНОСТЬ – превращение атомных ядер в другие ядра, сопровождающееся испусканием различных частиц и электромагнитного ...Атомная физика
...Атомная физика
Физика атома и атомного ядра. В 1833 году при исследовании явления электролиза М. Фарадей установил, что ток в растворе электролита это упорядоченное ...Атомная физика
Понятие об атомном ядре впервые было введено Э.Резерфордом в 1911г. СТРОЕНИЕ АТОМА Модель Томсона. Модель Резерфорда. + Модель Томсона. - «Кекс с ...Атомная физика
СТРОЕНИЕ АТОМА Модель Томсона. Модель Резерфорда. Опыт Резерфорда. Определение размеров. атомного ядра Планетарная модель атома. Планетарная модель ...Конспекты
Молекулярная физика. Газовые законы
МОДЕКУЛЯРНАЯ ФИЗИКА. ГАЗОВЫЕ ЗАКОНЫ. (решение задач повышенной сложности). 10 класс. Учителя: Юдинцева Ольга Васильевна. ...Ядерная физика
Обобщающий урок по теме «Ядерная физика». Цель урока:. выявить преимущества и недостатки использования энергии атома. Задачи:. Научить анализировать ...Что изучает физика
Открытый урок по физике в 7 классе от 0103.09 2014г. Что изучает физика(первый рок физики в 7 классе). Цели урока:. Познакомить учащихся с ...Что изучает физика
Презентация к уроку в 7 классе "Что изучает физика?". Определяется место физики как науки в системе школьных дисциплин; вводятся физические ...Что и как изучают физика и астрономия
План-конспект урока №1. Тема урока: Что и как изучают физика и астрономия. Цель урока:. познакомить учащихся с новым школьным предметом; научить ...Сказочная физика (расчет плотности, массы и объема тела)
Сказочная физика (расчет плотности, массы и объема тела) 18(21).11.14г. Магомаева М.С. , . учитель физики. . Разделы:. . Преподавание физики. ...Сказки и физика
Урок творчества и фантазии в 7 классе «Сказки и физика». является активной формой учебно- воспитательной работы, это творческая форма организации ...Необыкновенная физика обыкновенных явлений
. Муниципальное бюджетное общеобразовательное учреждение. . Суховская средняя общеобразовательная школа. Конспект урока на тему «Необыкновенная ...Мой дом и физика в нем. Деформация тел
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ ХАБАРОВСКОГО КРАЯ. КГБОУ НПО ПРОФЕССИОНАЛЬНОЕ УЧИЛИЩЕ № 16. Открытый урок по дисциплине. . «Физика». ...Квантовая физика
Муниципальное образовательное учреждение Сенгилеевская СОШ №2. Урок обобщения и систематизации знаний для учащихся 11 класса по теме «Квантовая ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 октября 2018
Категория:Физика
Содержит:16 слайд(ов)
Поделись с друзьями:
Скачать презентацию