Экзаменационный материал по химии
Экзаменационный материал
по химии 8 класс
(учебник В.В. Еремин, Н.Е.Кузменко)
Пояснительная записка
Данный экзаменационный материал составлены с учетом программы Еремина В.В. «Химия 8 класс». Экзаменационные билеты ориентированы на проверку усвоения содержания ведущих разделов (тем) курса химии за 8 класс. К числу таких разделов относятся: периодический закон и периодическая система химических элементов Д.И.Менделеева, строение атома; химическая связь и строение вещества; классы неорганических соединений, их свойства; химическая реакция: классификация реакций и закономерности их протекания; методы познания веществ и химических явлений; экспериментальные основы химии; применение веществ.
Объем содержания, проверяемый билетами, соотнесен с объемом учебного времени, отводимого на изучение химии по 2 часа в неделю.
Комплект состоит из – 23 билетов. Каждый из билетов включает два вопроса: первый - теоретический, а второй – практико-ориентированный.
Теоретические вопросы билетов ориентированы на проверку сформированности у выпускников:
-
основных химических понятий: химический элемент, атом, молекула, химическая связь, вещество, реакция, классификация веществ и реакций, степень окисления, валентность;
-
умений: характеризовать химические элементы на основе их положения в периодической системе и строения их атомов; устанавливать связь между составом, строением и свойствами веществ; классифицировать вещества и химические реакции; характеризовать химические свойства основных классов неорганических соединений.
Практико-ориентированные вопросы представляют собой расчетные задачи или лабораторные опыты. Предлагаемые в билетах расчетные задачи и лабораторные опыты ориентированы на проверку сформированности практических умений: обращаться с химической посудой и лабораторным оборудованием; распознавать опытным путем изученные газы, растворы щелочей и солей, вычислять массовую долю вещества в растворе и т.д.
При выполнении учащимися практического задания следует обращать внимание на технику проведения эксперимента, оформление записей и рисунков, объяснения полученного результата на основании теоретических знаний.
На подготовку к ответу учащимся отводится специальное время – 30 минут. За это время учащийся должен успеть подготовить необходимые выкладки, схемы и воспроизвести их на доске. Эти записи помогут построить связный, логичный и полный ответ. Для выполнения практического задания в некоторых случаях может быть выделено дополнительное время.
Критерии оценки устного ответа:
«5»- ответ полный, правильный на основании изученных теорий и фактов; материал изложен в определенной логической последовательности, научным языком; ответ самостоятельный
«4» - ответ полный, правильный на основании изученных теорий и фактов; материал изложен в определенной логической последовательности, научным языком; при этом допущено 2-3 несущественные ошибки, исправленные по требованию учителя.
«3» - ответ полный, но при этом допущена существенная ошибка или ответ не полный, не связный.
Критерии оценки практических умений учащихся:
«5» - правильно определена цель опыта;
-самостоятельно проведена работа;
-научно, грамотно, логично описаны наблюдения, сформулированы выводы.
«4» - правильно определена цель опыта;
- в целом грамотно, логично описаны наблюдения, выводы;
- в описании наблюдений из опыта допущены неточности, выводы неполные.
«3» - правильно определена цель опыта;
-подбор оборудования проведен с помощью учителя;
-допущены неточности, ошибки при закладки опыта, выводов.
Билет № 1
1. Предмет химии. Вещества простые и сложные. Химические элементы. Формы существования химических элементов.
2. Найдите массовые доли элементов в соединениях.
Билет № 2
1. Вода: ее состав, физические свойства. Химические свойства воды: разложение, отношение к натрию, оксидам кальция, оксиду серы (IV). Основные загрязнители природной воды.
2. Задача на растворы
Билет № 3
-
Простые и сложные вещества: различие в их составе. Основные классы неорганических соединений: примеры соединений, различие в их составе.
-
Осуществить цепочку превращения
Билет № 4
1. Химическая символика: химические символы, формулы и уравнения реакций, информация, которая заключена в них.
-
Практика: Очистка загрязненной поваренной соли
Билет № 5
1. Основные сведения о строении атомов. Строение атомного ядра. Изотопы.
2. Задача на растворы
Билет № 6
1. Строение электронных оболочек атомов первых двадцати химических элементов. Завершенные и незавершенные энергетические уровни атомов химических элементов.
2. Распределите формулы веществ по классам: оксиды, кислоты, соли, основания. Дайте названия каждому веществу.
Билет № 7
1. Структура Периодической системы химических элементов Д. И. Менделеева. Общие закономерности в изменении свойств химических элементов в периодах (малых) и группах, их объяснение на основе строения атомов.
2.Закончить уравнения и расставить коэффициенты:
Билет №8
1.Виды химических связей: ионная, ковалентная (полярная и неполярная), металлическая.
2. Опытным путем докажите, что выданное вам вещество кислота.
Билет № 9
1. Типы кристаллических решеток: атомная, молекулярная, ионная и металлическая. Соотношение вида химической связи и строения кристаллической решетки. Физические свойства веществ с различными типами кристаллических решеток. •
2. Определить степени окисления для каждого элемента в соединениях.
Билет № 10
1. Классификация простых веществ. Сравнение свойств простых веществ: металлов и неметаллов. Аллотропия как способность химических элементов существовать в виде нескольких простых веществ, ее причины. Примеры аллотропных модификаций для 1—2 элементов.
2.Найдите молекулярную массу следующих веществ.
Билет № 11
1.Классификация сложных веществ. Деление каждого класса сложных веществ на группы. Представители классов и групп сложных веществ, их применение.
2.Определите вид химической связи для следующих веществ, составьте схему образования любого из представленных веществ.
Билет № 12
1.Физические явления. Способы разделения смесей и их значение в народном хозяйстве и жизни человека.
2.Задачи на растворы
Билет № 13
1.Классификация химических реакций по различным признакам (агрегатному состоянию веществ, тепловому эффекту, использованию катализатора, направление протекания). Реакции соединения, разложения, замещения и обмена.
2.Опытным путем докажите, что выданное вам вещество щелочь.
Билет № 14
1.Степень окисления. Правила определения степени окисления элементов в соединениях.
2. Осуществить цепочку превращения.
Билет № 15
1. Кислоты, их классификация, химические свойства, способы получения.
2. Определите массовую долю всех элементов в формуле.
Билет №16
1. Основания, их классификация, химические свойства, способы получения.
2. Осуществить цепочку превращения.
Билет № 17
-
Оксиды: их состав и классификация. Химические свойства основных и кислотных оксидов.
-
Задачи на растворы
Билет № 18
1.Соли, их классификации, химические свойства средних солей, способы получения.
2. Практика: Получение кислорода в лаборатории
Билет №19
1. Генетическая связь между классами веществ. Генетические ряды металла и неметалла.
2. Практика: Получение водорода
Билет №20
-
Кислород: физические свойства, химические свойства, способы получения, области применения.
-
Осуществить цепочку превращения.
Билет №21
-
Водород: физические свойства, химические свойства, способы получения, области применения.
-
Задача на нахождение массы вещества по массе атома
Билет №22
-
Амфотерные оксиды и гидроксиды: свойства, способы получения
-
Задачи на растворы
Билет №23
-
Относительная атомная и молекулярная массы. Качественный и количественный состав вещества.
-
Задача на нахождение массы вещества по массе атома
Практическая часть экзамена по химии.
Билет № 1
Вычислите массовые доли всех элементов (в процентах) в медном купоросе.
Дано: Решение:
CuSO4 * 5 H2O M (CuSO4 * 5 H2O) = 250 г/моль
Найти: w (Cu)- ?
w (S) - ? w (Cu)= 64: 250= 0,256 или 25,6 %
w (O) – ? w (S) = 32 : 250 =0,128 или 12, 8 %
w (H) - ? w (O) = 16*9 : 250=0,576 или 57,6 %
w (H) = 1*10 : 250=0,04 или 4%
Ответ:
Билет № 2
Задача: В 475 г воды растворили 25 г поваренной соли. Вычислить массовую долю поваренной соли в полученном растворе.
| Решение: m (в-ва) ω = ----------- · 100% m (р-ра) | |
| | m (р-ра) = m (H2O) + m (NaCl) m (р-ра) = 475 +25= 500 г |
| | 25 ω (NaCl) = ------ ·100% = 5% 500 |
| | Ответ: массовая доля поваренной соли в растворе составляет 5 %. |
| | |
Билет № 3
Осуществить цепочку превращения:
Ba→BaO→Ba(OH)2→BaCl2→BaSO4
2Ba+O2→ 2BaO
BaO + H2O→ Ba(OH)2
Ba(OH)2 + 2HCl→ BaCl2 + 2H2O
BaCl2 + H2 SO4→ BaSO4↓+ 2 HCl
Билет № 4
Р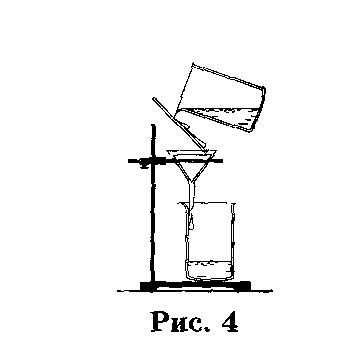 астворить загрязненную соль в небольшом объеме воды. Дать раствору отстояться. Очистить раствор фильтрованием (рис.4): осторожно слить жидкость с отстоявшегося осадка в стакан по стеклянной палочке. Примесь песка остается на фильтре, а в стакан проходит прозрачный фильтрат (раствор соли в воде). Полученный фильтрат вылить в фарфоровую чашечку и нагреть ее в пламени спиртовки до полного испарения воды (рис.5). На стенках чашечки образуются кристаллики очищенной поваренной соли.
астворить загрязненную соль в небольшом объеме воды. Дать раствору отстояться. Очистить раствор фильтрованием (рис.4): осторожно слить жидкость с отстоявшегося осадка в стакан по стеклянной палочке. Примесь песка остается на фильтре, а в стакан проходит прозрачный фильтрат (раствор соли в воде). Полученный фильтрат вылить в фарфоровую чашечку и нагреть ее в пламени спиртовки до полного испарения воды (рис.5). На стенках чашечки образуются кристаллики очищенной поваренной соли.
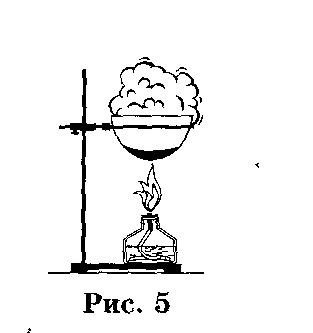
рис. 4 рис. 5
Билет № 5
Задача: Вычислить массу соли, содержащейся в 150 г раствора с массовой долей соли 15%.
| Решение: m (в-ва) ω = ------------ · 100% m (р-ра) ω · m (р-ра) m (в-ва) = --------------- 100%
15 · 150 m (в-ва) = ---------- = 22,5 г 100% Ответ: масса соли в растворе 22,5 г. |
Билет № 6
Оксиды: оксид серы (VI); оксид азота (II); оксид магния; оксид железа (III)
Кислоты: серная, азотистая, угольная, ортофосфорная
Основания: гидроксид натрия; гидроксид железа (II); гидроксид алюминия
Соли: гидросульфат натрия; гидрокарбонат калия, нитрит магния, сульфид алюминия, гидроксохлорид бария.
Билет № 7
а) 4Al + 3O2→ 2Al2O3
б) Fe2O3 + 3H2 → 2Fe + 3H2O
в) 2NaNO3 → 2 NaNO2 + O2
г) K2CO3 + CaCl 2 → 2KCl + CaCO3
д) 2Fe + 3Cl 2 → 2FeCl 3
Билет № 8
Соляная кислота. Необходимо провести реакции, подтверждающие свойства кислоты.
-
Взаимодействие с индикаторами: лакмус краснеет, а метиловый оранжевый розовеет.
-
Взаимодействие с металлами: HCl + Zn = ZnCl2 + H2
-
Взаимодействие с основными и амфотерными оксидами:
HCl + CuO = CuCl2 + H2O
-
Взаимодействие с основаниями:
-
с щелочами: к 2—3 мл раствора гидроксида натрия добавить 1—2 капли фенолфталеина — окраска станет малиновой, затем прилить 2—3 мл раствора соляной кислоты:
HCl + NaOH= NaCl + H2O
-
с нерастворимыми основаниями: к 2—3 мл раствора гидроксида натрия добавить 2—3 капли раствора хлорида меди (II):
2NaOH + CuCl2 = Cu(OH)2 + 2 NaCl
К образовавшемуся осадку гидроксида меди (И) добавляем несколько капель соляной кислоты: Cu(OH)2 + 2HCl = CuCl2 + 2 H2O
5. Взаимодействие с солями:
-
к 2 — 3 мл раствора карбоната калия добавляем 1 — 2 капли соляной кислоты:
K2CO3 + 2HCl = 2 KCl + CO2 + H2O
-
качественная реакция на хлорид-ион
HCl + AgNO3 = AgCl + HNO3
Вывод: соляная кислота проявляет все свойства, характерные для кислот. Взаимодействует: 1) с металлами, стоящими в электрохимическом ряду напряжений металлов до водорода; 2) с оксидами металлов; 3) с гидроксидами металлов; 4) с солями. Качественной реакцией на хлорид-ион является взаимодействие с ионом серебра.
Билет № 9
Al2O3 ; H2 ; NaNO3 ; O2 ; KHCO3 ; FeCl 3 ; KMnO4 ;
Билет № 10
Mr (K2MnO2)=
Mr (BaCl2) =
Mr (Cl2O) =
Билет № 11
СО2; NH3 –к.п.св.
H2;N2 – к.неп.св.
Al - металлическая
Аl2О3 - ионная
Билет № 12
Задача: Какой объем воды и какая масса гидроксида калия потребуется для приготовления 500 мл 28%-ного его раствора (плотность 1,263 г/мл).
| Решение: m (р-ра) ρ = ------------ V (р-ра) m (р-ра) = ρ · V (р-ра) | |
| | m (р-ра) = 1,263 · 500= 631,5 г |
| | m (в-ва) ω = ------------ · 100% m (р-ра) ω · m (р-ра) m (KOH) = --------------- 100% |
| | 28 · 631,5 m (KOH) = ---------- = 176,82 г 100% |
| | m (H2O) = m (р-ра) - m (KOH) m (H2O) = 631,5 – 176,82= 454,68 г 454,68 г V (H2O)= ----------- = 454,68 мл 1 г/мл |
| | Ответ: для приготовления 500 мл 28%-ного гидроксида калия потребуется 176,82 г KOH и 454,68 мл воды |
Билет № 13
Распознать кислоту и щелочь можно с помощью растворов индикаторов.
-
Взять пробы из трех пробирок (каждую отдельно).
-
Добавить по 2—3 капли раствора фиолетового лакмуса: в пробирке с кислотой он становится красным; в пробирке со щелочью он меняет окраску на синюю.
-
Другой вариант исследования может быть осуществлен с помощью метилового оранжевого. Добавить по 2—3 капли раствора метилового оранжевого. В кислотной среде окраска индикатора изменяется на розовую, а в щелочной — на желтую.
-
Реактивом на кислоту может служить соль угольной кислоты — карбонат: 2H+ + CO32-= H2O + CO2
Билет № 14
Осуществить цепочку превращения:
фосфор → оксид фосфора (V) → ортофосфорная кислота→ ортофосфат кальция
Билет № 15
Вычислить массовые доли элементов в бертолетовой соли, магнитном железняке
Билет № 16
Осуществить цепочку превращения:
Al → Al2O3→ AlCl 3 → Al(OH)3→ Al2O3
↓_____________↑
Билет № 17
Задача: Какую массу 40%-ного раствора соли следует добавить к 200 г 15%-ного раствора той же соли, чтобы получить 20%-ный раствор этой соли?
| Решение: m (в-ва) ω = ------------ · 100% m (р-ра) ω · m (р-ра) m (соли) = --------------- 100% | |
| | 200 ·15% m2 (соли) = ---------- = 30 г 100% |
| | х · 40% m1 (соли) = ---------- = 0,4 х 100% |
| | m3 (р-ра) = m1 (р-ра) + m2 (р-ра) m3 (р-ра) = х + 200 |
| | m3 (соли) = m1 (соли) + m2 (соли) m3 (соли)= 0,4 х + 30 |
| | 0,4 х + 30 0,2 = --------------- х + 200 40+0,2х=0,4х+30 х =50 |
| | Ответ: для получения 20%-ного раствора соли, необходимо взять 50г 40%-ного и 200 г 15%-ного растворов. |
Билет № 18
Для получения кислорода можно использовать реакцию разложения перманганата калия при нагревании:
t0
2 KMnO4 = K2MnO2 + MnO2 + 2 O2
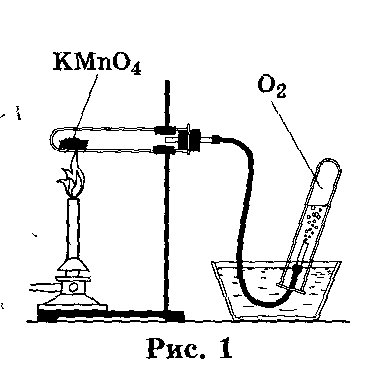
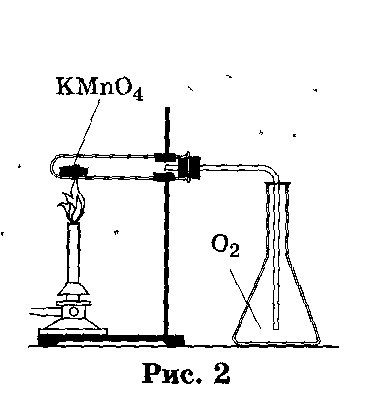
Собрать кислород можно вытеснением воды (рис.1) и вытеснением воздуха (рис.2). Несколько удобнее собирать кислород способом вытеснения воздуха. При этом кислород,имеющий большую молярную массу* чем воздух (M (O2) = 32 г/моль; Ж(возд.) = 29 г/моль), будет собираться на дне, тем самым вытесняя воздух из емкости (стакана, колбы). Доказать наличие кислорода можно, постепенно опуская в пробирку (стакан, колбу) тлеющую лучинку, которая при контакте с кислородом вспыхнет (кислород поддерживает горение).
Билет № 19
В лаборатории водород можно получить действием раствора кислоты (кроме азотной) на металлы (в ряду напряжений металл должен находиться левее водорода). Например, хлороводородной кислоты НС1 на цинк:
HCl + Zn = ZnCl2 + H2
Собрать водород можно вытеснением воды (рис.6) или вытеснением воздуха (рис. 7).
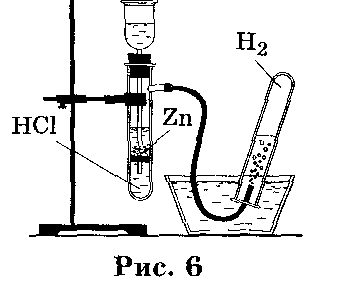
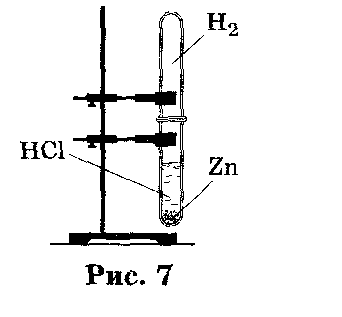
рис. 7
рис. 6
Билет № 20
Прежде чем провести опыт, следует определить соответствующие реактивы и составить схему превращений. Например:
Сульфат меди (2)--- Гидроксид меди (2) --- Оксид меди (2)
А затем провести реакции:
а) CuSO4 + 2NaOH= Cu(OH)2 + Na2SO4
б) если нагреть полученный голубой осадок, то он изменит свой цвет на черный вследствие образования оксида меди (II):
t0
Cu(OH)2 = CuO + H2O
Билет № 21
Задача: Рассчитать массу магнитного железняка, содержащего 50 г атомов железа.
| Решение: Mr (Fe3 O4) = 56· 3 + 16·4=232 |
| Ar · n ω (эл-та) = --------- · 100% Mr |
| 56 ·3 ω (Fe) = --------- · 100% = 72% или 0,72 232 |
| m (Fe) m (Fe3 O4) = --------- ω (Fe)
50 m (Fe3 O4) = ------- = 69,4 г 0,72 |
| Ответ: масса магнитного железняка 69,4 г |
Пудова Ю.В. МБОУ гимназия № 79 
Здесь представлены материалы теста на тему «Экзаменационный материал по химии », которые могут быть просмотрены в онлайн режиме или же их можно бесплатно скачать. Предмет теста: Химия (8 класс). Также здесь Вы найдете подборку тестов на схожие темы, что поможет в еще лучшей подготовке к тестированию.

