Тесты по химии
ГАоу Нпо ПУ – 113
Комплект контрольно-измерительных материалов
(для итоговой аттестации)
по учебной дисциплине
Химия
Малояз, 2013
СОДЕРЖАНИЕ
| ПАСПОРТ КОМПЛЕКТА КИМ ПО УЧЕБНОЙ ДИСЦИПЛИНЕ …………………………………………. | 3 | |
| 2 | СТРУКТУРА И ПЕРЕЧЕНЬ КОНТРОЛЬНО-ИЗМЕРИТЕЛЬНЫХ МАТЕРИАЛОВ ДЛЯ ИТОГОВОЙ АТТЕСТАЦИИ ПО ДИСЦИПЛИНЕ …………………………………………. | 6 |
| 3 | ПЕРЕЧЕНЬ МАТЕРИАЛОВ И ИНФОРМАЦИОННЫХ ИСТОЧНИКОВ ……………. | 10 |
1. ПАСПОРТ КОМПЛЕКТА ИЗМЕРИТЕЛЬНЫХ МАТЕРИАЛОВ ПО УЧЕБНОЙ ДИСЦИПЛИНЕ
1.1. Общие положения
Контрольно-измерительные материалы (КИМ) предназначены для контроля и оценки образовательных достижений обучающихся, освоивших программу учебной дисциплины «Химия».
Содержание современного курса химии тесно связано не только с задачей получения фундаментального естественно - научного образования, но и с задачей формирования представлений о химии как о необходимой для каждого человека составляющей общих знаний о мире и понимания значимости этой науки для общественного прогресса. Важной частью общей культуры является широкий набор знаний, которые человек активно использует в быту, в профессиональной деятельности, на протяжении всей жизни. Умение применять полученные теоретические знания на практике может служить критерием оценки уровня культурного развития человека. Поэтому одним из традиционных направлений в преподавании химии является освещение вопросов прикладной направленности. Прикладная направленность химии осуществляется с целью повышения качества химического образования обучающихся, применения их химических знаний к решению задач повседневной практики и в профессиональной деятельности.
течение двух семестров. Формой промежуточной аттестации после изучения является дифференцированный зачет.
-
Результаты освоения дисциплины, подлежащие проверке
В ходе аттестации по дисциплине осуществляется проверка следующих умений, знаний и формирования общих компетенций
| Основные показатели оценки результатов | |
| У.1. Применять основные законы химии для решения задач в области профессиональной деятельности; У.2 Использовать свойства органических веществ, дисперсных и коллоидных систем для оптимизации технологических процессов; У.3 Описывать уравнениями химических реакций процессы, лежащие в основе производства пищевых продуктов; У.4 Проводить расчеты по химическим формулам и уравнениям реакций; У.5 Использовать химическую посуду и оборудование; У.6 Выбирать метод и ход химического анализа, подбирать реактивы и оборудование; У.7 Проводить качественные реакции на неорганические вещества и ионы, отдельные классы органических соединений; У.8 Выполнять количественные расчеты состава вещества по результатам измерений; У.9 Соблюдать правила техники безопасности при работе в химической лаборатории. | - Обоснованное применение законов химии в профессиональной деятельности; - Способность оптимизировать технологические процессы, основываясь на свойствах веществ, дисперсных и коллоидных систем; - Способность представить химизм процесса производства пищевых продуктов с помощью уравнений реакций; - Достоверный результат расчета; - Использование химической посуды и оборудования по назначению; - Обоснованный выбор метода проведения химического анализа; - Способность выполнить качественный анализ; - Способность провести количественный анализ с получением достоверного результата; - Умение соблюдать правила техники безопасности при работе в химической лаборатории; |
| З.1 Основные понятия и законы химии; З.2 Теоретические основы органической, физической и коллоидной химии; З.3 Понятия химической кинетики и катализа; З.4 Классификацию химических реакций и закономерности их протекания; З.5 Обратимые и необратимые химические реакции, химическое равновесие, химическое равновесие и его смещение под действием различных факторов; З.6 Окислительно-восстановительные реакции, реакции ионного обмена; З.7 Гидролиз солей, диссоциацию электролитов в водных растворах, понятие о сильных и слабых электролитах; З.8 Тепловой эффект химических реакций, термохимические уравнения; З.9 Характеристики различных классов органических соединений, входящих в состав сырья и готовой пищевой продукции; З.10 Свойства растворов и коллоидных систем высокомолекулярных соединений; З.11 Дисперсные и коллоидные системы пищевых производств; З.12. Роль и характеристики поверхностных явлений в природных и технологических процессах; З.13 Основы аналитической химии; З.14 Основные методы классического количественного и физико-химического анализа; З.15 Назначение и правила использования лабораторного оборудования и аппаратуры; З.16 Методы и технику выполнения химических анализов; З.17 Приемы безопасной работы в химической лаборатории. | – Знание основных понятий и законов химии – Знание основ органической, физической и коллоидной химии; – Знание сущности химической кинетики и катализа, в т.ч. факторов на него влияющих; - Знание различных вариантов классификации химических реакций; - Знание сущности химического равновесия и условий его смещения; - Знание сущности окислительно-восстановительных и обменных процессов; - Знание сущности процесса гидролиза и факторов на него влияющих; - Знание основных понятий и законов термохимии; - Знание общей характеристики и особенностей органических соединений, входящих в состав сырья и готовой пищевой продукции; - Знание свойств растворов и коллоидных систем высокомолекулярных соединений; - Знание дисперсных и коллоидных систем пищевых производств; - Знание сущности поверхностных явлений и их роли в природных и технологических процессах; - Знание основ аналитической химии; - Знание основных приемов и методов количественного и физико-химического анализа; - Знание назначений и правил использования лабораторного оборудования и аппаратуры; - Знание методов и техники выполнения химических анализов; - Знание приёмов безопасной работы в химической лаборатории. |
1.3 Критерии оценки знаний и умений
Итоговый тест за курс основной общей школы
Итоговый тест содержит задания по основным темам курса химии: «Строение атома», «Периодический закон и периодическая система химических элементов Д.И. Менделеева», «Строение вещества», «Химические реакции», «Основные закономерности протекания химических реакций», «Растворы. Теория электролитической диссоциации», «Окислительно-восстановительные реакции», «Классификация веществ», «Основные классы неорганических и органических соединений».
Задания оцениваются в 1 балл. Максимальная сумма баллов - 20.
Баллы, полученные за правильно выполненные задания, переводятся в традиционные отметки по шкале:
«5» - 18-20 балла «4» - 15-17 балла,
«3» - 12-14 баллов «2» - 11 баллов и менее.
Вариант 1
1. Число электронов, которые содержатся в атоме углерода равно:
1) 6; 2) 12; 3) 8
2. Электронная формула атома 1s 22s 22p 63s 23p2 . Химический знак этого элемента:
1) C; 2) O; 3) Si
3. Радиусы атомов химических элементов в ряду: хлор, фосфор, алюминий, натрий:
1) увеличиваются; 2) уменьшаются; 3) не изменяются.
4. Химическая связь в молекуле воды:
1) ионная; 2) ковалентная полярная; 3) ковалентная неполярная.
5. Формулы кислотных оксидов:
1) CO2 и CaO; 2) CO2 и SO3; 3) K2O и Al2O3
6. Формула сероводородной кислоты: 1) H2S; 2) H2SO4; 3) H2SO3
7. К реакциям обмена относится:
1) CaO + H2O= Ca(OH)2;
2) Сu(OH)2= CuO + H2O;
3) KOH + HNO3= KNO3 + H2O
8. Электролиты, при диссоциации которых образуются катионы металла, и анионы кислотного остатка называются:
1) кислотами;
2) солями;
3) основаниями.
9. Какая степень окисления хрома в К2Сr2О7?
1) +6; 2) +3; 3) -3; 4) -6.
10. Присутствие в растворе кислоты можно доказать с помощью:
1) лакмуса;
2) фенолфталеина;
3) щелочи
11. Вещества с общей формулой CnH2n относятся к классу
1) алканов 2) алкенов 3) алкинов 4) аренов
12. Вещество, формула которого С2Н6 относится к классу
1) алканов 2) алкенов 3) алкинов 4) Аренов
13. Вещество, формула которого СН3 – СН2 – СН2 – СН3 является
1) алканом 2) алкеном 3) алкином 4) ареном
14. Вещество, формула которого СН2 = СН – СН – СН3 называется
СН3
1) 2-метилбутен-3 2) 2-метилбутин-3 3) 3-метилбутен-1 4) 3-метилбутин-1
15. Характерной химической реакцией для веществ, имеющих общую формулу СnH2n+2, является реакция
1) замещения 2) гидрирование 3) присоединение 4) дегидрирование
16.Укажите «лишнее» вещество в ряду:
1) 3 -метилбутаналь; 2) изопропанол;
3) метаналь; 4) ацетальдегид.
17. Дайте название соединению
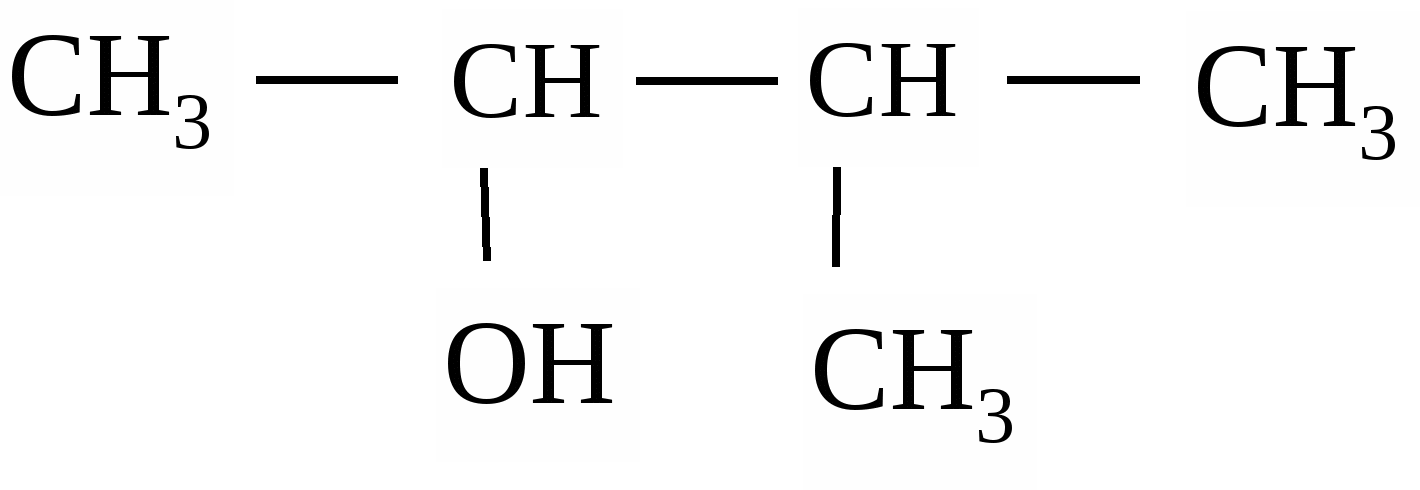
1) 3-метилбутанол-2; 2) 2-метилбутанол-3;
3) 3-метилпропанон-2; 4) 2-метилпропаналь-2.
18. Функциональная группа – СОН характерна для:
1) альдегидов; 2) сложных эфиров;
3) простых эфиров; 4) спиртов.
19. Вещество, относящееся к аминам, имеет формулу
1)С6Н5—NO2 2) С6Н5—NH2
3)С6Н5—СН3 4) С6Н5—OH
20. Мономерами белков выступают:
1) аминокислоты; 2) моносахариды;
3) нуклеотиды; 4) остатки фосфорной кислоты.
Вариант 2
1. Число нейтронов, которые содержатся в атоме кислорода равно:
1) 6; 2) 12; 3) 8.
2. Формула высшего оксида элемента, электронная формула которого 1s 22s22p 63s 23p3 :
1) N2 O5 ; 2) P2 O5; 3) B2O3 .
3. Наиболее ярко выраженные неметаллические свойства проявляет:
1) фосфор; 2) сера; 3) кремний.
4. Формула вещества с ковалентной полярной связью:
1) H2O; 2) O2; 3) CaCl2
5. Формула основания и кислоты соответственно:
1) Ca(OH)2 и Be(OH)2 ;
2) NaOH и KHSO4;
3) Al(OH)3 и HNO3
6. Формула сульфита натрия:
1) Na2SO4; 2) Na2SO3; 3) Na2S
7. К реакциям замещения относится:
1) Ca + H2SO4= CaSO4 + H2;
2) Сu(OH)2= CuO + H2O;
3) KOH + HNO3= KNO3 + H2O
8. Электролиты, при диссоциации которых образуются катионы металла и гидроксид-ионы называются:
1) солями; 2) кислотами; 3) основаниями.
9. В ПСХЭМ в группе сверху вниз увеличивается:
1) металлические свойства; 2) сила высших кислот;
3) электроотрицательность атома; 4) неметаллические
10.Назовите элемент, электронная формула которого:
1s2, 2s2, 2p6, 3s2, 3p5
1) фосфор; 2) сера; 3) хлор; 4) кислород.
11. Для алканов характерна общая формула
1)CnH2n 2)CnH2n+2 3)CnH2n-2 4)CnH2n-6
12. К классу алкенов относится вещество с молекулярной формулой
1) С6Н10 2) С6Н6 3) С6Н12 4) С6Н14
13. Вещество, формула которого СН3 – С ≡ С – СН3 является
1) алканом 2) алкеном 3) алкином 4) ареном
14. Гомологом этана является
1) С2Н4 2) С2Н6 3) С3Н8 4) С3Н6
15. Укажите название соединения СН2 = СН - СН2 - СН2 - СН2 - СН3
1) 3,3-диметилбутин-1; 2) октин-1; 3) 3,3-диметилпентин-1; 4) гексен-1
16. Для алкенов характерна реакция
1) замещения 2) обмен 3) присоединения 4) дегидратации
17. Дайте название соединению:
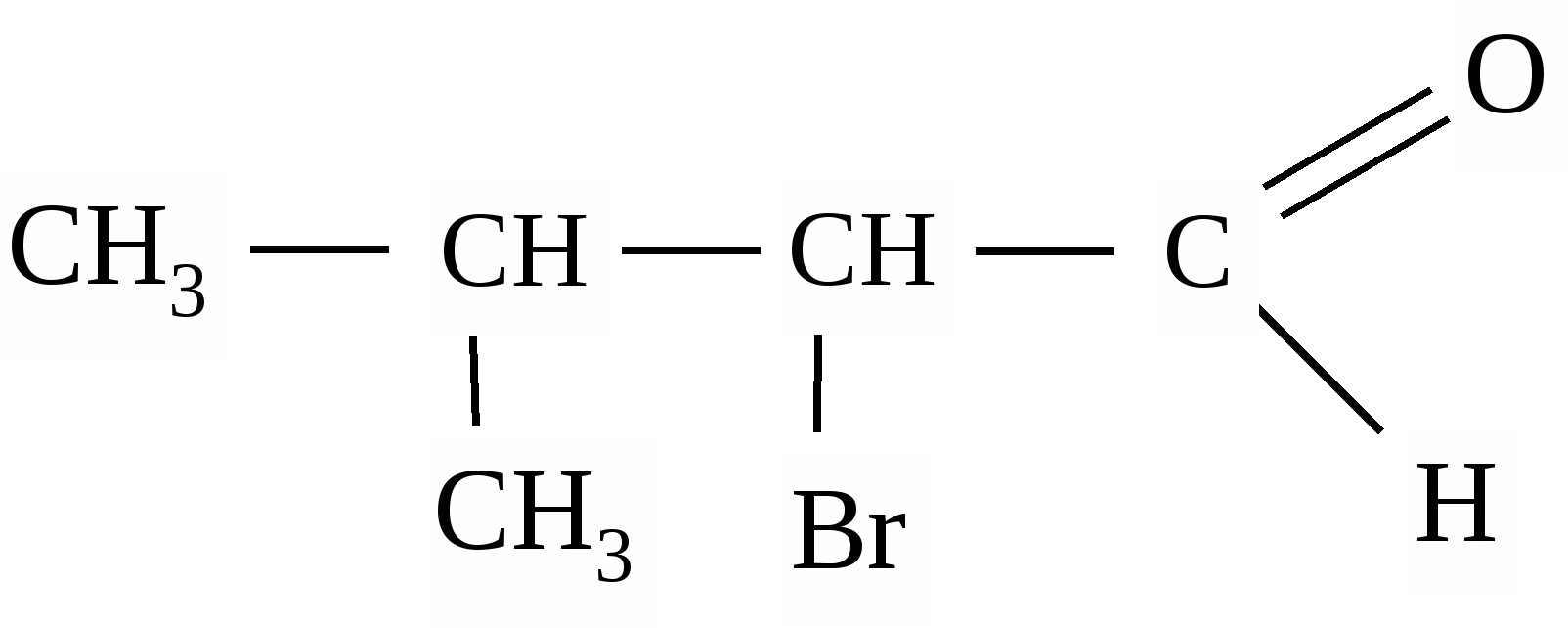
1) 2-метил-3-бромбутанол-1; 2) 2-бром-З-метилбутаналь;
3) 2-бром-З-метилпропаналь; 4) 2-метил-З-бромбутаналь.
18.Укажите «лишнее» вещество в ряду:
1) метанол; 2) этаналь; 3) пентанол; 4) бутиловый спирт.
19. Функциональная группа – СОО- характерна для
1) альдегидов; 2) сложных эфиров; 3) углеводов; 4) спиртов.
20. В состав белков может входить
1)пять аминокислот; 2) двадцать аминокислот;
3)десять аминокислот; 4) тридцать аминокислот
КЛЮЧИ К ДИФФЕРЕНЦИРОВАННОМУ ЗАЧЕТУ
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | |
| | 1 | 3 | 1 | 2 | 2 | 1 | 3 | 2 | 1 | 1 | 2 | 1 | 1 | 3 | 1 | 2 | 1 | 1 | 2 | 1 |
| В2 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| | 3 | 2 | 2 | 1 | 3 | 2 | 1 | 3 | 1 | 3 | 2 | 3 | 3 | 3 | 4 | 3 | 2 | 2 | 2 | 2 |
Список использованной литературы
1. Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. – М., 2005.
2. Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова – М., 2006.
3. ПЕРЕЧЕНЬ МАТЕРИАЛОВ, ОБОРУДОВАНИЯ И ИНФОРМАЦИОННЫХ ИСТОЧНИКОВ
3.1 Рекомендуемая литература для разработки оценочных средств и подготовки обучающихся к аттестации
-
Габриелян О.С., Остроумов И.Г. Химия: - М.: Академия, 2010. – 257с.
-
Глинка Н.Л. Общая химия:- М.: Юрайт,2012. – 898с.
-
Харитонов Ю.Я. Аналитическая химия (аналитика). В 2кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа: Учеб. Для вузов. – 2-е изд., испр. – М.:Высш.шк., 2003. – 559с.: ил.
-
Физическая и коллоидная химия (в общественном питании): Учебное пособие/ С.В.Горбунцова, Э.А.Муллоярова, Е.С.Оробейко, Е.В.Федоренко. – М.: Альфа-М;ИНФРА-М, 2008. – 270с.: ил. – (Серия «Профиль»).
-
Белик В.В. Физическая и коллоидная химия: учебник для студ. сред. проф. учеб. заведений – 4-е изд., стер. – М.:Издательский центр «Академия», 2008. – 288 с.
-
Задачи и упражнения и упражнения по общей химии6 Учеб. пособие/ Б.И.Адамсон, О.Н.Гончарук, В.Н. Камышова и др.; Под ред. Н.В.Коровина. – 2-е изд., испр. – М.:Высш. шк., 2004. – 255 с.: ил.
Здесь представлены материалы теста на тему «Тесты по химии», которые могут быть просмотрены в онлайн режиме или же их можно бесплатно скачать. Предмет теста: Химия (все классы). Также здесь Вы найдете подборку тестов на схожие темы, что поможет в еще лучшей подготовке к тестированию.

