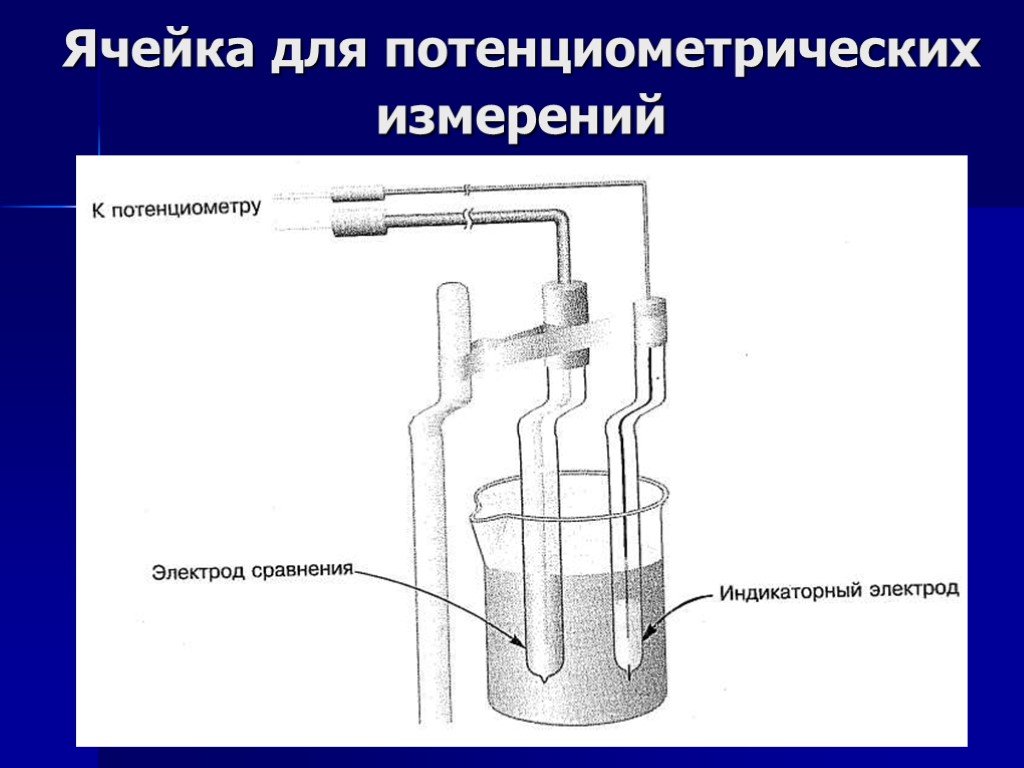
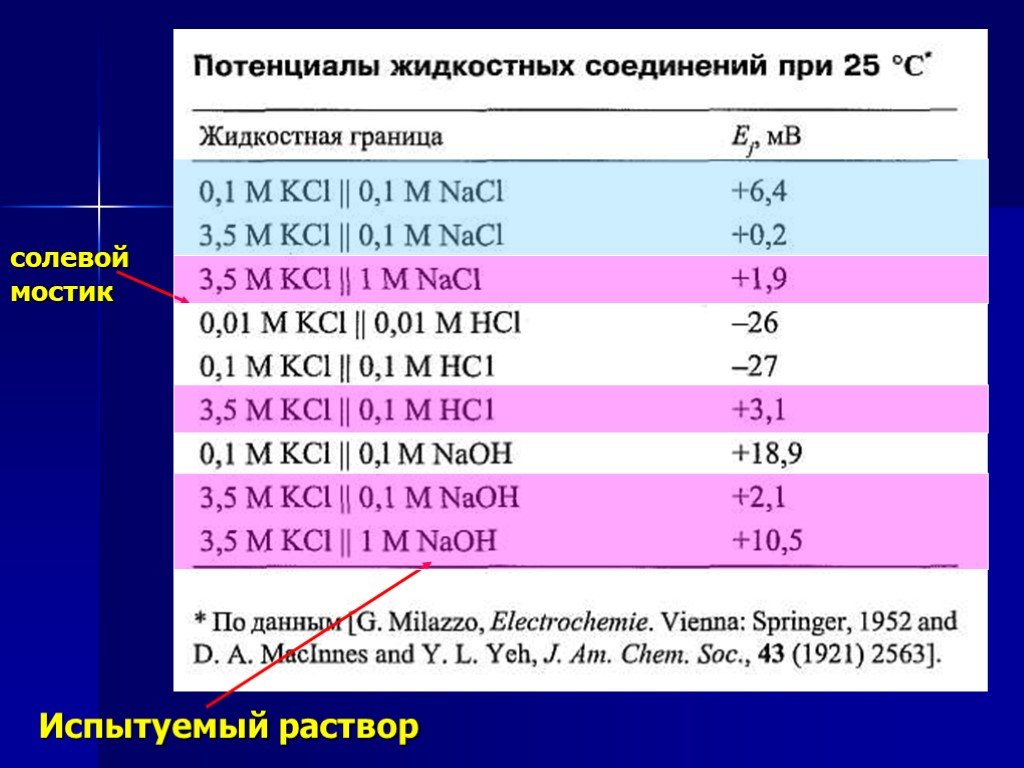
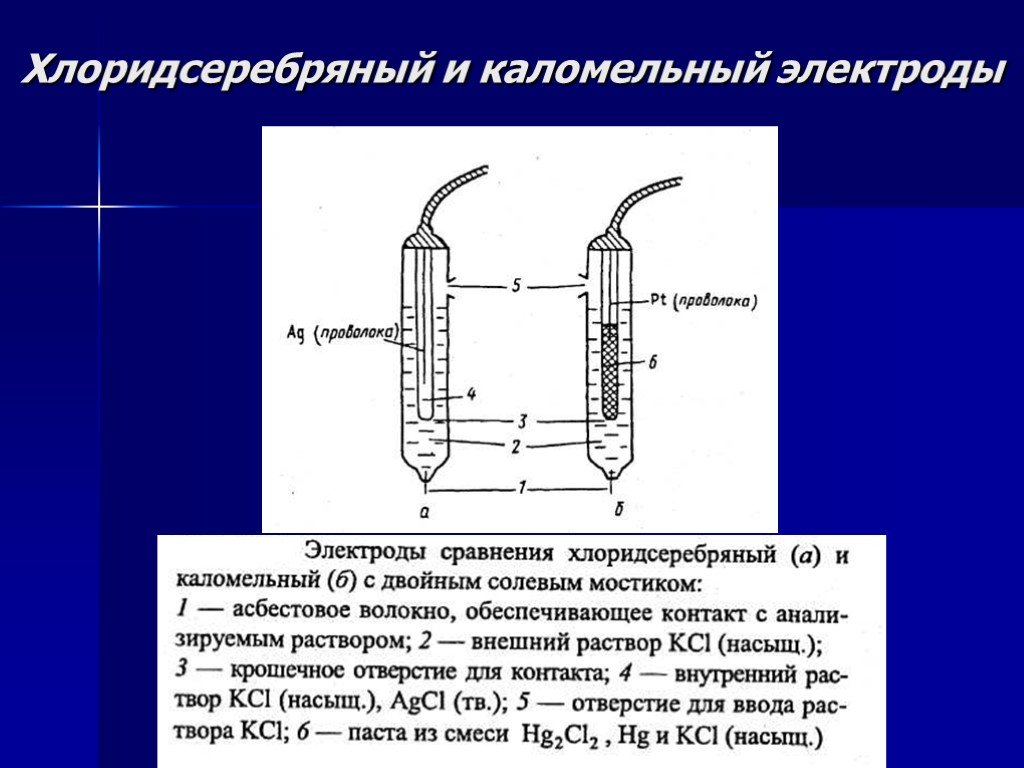
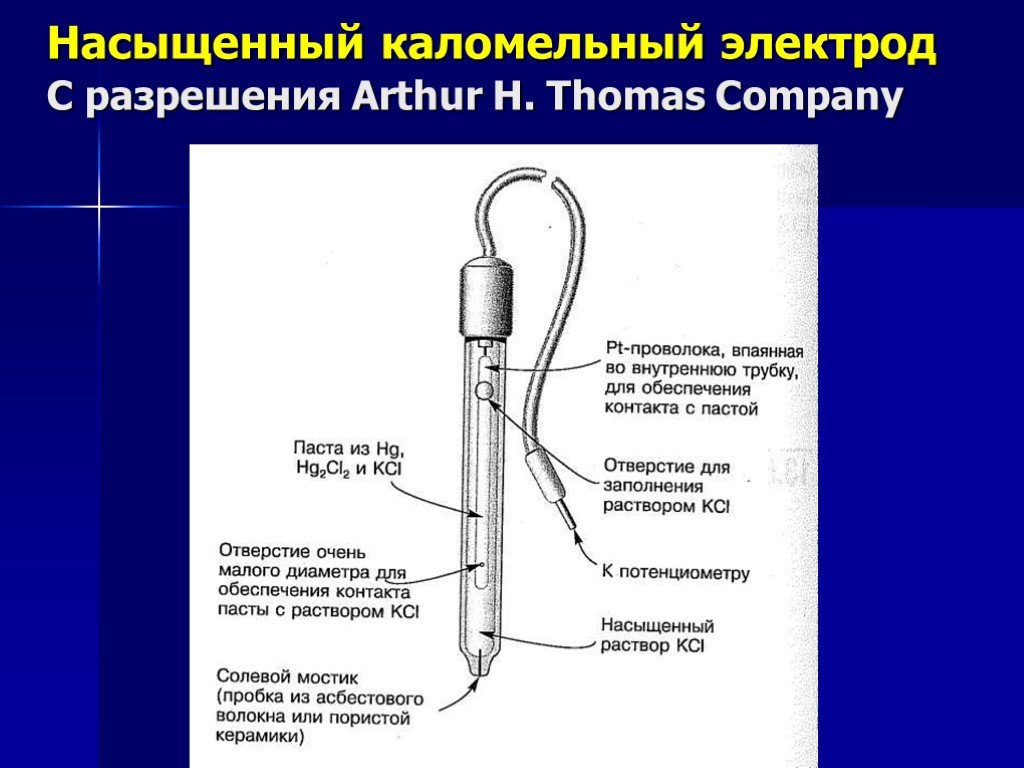
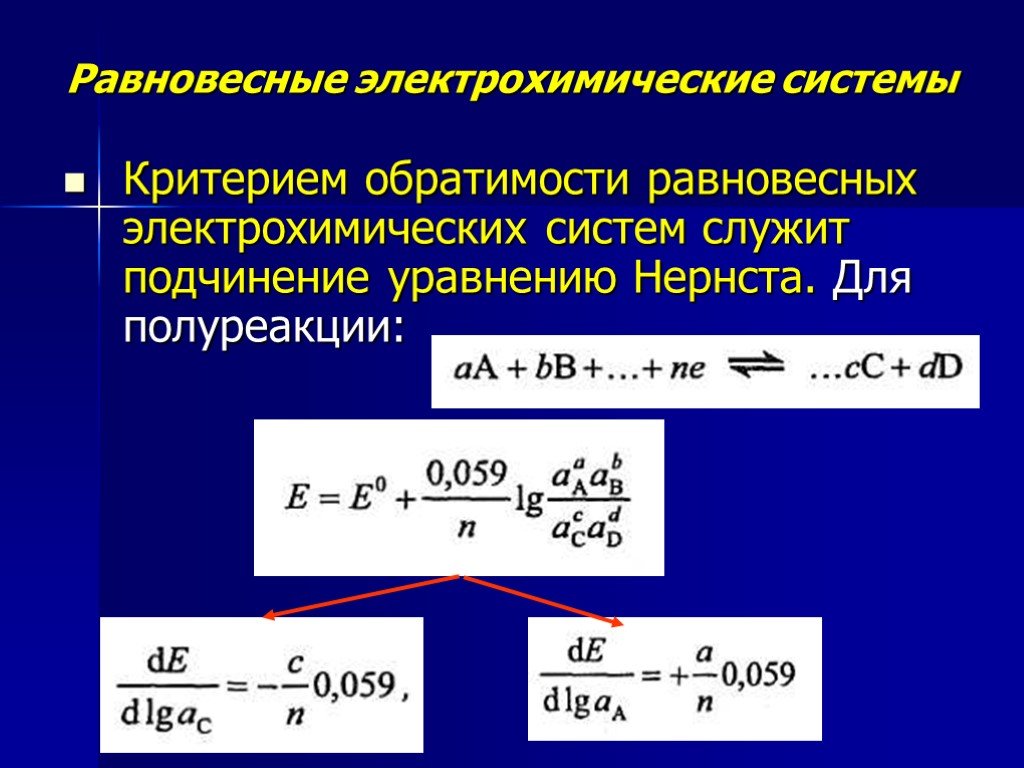
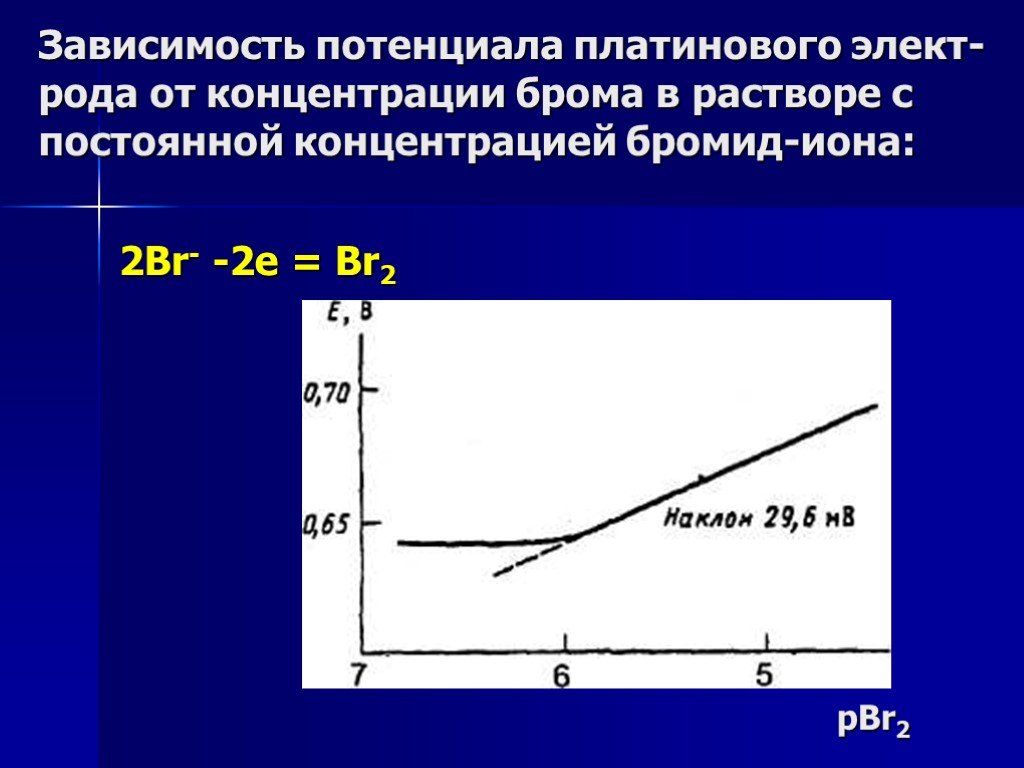
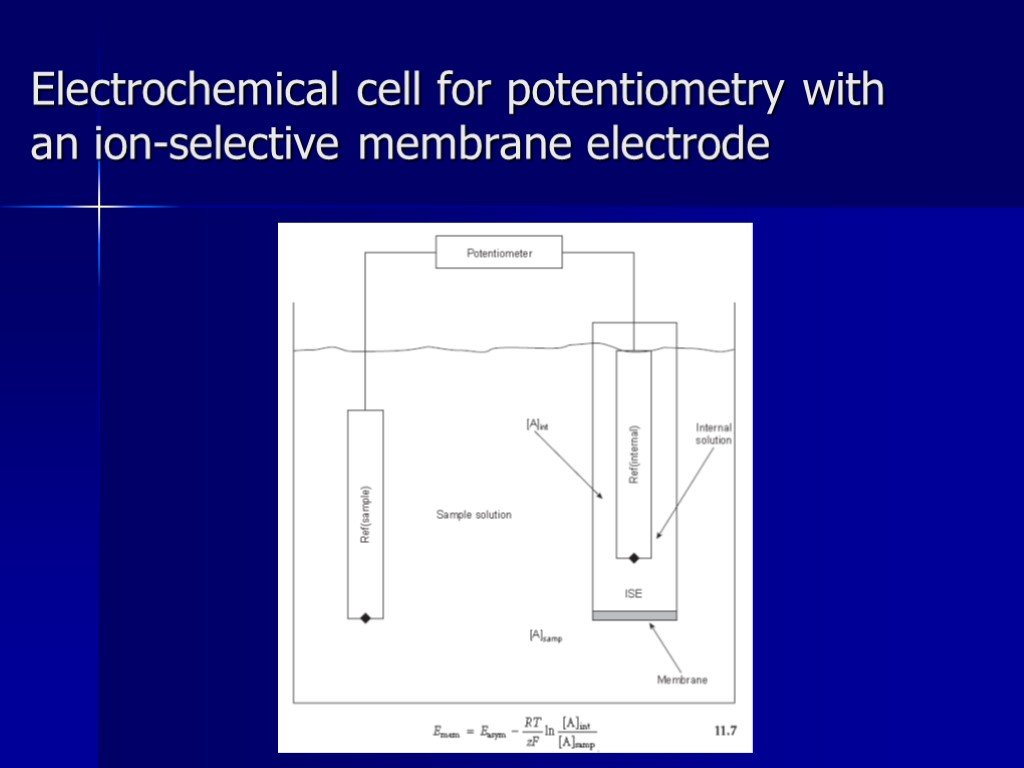
Презентация "Потенциометрический метод анализа" – проект, доклад
Презентацию на тему "Потенциометрический метод анализа" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Разные. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 29 слайд(ов).
Слайды презентации
Список похожих презентаций
Методика анализа оплаты труда
Управление оплатой труда в условиях рыночной экономики базируется на концепции затрат на прирост прибыли, согласно которой каждая дополнительная единица ...Методы анализа ДНК
Что такое ДНК - диагностика. ДНК-диагностика - это совокупность методов и технологий, которые позволяют выявлять повреждения в определенном гене человека, ...История создания математического анализа
Математи́ческий ана́лиз — совокупность разделов математики, посвящённых исследованию функций и их обобщений методами дифференциального и интегрального ...Итерационные методы решения линейных алгебраических систем1. Метод простой итерации или метод Якоби
Предположим, что диагональные элементы матриц A исходной системы не равны 0 (aii ≠ 0, i = 1, 2, …, n). Разрешим первое уравнение системы относительно ...Инвентаризация – основной метод, контроля и аудита имущества и обязательств организации (на примере ООО «МебельАрт»)
Цель работы - исследование инвентаризации как основной метод учета, контроля и аудита имущества и обязательств организации для разработки рекомендаций ...Инструментальный метод удаления зубных отложений.
Ручные инструменты для удаления зубных отложений. Для удаления зубных отложений ручным способом используются специальные инструменты — скейлеры, кюреты, ...Дерматоглифический метод исследования
Основные методы изучения генетики человека. Генеалогический Цитогенетический Биохимический Близнецовый Популяционно-статистический Дерматоглифический ...Дедуктивный метод
Дедуктивный метод Шерлока Холмса:. Дедуктивный метод Шерлока Холмса: На основе всех фактов и улик строится полная картина преступления. Отталкиваясь ...Выборочный метод в исследовании
Ангус Дитон. - восхождение от частного к общему - Почти идеальная система спроса - Парадокс Дитона - изучение «счастья». . Исследования сплошные и ...Балансовый метод
С помощью балансового метода реализуется принцип сбалансированности и пропорциональности. Он применяется при разработке прогнозов, планов и программ. ...SEO – новый эффективный метод рекламы
1. SEO – новый эффективный метод рекламы. Search Engines Optimization – оптимизация под поисковые системы. SEO–студии подстраивают сайты под алгоритмы ...Методы исследования при заболеваниях сердечнососудистой системы
В диагностическом процессе при заболеваниях сердечнососудистой системы используются как субъективные и объективные методы исследования больного, так ...Методы и системы мотивации
Мотивация. Мотивация-это внутреннее состояние человека, вызванное внешним и внутренним воздействием, связанное с его потребностями, которое активизирует, ...Методология и методы психолого-педагогического исследования
Термин методология греческого происхождения и означает «учение о методе» или «теория метода». В современной науке методология понимается в узком и ...1. Активные формы и методы обучения
Сейчас мы находимся на новом этапе развития потребностей общества. Информационный бум, формирование рыночных отношений в мире труда, сложные экономические ...Аппаратные методы диагностики и коррекции в специальной педагогике
История создания технических средств поддержки коррекционного процесса. Разработка вспомогательных средств, направленных на формирование и коррекцию ...Криптографические методы защиты
Введение. Криптографические методы в настоящее время являются базовыми для обеспечения надежной аутентификации сторон информационного обмена, защиты ...Магнитные методы неразрушающего контроля
Содержание. Основные понятия и средства МК Типы приборов МК Область применимости МК Классификация методов МК Обзор методов МК Достоинства и недостатки ...Курение как фактор риска, методы коррекции.
Табак на экспорт или для внутреннего употребления выращивается более чем в 100 странах мира. Те из них, которые занимают ведущее место по производству, ...Качественные методы оценки риска
Среди качественных методов оценки риска используются следующие. Метод экспертных оценок Метод мозгового штурма Синектический метод Метод Дельфи. 1. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:11 октября 2018
Категория:Разные
Содержит:29 слайд(ов)
Поделись с друзьями:
Скачать презентацию