Слайд 1Глобальный цикл углерода в биосфере
Основы биогеохимии Тема 8 Д.Ю. Шишкина
Слайд 2Циклы массобмена элементов
Существует глубокая связь химического состава земной коры, Мирового океана и атмосферы. Эта связь обусловлена процессами массобмена между геосферами. Процессы изначально носили циклический характер по причине суточных, сезонных, годовых и др. колебаний поступавшей от Солнца энергии. Источники поступления химических элементов в циклы массобмена: гипергенная мобилизация и выщелачивание из гранитного слоя континентальной коры; дегазация мантии, вынос вулканических газов. Элементы, выделявшиеся в виде газов, образовали газовую оболочку, гидросферу и живое вещество. Углерод, кислород, сера, азот.

Слайд 3Биогеохимические характеристики углерода
Кларк в литосфере равен 2,3 × 10-2%, чистых известняках – 12%, каменном угле – 80, нефти 85%. Число собственных минералов – 112. В земной коре, в основном, находится в виде известняков и доломитов. Живое вещество является аккумулятором углерода. В растениях на его долю приходится 45%, в животных – 63% от массы сухого вещества. В гумусе почвы С составляет 58%. Наиболее распространенным соединением С является диоксид углерода СО2, который ассимилируется зеленым листом растений в процессе фотосинтеза. В зоне гипергенеза, особенно в почвах, может накапливаться до 3% СО2. С – 4-й по распространенности элемент в космосе (после H, He, O).
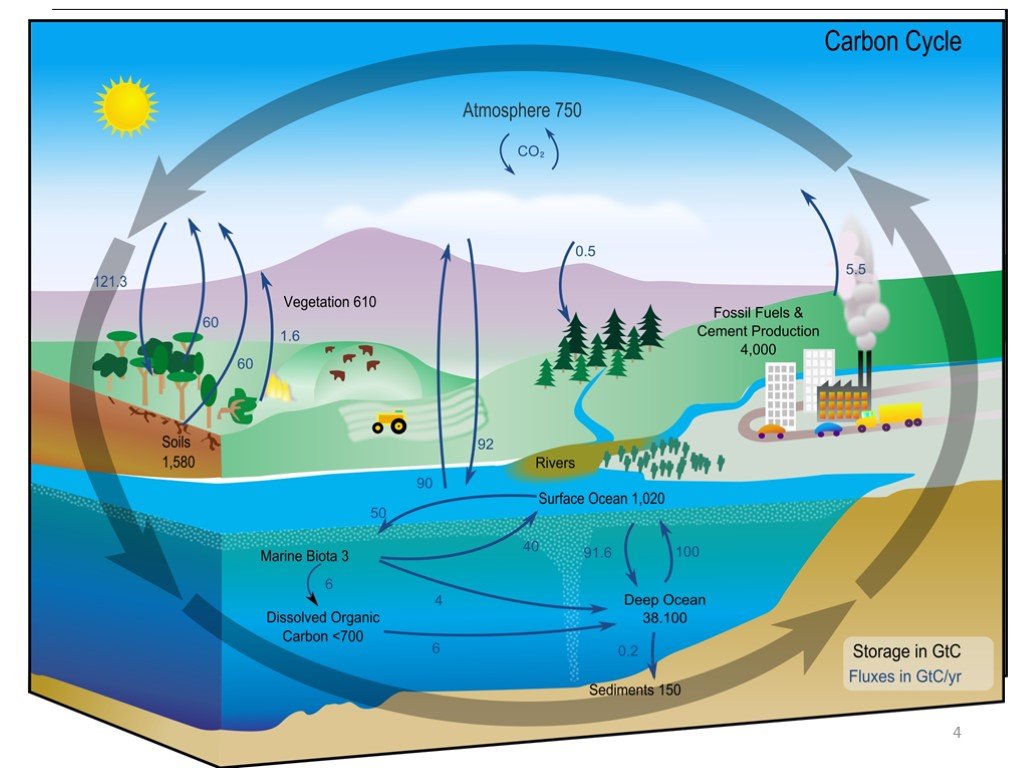
Слайд 4
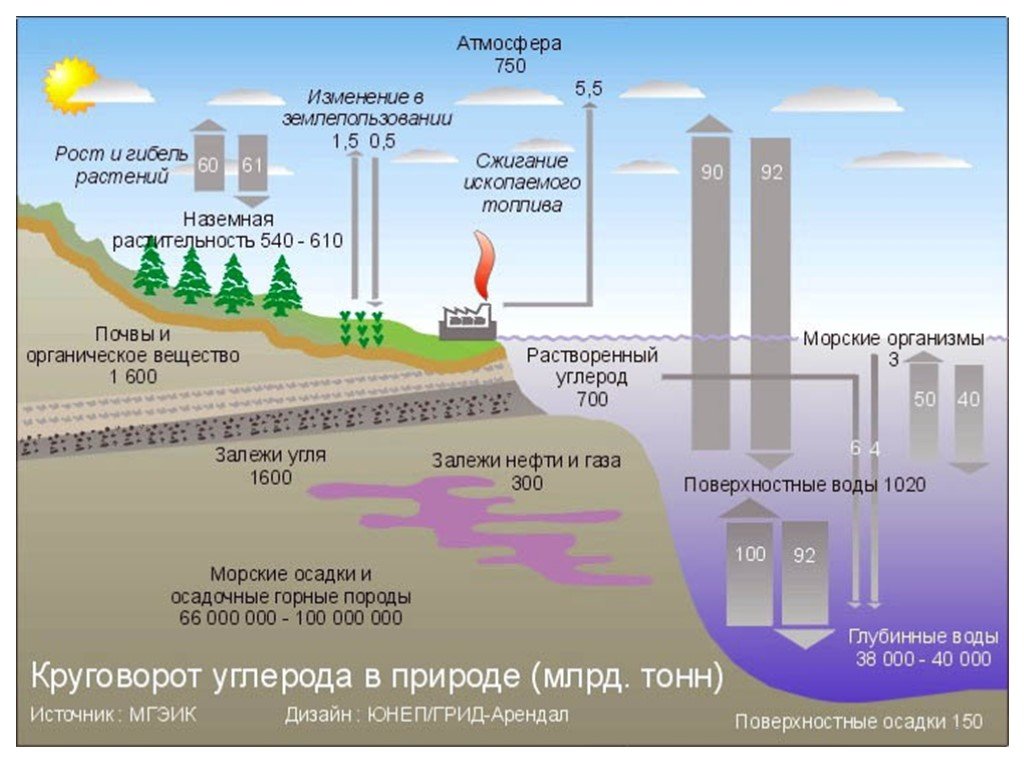
Слайд 5
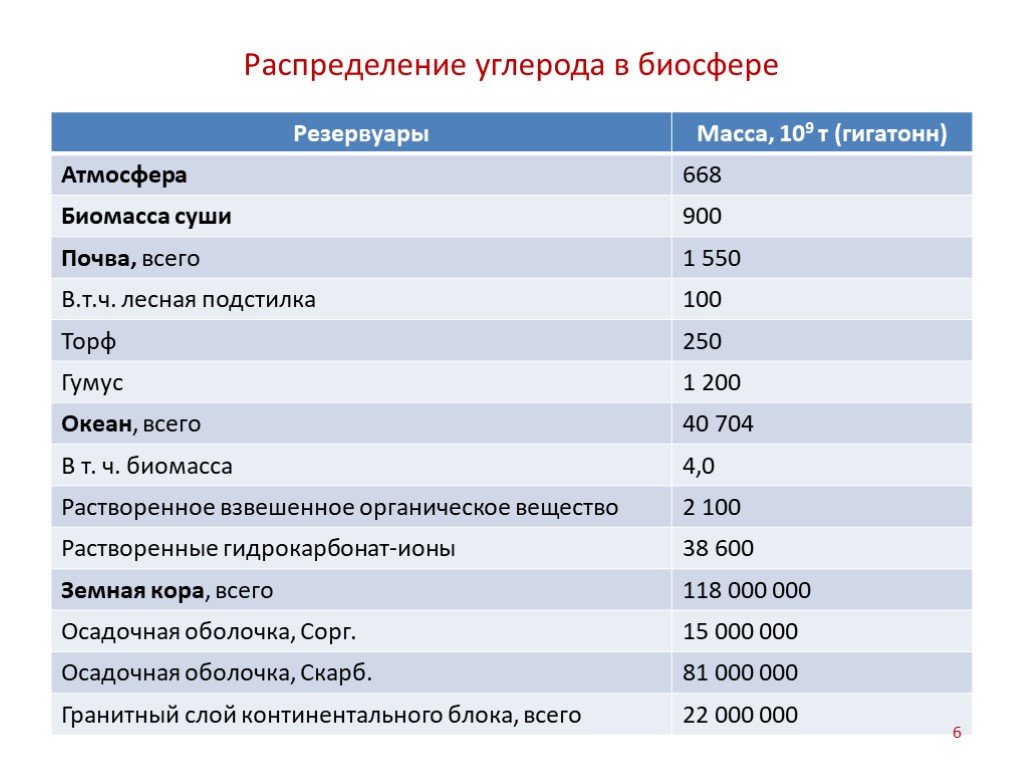
Слайд 6Распределение углерода в биосфере
Слайд 8Фотосинтез
Глобальный биогеохимический цикл углерода состоит из 2-х крупных циклов более низкого ранга. Первый обусловлен связыванием углекислого газа в органическое вещество путем фотосинтеза и новым образованием СО2 в процессе трансформации первичного органического вещества организмами-гетеротрофами и почвенными микроорганизмами. Если бы этот цикл был полностью замкнутым, то количество поглощенного при фотосинтезе углекислого газа должно полностью возвращаться в исходный резервуар – атмосферу. 6CO2 + 6H2O = C6H12O6 + 6O2 На протяжении года живое вещество суши и океана поглощает около 440 × 109 т СО2 или 120 × 109 т Сорг, большая часть которого вновь возвращается в океан и атмосферу.

Слайд 9Взаимодействие СО2 атмосферы и природных вод
Между газами тропосферы и поверхностным слоем океана существует подвижное равновесие. Растворимость газов воде зависит от давления, температуры, а также от количества растворенных солей. Увеличение роста растворимости происходит по мере роста парциального давления согласно зависимости Дальтона-Генри. В пресной воде газы растворяются больше, чем в соленой, но из-за малого количества пресных вод на Земле в глобальном балансе СО2 они играют скромную роль. Растворимость СО2 уменьшается с возрастанием температуры: при 0°С растворяется 1,71 мл/л; при 25°С – 0,76. Среднее содержание углекислого газа, растворенного в морской воде, равно 0,75 мл/л. В отличие от других газов СО2 вступает в химическое взаимодействие с морской водой. При этом образуется угольная кислота: СО2 + Н2О ↔ Н2СО3. Эта кислота двухосновная и диссоциирует ступенчато, образуя карбонат-гидрокарбонатную систему: Н2СО3 ↔ Н+ + НСО3-; НСО3- ↔ Н+ + СО32-.

Слайд 10Массообмен СО2 между атмосферой и океаном
Углекислый газ активно растворяется в холодной воде приполярных районов океана. При охлаждении возрастает и плотность воды. Массы холодной воды опускаются на глубину и в виде мощных холодных течений перемещаются к экватору. Они постепенно нагреваются, уменьшают плотность, поднимаются наверх и освобождаются от избытка СО2. Океан действует как грандиозный насос, забирая СО2 из атмосферы в холодных областях и отдавая его в тропических областях. На массообмен СО2 между поверхностным слоем океана и тропосферой весьма активно влияют живое вещество планктона, освещенность, сезонно-термические условия. Определенный вклад в массообмен углерода между атмосферой и океаном вносит захват гидрокарбонатов ветром с брызгами волн и возвращение их в океан с атмосферными осадками. Полная карбонат-гидрокарбонатная система включает образование карбоната кальция: Атмосфера СО2 ↑↓ Океан Н2О ↔ Н2СО3 ↔ Н+ + НСО3- ↔ Н+ + СО32- + Са2+ ↑↓ СаСО3

Слайд 11Фракционирование изотопного состава углерода
Масса земного углерода состоит из двух стабильных изотопов 12С и 13С и исчезающее малых количеств 14С (радиоактивный с периодом полураспада 5730 лет). Соотношение 12С : 13С варьирует в разных природных объектах от 88 до 94. В живом веществе около 90,5; в углекислом газе атмосферы и гидросферы 89,5; в карбонатных отложениях 88,6. Во время фотосинтеза происходит более быстрое поглощение легкого изотопа 12С и вследствие этого обогащение им углерода органического вещества. Особенно активно этот процесс происходит под влиянием микробиологических процессов. По этой причине метан микробиологического происхождения максимально обогащен легким изотопом. Так как фотосинтезируемое органическое вещество захватывает 12С, карбонаты обогащены тяжелым изотопом 13С.

Слайд 12Соотношение масс органического и карбонатного углерода
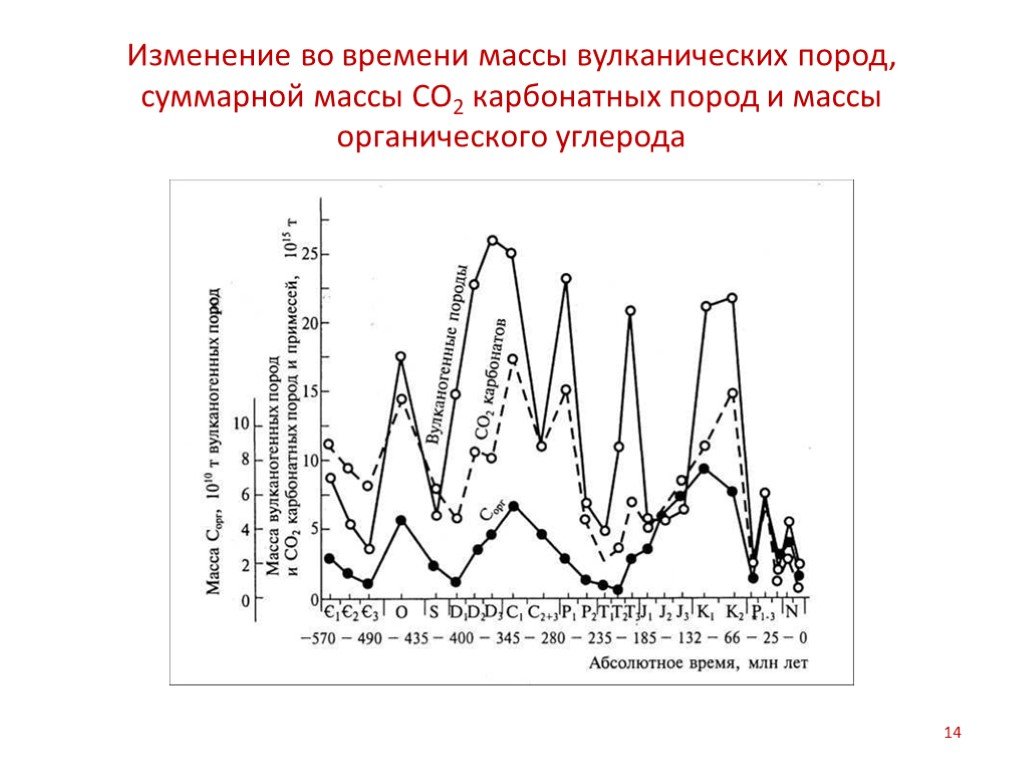
На протяжении длительного времени происходило закономерное распределение исходного СО2 между фотосинтезом и образованием карбонатов. При этом более 80% углерода, поступавшего в атмосферу при дегазации мантии, связывалось в карбонатах. Соотношение масс Ск и Сорг является важным показателем, который характеризует «лимит роста» живого вещества на разных этапах геологической истории. Соотношение масс карбонатного и органического углерода закономерно уменьшалось на протяжении последних 1,6 млрд. лет. Так, в толще осадков верхнего PR (1600-570 млн. лет) отношение Ск : Сорг = 18; в осадочной толще PZ (570-400 млн. лет) – 11; в осадках MZ (235-66 млн. лет) – 5,2; KZ – 2,9. Неуклонное возрастание относительного содержания органического вещества во взвесях, выносимых реками с древней суши, свидетельствует об увеличении продуктивности наземных фотосинтезирующих организмов и о постепенном усилении роли растительности Мировой суши в глобальной фиксации СО2. Карбонатообразование и фотосинтез органического вещества имеют общую направленность на удаление из атмосферы СО2, непрерывно поступающего из мантии. Возможно, что эти процессы являются частью глобального механизма поддержания невысокой концентрации СО2 в газовой оболочке Земли.

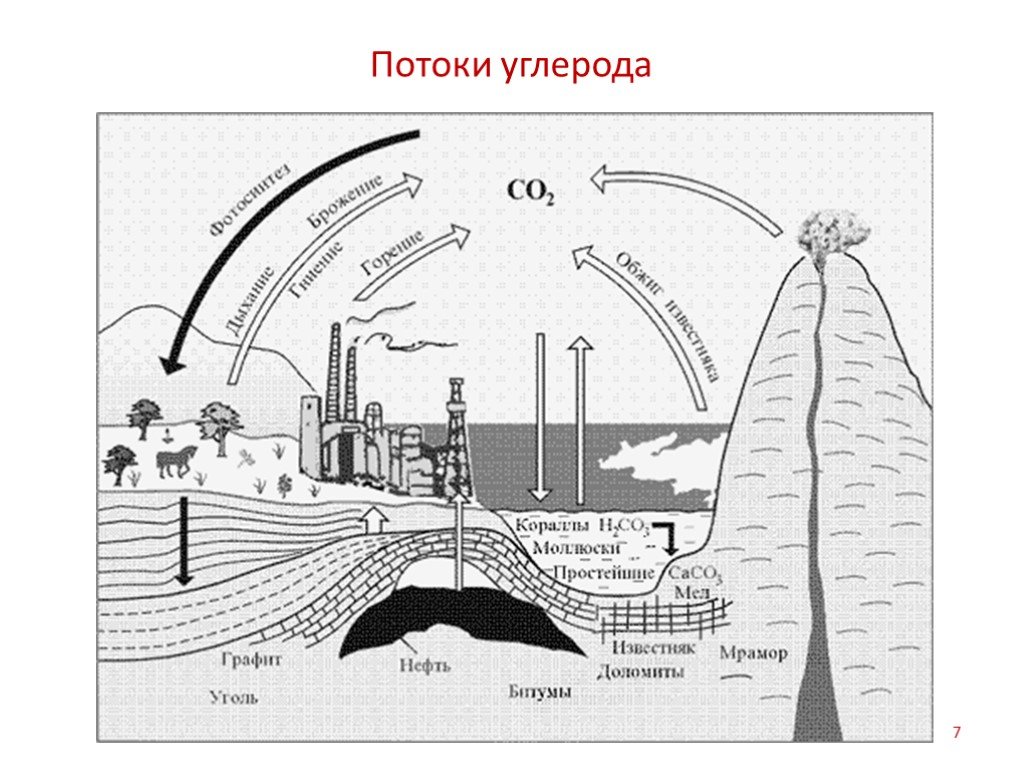
Слайд 13Вулканические газы как источник СО2 в атмосфере
Были определены объемы всех типов осадочных горных пород, образованных на протяжении фанерозоя, и рассчитано количество углерода, содержащегося в карбонатных породах и рассеянном органическом веществе. Одновременно установлен объем вулканических лав, которые изливались в те периоды, когда отлагались осадки. Обнаружено, что массы СО2, связанного в карбонатных толщах, и углерода, содержащегося в рассеянном органическом веществе древних пород, изменяются согласно с колебаниями величин объемов вулканических пород. В те эпохи, когда происходили бурные извержения вулканов и изливалось огромное количество лавы, отлагалось особенно много карбонатных пород и рассеянного органического вещества. Объем лав отражает интенсивность выноса вулканических газов.
Слайд 14Изменение во времени массы вулканических пород, суммарной массы СО2 карбонатных пород и массы органического углерода

Слайд 15Влияние СО2 на изменение климата
Создание биосферы и поддержание ее функционирования обусловлены геохимической деятельностью живого вещества. Если бы организмы не обеспечивали геохимический цикл С, поддерживающий невысокую концентрацию СО2 в атмосфере, то захороненное количество углерода находилось бы в виде углекислого газа в атмосфере в десятки тысяч раз больше, чем сейчас. Это имело бы самые серьезные последствия из-за парникового эффекта. Молекулы СО2 в атмосфере поглощают инфракрасное (тепловое) излучение Земли и излучают поток энергии к земной поверхности. Сильное повышение содержания углекислого газа могло вызвать очень сильное повышение температуры и разогревание поверхности планеты вплоть до испарения Мирового океана. Усиление притока углекислого газа в периоды активного вулканизма, по-видимому, сопровождалось общим потеплением климата, уменьшением контрастности температур высоких и низких широт. Некоторые ученые предполагают, что смена ледниковых и межледниковых периодов в плейстоцене обусловлена колебаниями содержания углекислого газа в атмосфере. Можно допустить, что распространение материкового льда и сильное сокращение площади лесной растительности с характерной высокой биомассой способствовало повышению углекислоты в воздухе и относительному потеплению. Вызванное этим сокращение ледников и распространение лесов сопровождалось изъятием СО2 из атмосферы и связыванием его в биомассе и органическом веществе педосферы, что в свою очередь взывало постепенное похолодание и появление очередного материкового оледенения, за которым следовало сокращение площади лесов и повторение всего цикла.