Слайд 1«Людям я совсем как брат. Много тысяч лет назад Я уже пылал в костре, Освещая интерьер Первобытных их пещер.
И украсить был я рад Дам и рыцарей наряд, Что блистали при дворе… Если мягким быть решу,- То в тетради я пишу.» Такова, друзья, природа Элемента …………!
Слайд 2Углерод
Учитель химии Сташкова А.Э.
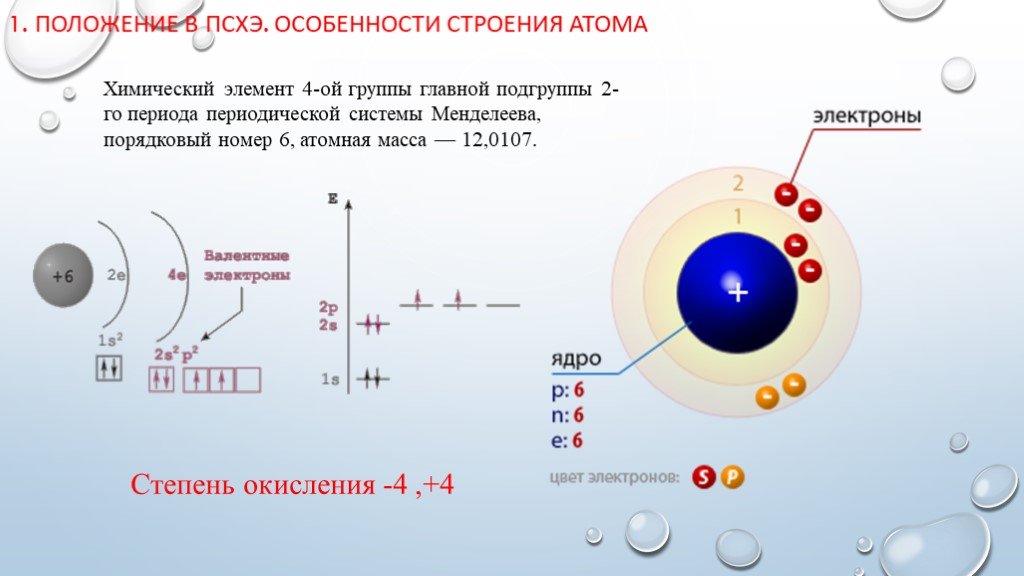
Слайд 31. Положение в ПСХЭ. Особенности строения атома
Химический элемент 4-ой группы главной подгруппы 2-го периода периодической системы Менделеева, порядковый номер 6, атомная масса — 12,0107.
Степень окисления -4 ,+4
Слайд 4Углерод в виде древесного угля применялся в глубокой древности для выплавки металлов. Издавна известны аллотропные модификации углерода — алмаз и графит.
В 1772 году французский химик Антуан Лоран Лавуазье показал, что при сгорании алмаза образуется углекислый газ.
В 1797 году английский химик Смитсон Теннант (1761-1815) установил, что алмаз, графит и древесный уголь имеют одинаковую химическую природу.
2. Открытие углерода

Слайд 53. Изотопы углерода
Природный углерод состоит из двух стабильных изотопов — 12С (98,93 %) и 13С (1,07 %) и одного радиоактивного изотопа 14С (β-излучатель, Т½= 5730 лет), сосредоточенного в атмосфере и верхней части земной коры. Он постоянно образуется в нижних слоях стратосферы в результате воздействия нейтронов космического излучения, а также, с середины 1950-х годов, как техногенный продукт работы АЭС и в результате испытания водородных бомб. На образовании и распаде 14С основан метод радиоуглеродного датирования, широко применяющийся в четвертичной геологии и археологии.
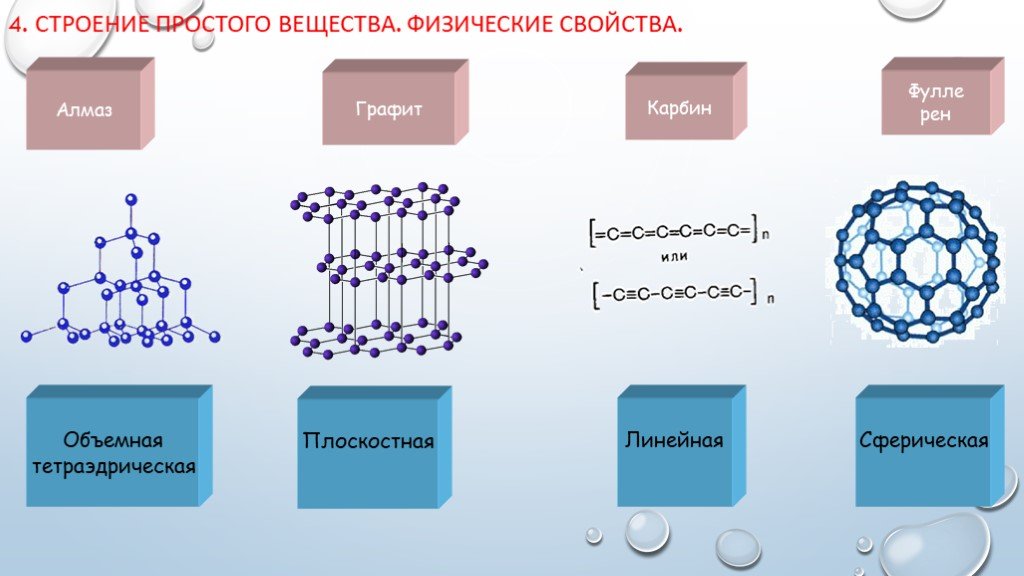
Слайд 64. Строение простого вещества. Физические свойства.
Алмаз Графит Карбин Фулле рен
Объемная тетраэдрическая
Плоскостная Линейная Сферическая
Слайд 7Бесцветный Прозрачный Не проводит электрический ток Прочный Твердый
Алмаз тверже всех найденных в природе веществ, но при этом довольно хрупок. Алмазы очень редки и ценны, их вес измеряется в каратах (1 карат =200мг). Ограненный алмаз называют бриллиантом.
Слайд 8Крупнейшие в мире алмазы: “Куллинан” - 3106 карат
Слайд 9“Эксельсиор” - 971,5 карат
Слайд 10Орлов” – 190 карат
Слайд 11Значительные месторождения алмазов находятся в Южной Африке, Бразилии, Якутии. Крупнейший в мире синий алмаз “Хоуп” - 44,5 карат, владельцы которого нередко погибали при загадочных обстоятельствах, хранится в музее Смитсоновского института (США).
Слайд 12Темно-серый Непрозрачный Проводит электрический ток Мягкий Металлический блеск Оставляет след на бумаге Жирный на ощупь
Крупные залежи графита находятся в Германии, Шри-Ланке, Сибири и на Алтае. Из графита изготавливают электроды, твердые смазки, стержни для карандашей.
Слайд 13Аморфный углерод
Активированный уголь - пористое вещество, которое получают из различных углеродсодержащих материалов органического происхождения: древесный уголь , каменноугольный кокс, кокосовый уголь и др. . Классический пример использования активированного угля связан с использованием его в противогазе. Н. Д. Зелинский разработал противогаз, который спас множество солдат в первой мировой войне. Так же применяется в медицине, химической, фармацевтической и пищевой промышленностях.
Адсорбция
- свойство углерода удерживать на пористой поверхности растворенные вещества и газы

Слайд 14При нагревании углерод соединяется с кислородом, образуя оксид углерода (IV), или углекислый газ: С + O2 = CO2 При недостатке кислорода образуется оксид углерода (II), или угарный газ: 2С + О2 = 2СО С водородом углерод соединяется только при высоких температурах и в присутствии катализаторов. В зависимости от температуры образуются различные углеводороды, например, метан: С + 2H2 = CH4 Углерод взаимодействует при нагревании с серой и фтором, в электрической дуге с азотом: С + 2S = CS2 С + 2F2 = CF4 2С + N2 = (CN)2
1. Восстановительные – атомы С отдают 4 (2) электрона, приобретают при этом степень окисления +4 (+2).
5. Химические свойства.

Слайд 15При нагревании с водяным паром он вытесняет из воды водород: Н2O + С = СО + Н2 При нагревании углерода с оксидом углерода (IV) образуется угарный газ: С + СО2 = 2СО Углерод восстанавливает многие металлы из их оксидов: 2Fe2O3 + 3С = 4Fe + 3CO2 С металлами или их оксидами углерод образует карбиды: CaO + 3C = CaC2 + СО
2. Окислительные – атомы С принимают четыре электрона, приобретают при этом степень окисления -4
Слайд 165. Оксиды углерода.
Оксид углерода (II) монооксид углерода, окись углерода С=О
2С + О2 = 2СО СО2 + С = 2СО Получение CO:
СО – несолеобразующий оксид, хороший восстановитель CO + O2 = CO2,
Хим. свойства CO:
Слайд 17Физические св-ва оксидов углерода:
CO2 углекислый газ Без цвета Без запаха В воде растворяется 1:1 Применяют При тушении пожаров При хранении продуктов Для получения соды Про-во газированной воды
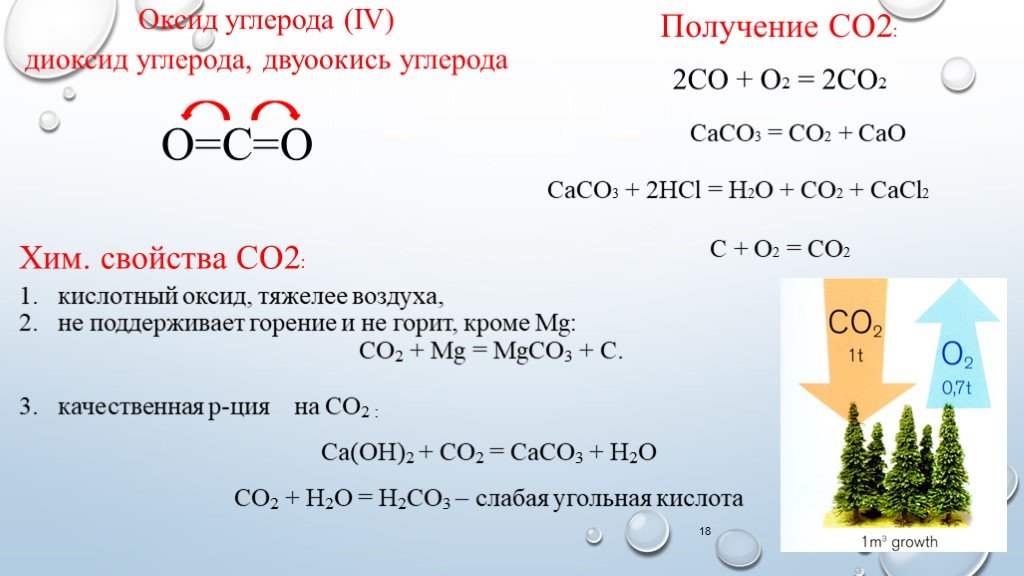
Слайд 18Оксид углерода (IV) диоксид углерода, двуоокись углерода
О=С=О 2СО + О2 = 2СО2 СаСО3 = СО2 + СаО
СаСО3 + 2HCl = H2О + СО2 + СаCl2
Получение CO2: С + О2 = СО2 Хим. свойства CO2:
кислотный оксид, тяжелее воздуха, не поддерживает горение и не горит, кроме Mg: CO2 + Mg = MgCO3 + C. качественная р-ция на CO2 : Ca(OH)2 + CO2 = CaCO3 + H2O CO2 + H2O = H2CO3 – слабая угольная кислота
Слайд 19Осуществить цепочку превращений:
С→СО→ СО2 → Na2CO3→ NaHCO3 → CO2
C→ CH4→ CO2→ H2CO3→ Na2CO3→ NaNO3
Допишите уравнения реакций, которые осуществимы. Реакции ионного обмена запишите в сокращенной ионной форме.
K2CO3 + HCl→ K2SiO3 + HNO3→ C + O2→ KOH + CO2→ H2O + CO2→ CaCO3 + H2SiO3→
В трех пробирках находятся вещества. Приведите уравнения реакций, с помощью которых можно распознать эти вещества.
Серная кислота, силикат калия, карбонат натрия.
Слайд 20Какой объем (н.у.) оксида углерода (IV) можно получить при разложении 400г карбоната кальция, содержащего 6% примесей?

Слайд 211. Тип кристаллической решетки графита: а) молекулярная; б) ионная; в) атомная; г) металлическая. 2. Применение кокса в металлургии основано на его свойстве: а) восстанавливает металлы; б) твердое вещество; в) окисляет металлы; г) способность к адсорбции. 3. Число электронов на внешнем электронном слое атомов неметаллов равно: а) номеру периода; б) порядковому номеру; в) номеру группы; г) заряду ядра.
Тест:
4. Атом углерода проявляет низшую положительную степень окисления в соединении, формула которого: а) СО; б) СO2; в) K2СO3; г) СS2. 5. Уголь является окислителем в реакции с: а) кислородом; б) железо(II) оксидом; в) магнием; г) все перечисленные. 6. Оксиды углерода(II) и (IV) сходны между собой: а) качественным составом; б) количественным составом; в) оба проявляют восстановительные свойства; г) оба являются кислотными оксидами. 7. При нагревании разлагается вещество, формула которого: а) Na2CO3; б) CaCO3; в) K2CO3; г) Na2SiO3. 8.В схеме превращений C → CO2→ A → CO2 буквой «А» зашифровано вещество, формула которого: а) CO; б) Na2CO3; в) CaCO3; г) все перечисленные