Презентация "Производство серы и серной кислоты" – проект, доклад
Презентацию на тему "Производство серы и серной кислоты" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Разные. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 35 слайд(ов).
Слайды презентации
Список похожих презентаций
Производство соляной кислоты
Применение соляной кислоты:. 1) получение неорганических солей, в том числе хлоридов цинка и алюминия, используемых в качестве катализаторов; 2) регенерация ...Производство шоколадных конфет
Цель проекта: обоснование финансово-экономической эффективности и технически возможной реализации производства шоколадных конфет на территории Армении. ...Производство сталей.
Мартеновский способ. Марте́новская печь (марте́н) — печь для переработки передельного чугуна и лома в сталь нужного химического состава и качества. ...Производство растительного масла
Сырьем для маслобойного производства служат семена различных масличных растений. конопля лен рапс хлопчатник подсолнечник. Извлечение масла из семян. ...Производство обуви
. . У первого лаптя правые концы перегибаем на внешнюю, а левые - на внутреннюю сторону подошвы , у второго - наоборот. Поршни. Башмаки от поршней ...Производство печенья.
Печенье — небольшое кондитерское изделие, выпеченное из теста. К тесту для печенья иногда добавляют различные зёрна; печенье обычно формуют в виде ...Производство джинс
Деним бывает трех видов. «Jean» – если Вы видите на этикетке такую надпись, значит перед Вами джинсы, изготовленные из недорогой хлопчатобумажной ...Производство дизельного топлива.
Что такое дизельное топливо? Дизельное топливо – это продукт, используемый в качестве топлива в дизельном двигателе. Это топливо получается при перегонке ...Производство в суде первой инстанции и его особенности
ст. 118 Конституции РФ, определяет, что правосудие в Российской Федерации осуществляется только судом. Сущность судебного разбирательства состоит ...Производство витаминов методами биотехнологии
Витамины (от лат. vita – жизнь + амины) – низкомолекулярные органические соединения различной химической природы, абсолютно необходимые для нормальной ...Производство бумаги
Смешение в соответствующей пропорции древесной массы и целлюлозы получают бумажную массу, из которой вырабатывают бумагу. Чтобы получить бумагу с ...Производство алюминия
Процесс. Процесс получения алюминия весьма сложен и основан на использовании электричества огромной мощности. Поэтому алюминиевые заводы всегда строятся ...Производство азотных удобрений.
В самом начале 20 века был предложен так называемый цианамидный способ получения азотных удобрений: вначале из смеси угля и извести путем накаливания ...Белки, жиры, углеводы и нуклеиновые кислоты
ВСТУПЛЕНИЕ. Нормальная деятельность организма возможна при непрерывном поступлении пищи. Входящие в состав пищи жиры, белки, углеводы, минеральные ...Белки и нуклеиновые кислоты
Из всех органических веществ белки составляют 50-70 % массы клетки. Белки – это сложные органические вещества. Функции белков. Строительная –участвуют ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:6 марта 2019
Категория:Разные
Содержит:35 слайд(ов)
Поделись с друзьями:
Скачать презентацию















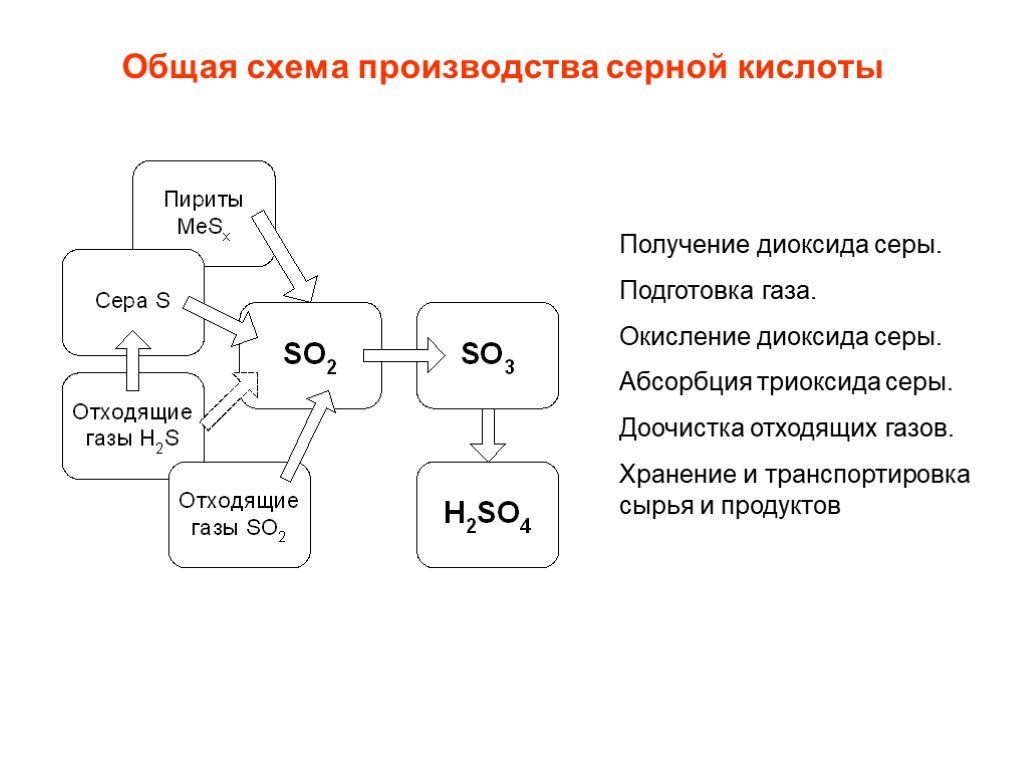
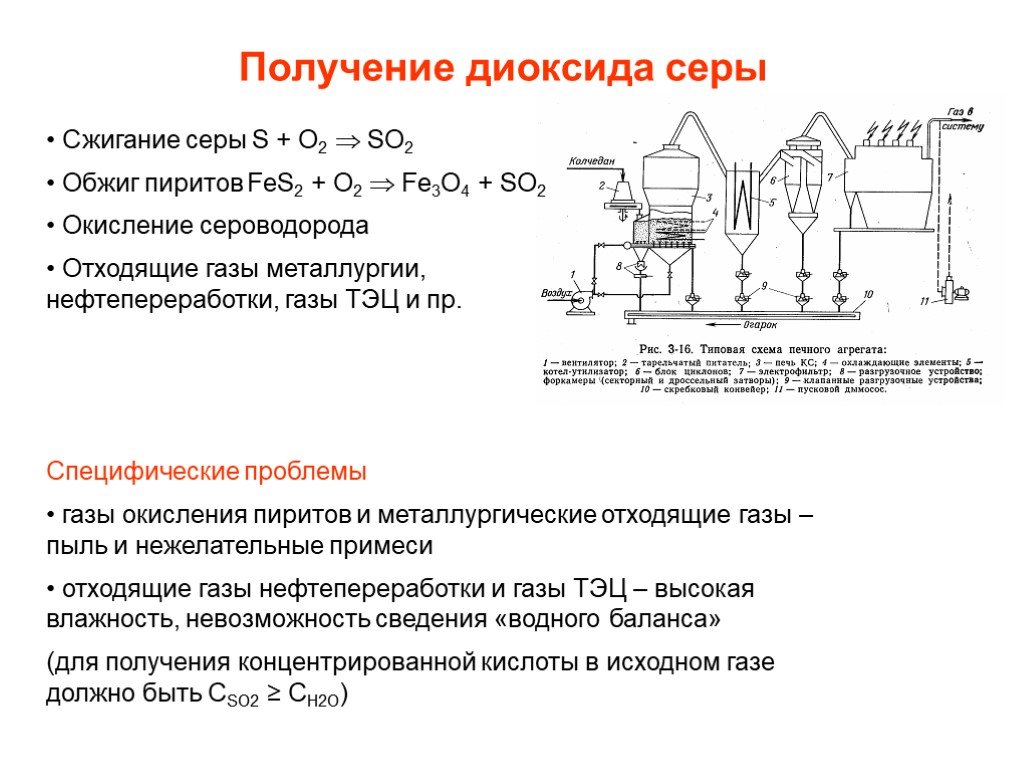


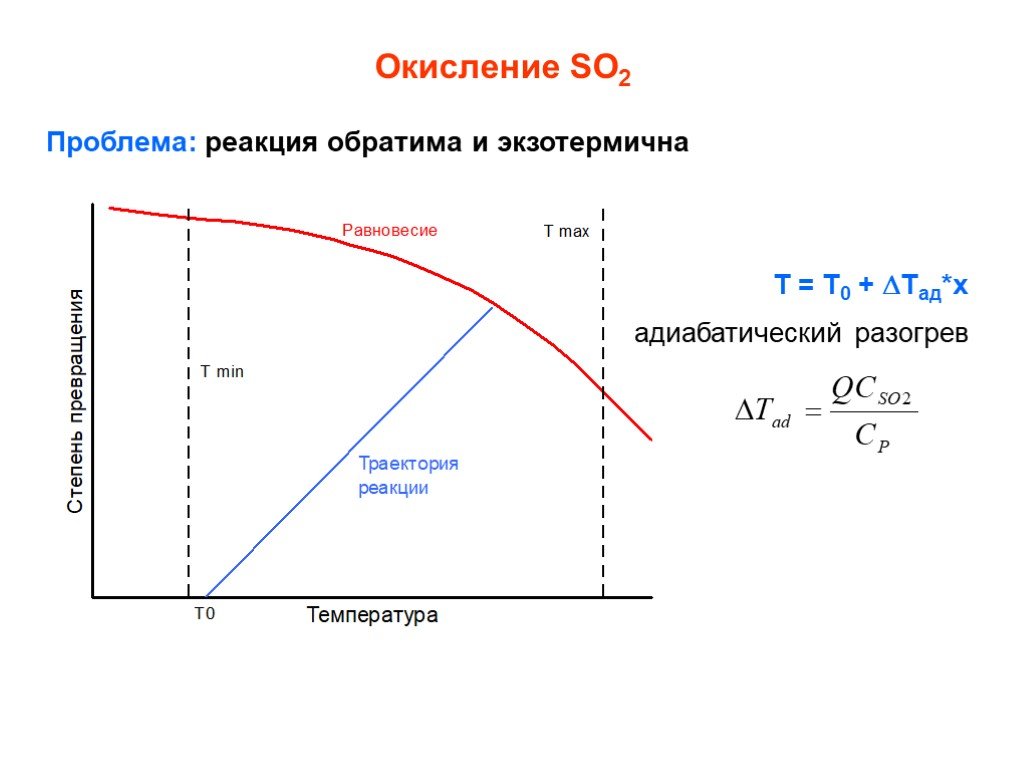

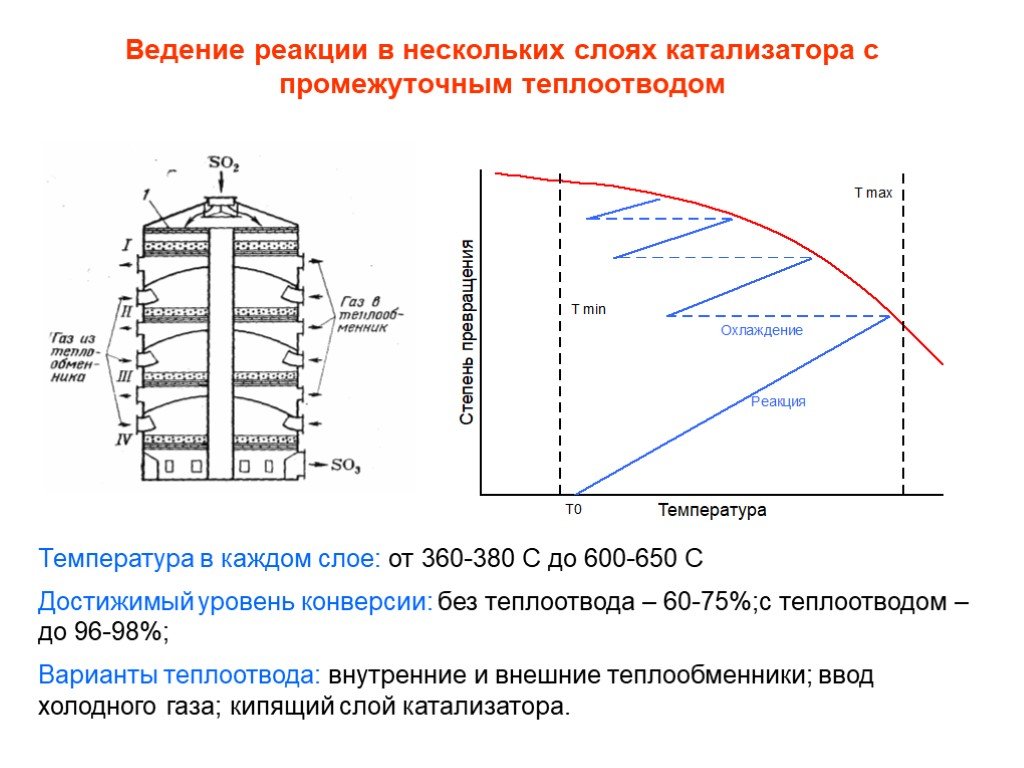
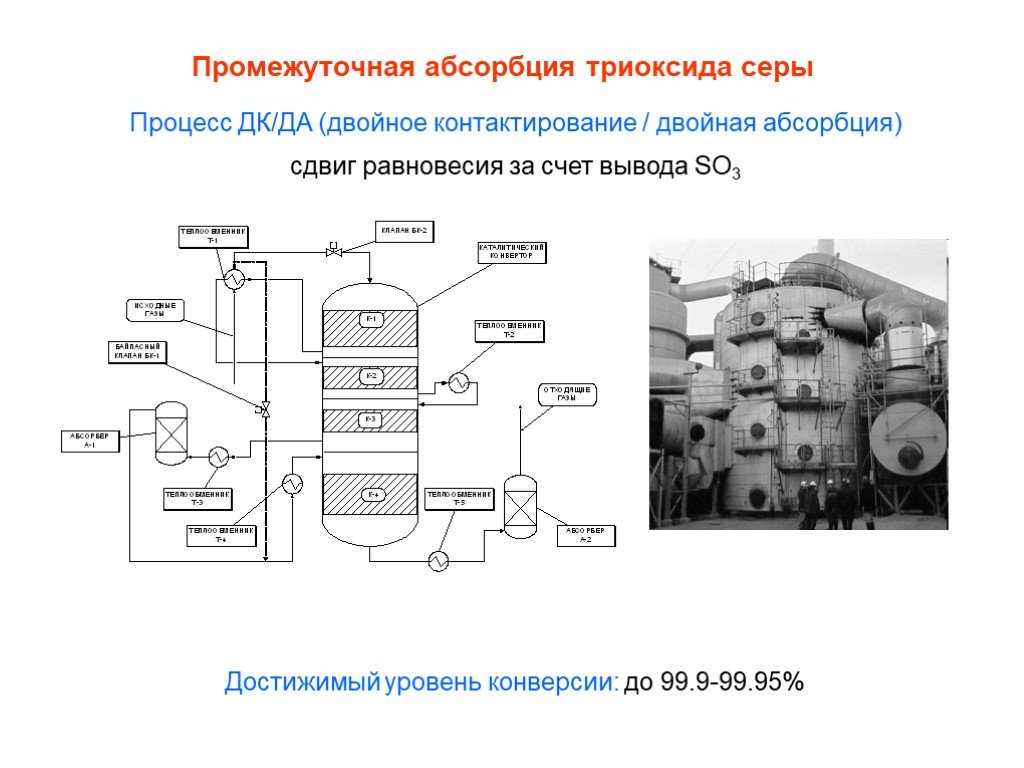
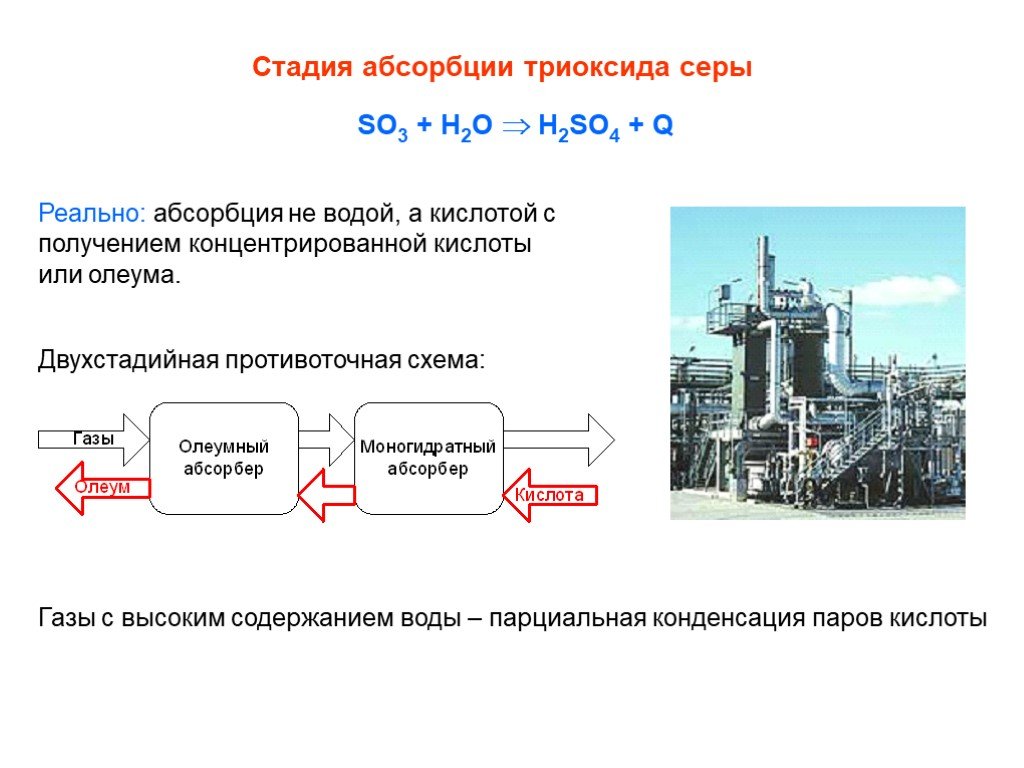


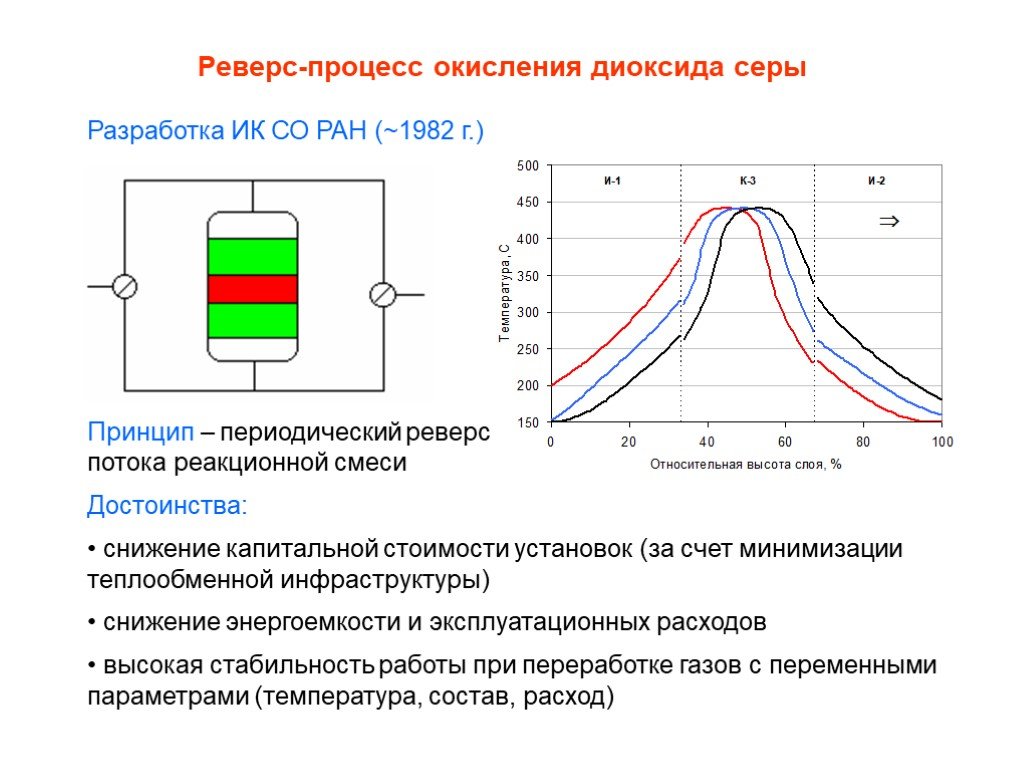























![Окисление SO2. SO2 + ½ O2 SO3 + 99 кДж/моль Катализаторы (V2O5 + K2S2O7)/SiO2 Активный компонент – расплав V2O5 + K2S2O7 Механизм [A] + SO2 [B] + SO3 [B] + SO2 [C] [C] + O2 [A]+ SO3 [C] V24+ + SO3 где [A], [B], [C] – комплексы пятивалентного ванадия ([A] соответствует V25+O22-, [B] - V25+O Окисление SO2. SO2 + ½ O2 SO3 + 99 кДж/моль Катализаторы (V2O5 + K2S2O7)/SiO2 Активный компонент – расплав V2O5 + K2S2O7 Механизм [A] + SO2 [B] + SO3 [B] + SO2 [C] [C] + O2 [A]+ SO3 [C] V24+ + SO3 где [A], [B], [C] – комплексы пятивалентного ванадия ([A] соответствует V25+O22-, [B] - V25+O](https://prezentacii.org/upload/cloud/19/03/131514/images/thumbs/screen25.jpg)