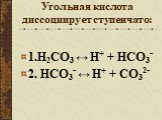Презентация "Карбонаты" по химии – проект, доклад
Презентацию на тему "Карбонаты" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 22 слайд(ов).
Слайды презентации
Список похожих презентаций
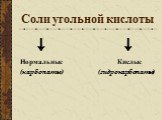
Карбонаты и силикаты
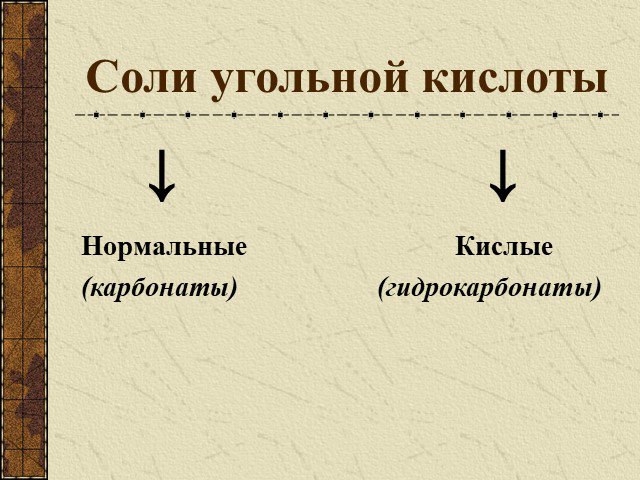
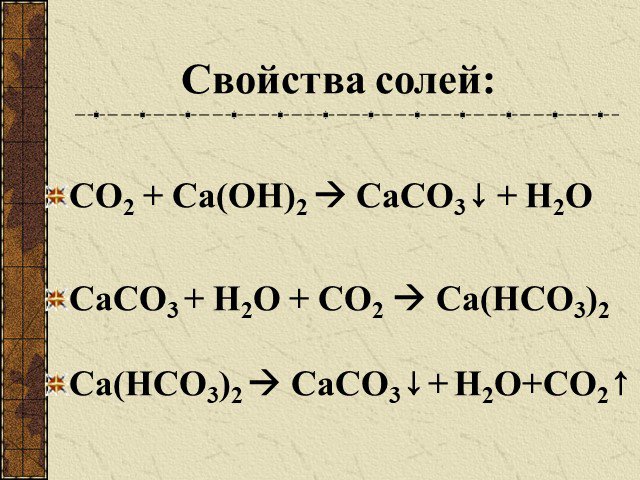
Угольная кислота. Существует в растворах; Является слабым электролитом; Неустойчива, легко разлагается. СО2 + Н2О → Н2О. Кремниевая кислота H2SiO3 ...Карбонаты и гидрокарбонаты
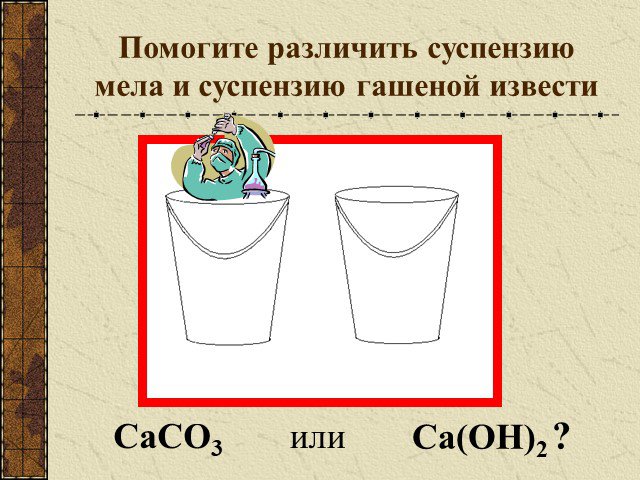
Кап… Кап… Капельки воды… Какое отношение они имеют к нашей теме про карбонаты и гидрокарбонаты? Идет дождь, вода просачивается в землю. Там карбонаты: ...Конспекты
Оксиды углерода (II) и (IV). Карбонаты
Открытый урок по химии в 9 классе по теме:. . . «Оксиды углерода (. II. ) и (. IV. ). Карбонаты». Учитель МКОУ СОШ с.п. Кара-Суу Жабоева Раиса ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 января 2015
Категория:Химия
Содержит:22 слайд(ов)
Поделись с друзьями:
Скачать презентацию