Презентация "Гибридизация атомных орбиталей" по физике – проект, доклад
Презентацию на тему "Гибридизация атомных орбиталей" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 27 слайд(ов).
Слайды презентации
Список похожих презентаций
Характеристики атомных ядер
Атомное ядро состоит из Z протонов и N нейтронов, которые вместе составляют массовое число A=Z+N. Соотношение Z/N ≈ 1 для легких и средних ядер ( ...Радиоактивные превращения атомных ядер
РАДИОАКТИВНЫЕ ПРЕВРАЩЕНИЯ. Э. Резерфорд вместе с с английским радиохимиком Ф. Содди доказал, что радиоактивность сопровождается самопроизвольным превращением одного ...Энергия связи атомных ядер
Энергия связи атомных ядер – та энергия, которая необходима для полного расщепления ядра на отдельные частицы. Закон сохранения энергии энергия связи ...Радиоактивные превращения атомных ядер
Фредерик Содди 1877 - 1956. Эрнест Резерфорд 1871–1937. В 1903 г. обнаружили, что радий превращается в радон в результате альфа-распада. Изменяются ...Радиоактивные превращения атомных ядер
О, сколько нам открытий чудных Готовит просвещенья дух, И опыт, сын ошибок трудных, И гений, парадоксов друг, И случай, бог изобретатель. А. С. Пушкин. ...Гибридизация Атома Углерода
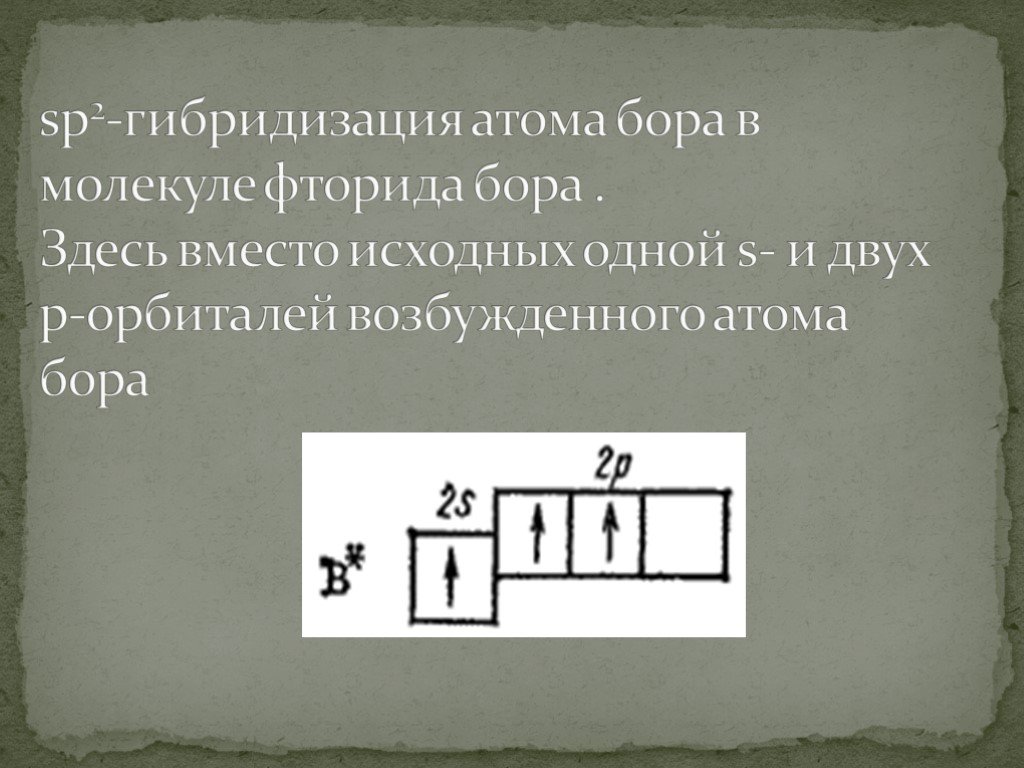
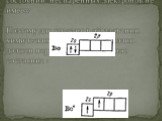
Строение электронной оболочки атома углерода. * hu. Валентные электроны. Сафарова М.А., Саратов, 2013 г. Гибридизация атома углерода. В зависимости ...Тепловые двигатели физика
СОДЕРЖАНИЕ. Содержание Тепловой двигатель Тепловые машины и развитие техники Кто создал тепловые двигатели Виды тепловых двигателей Принцип работы ...«Механические волны» физика
Цель исследования: установить с научной точки зрения, что такое звук. Задачи исследования: 1. Изучить физическую теорию звука. 2. Исследовать историю ...Рентгеновские лучи физика
Презентацию подготовила: Григорьвева Наталья. Руководитель: Баева Валентина Михайловна. Цель работы: узнать о жизни и изобретении великого ученого ...Сила трения физика
Определение. Сила трения - это сила, возникающая в плоскости касания тел при их относительном перемещении. Направление. Сила трения направлена противоположно ...Оптика и атомная физика
В основу настоящего конспекта лекций положен курс лекций по оптике, разработанный профессором кафедры оптики Н.К. Сидоровым и заведующим кафедры оптики ...Простая и интересная физика у Вас дома
Содержание. Эксперименты на тепловые явления. Эксперимент на плотность. Научные забавы и прочие опыты. Как будут отпадать гвозди??? Вы ответили неверно!!! ...Атомная физика
Факты, свидетельствующие о сложном строении атома. Периодическая система Д.И. Менделеева Электролиз Открытие электрона Катодные лучи Радиоактивность. ...Музыка и физика
Урок подготовили:. Учащиеся 9Б класса и Алевтина Антоновна Петриченко – учитель физики первой категории МОУ «СОШ № 30» г.Чебоксары. Надежда Николаевна ...«Сообщающиеся сосуды» физика
Цель: изучить особенности сообщающихся сосудов и сформулировать основной закон сообщающихся сосудов. Опыт с двумя трубками. Опыт с сосудами разной ...«Электромагнит» физика
2. Как располагаются железные опилки в магнитном поле прямого тока? 3. Что называют магнитной линией магнитного поля? 4. Для чего вводят понятие магнитной ...«Световые волны» физика
Оглавление:. Принцип Гюйгенса Закон отражения света Закон преломления света Полное отражение Линза Расчёт увеличения линзы Дисперсия света Интерференция ...«Оптические приборы» физика
Содержание. 1.Телескоп 2.Строение телескопа 3.Разновидности телескопов 4.Рефлекторы 5.Использование телескопов 6.Микроскоп 7.Создание микроскопа 8.Использование ...«МКТ» физика
Содержание. Молекулярная физика Основы молекулярно-кинетической теории строения вещества (МКТ) Температура и внутренняя энергия тела Характеристика ...Молекулярная физика и термодинамика
Литература: 1. Кудрявцев Б.Б., Курс физики: Теплота и молекулярная физика. – М.: Учпедгиз, 1960. 210 с. 2. Савельев И.В. Курс общей физики Т. 1, Механика, ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:8 ноября 2018
Категория:Физика
Содержит:27 слайд(ов)
Поделись с друзьями:
Скачать презентацию