Презентация "Основные положения молекулярно-кинетической теории" по физике – проект, доклад
Презентацию на тему "Основные положения молекулярно-кинетической теории" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 20 слайд(ов).
Слайды презентации
Список похожих презентаций
Основные положения молекулярно-кинетической теории
МКТ молекулярно-кинетическая теория. объясняет физические явления и свойства тел с точки зрения их внутреннего микроскопического строения. На уроках ...Основные положения молекулярно-кинетической теории
Цели урока:. Образовательные: сформулировать основные положения МКТ; раскрыть научное и мировоззренческое значение броуновского движения; установить ...Основные положения молекулярно-кинетической теории (МКТ). Абсолютная температура.
Молекулярная физика. Раздел, в котором изучают свойства макроскопических тел в различных агрегатных состояниях на основе МКТ. Демокрит (около 460 ...Основные положения, идеальный газ
Два подхода к изучению свойств вещества. Молекула (М)– мельчайшая, самостоятельно существующая частичка вещества, сохраняющая его химические свойства. ...Основные положения МКТ
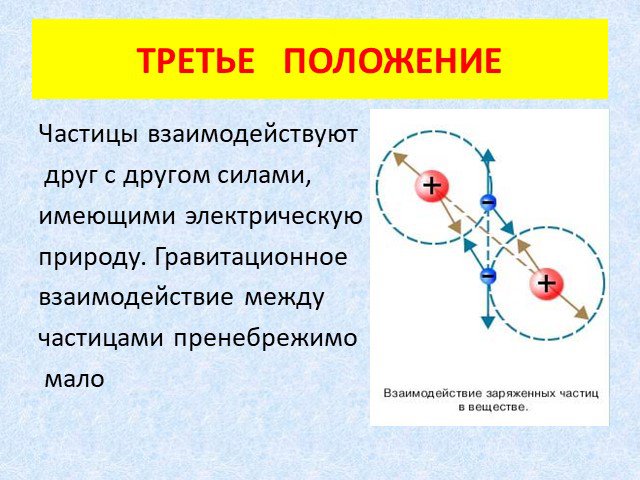
1.Все вещества состоят из мельчайших частиц(молекул, атомов ,элементарных частиц) 2. Частицы движутся 3. Частицы взаимодействуют. Вещество состоит ...Основные положения МКТ
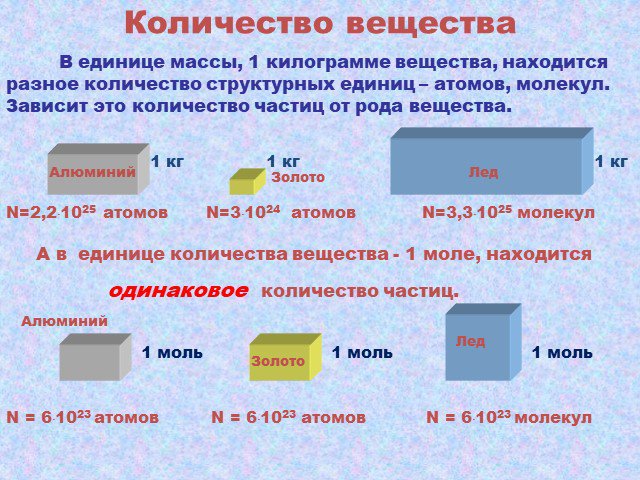
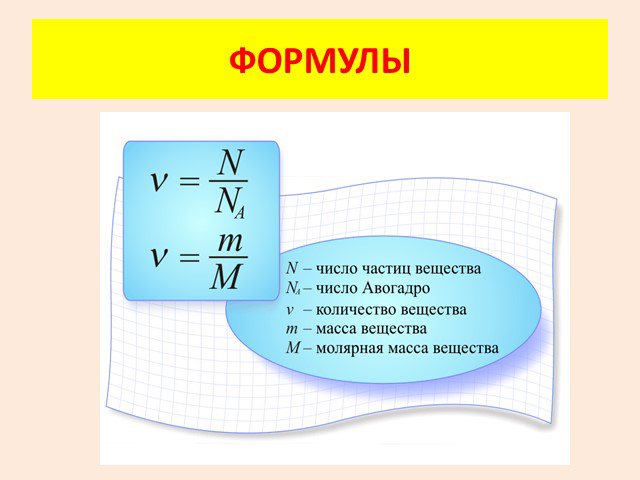
Молекулярно-кинетическая теория. учение о строении и свойствах вещества на основе представления о существовании атомов и молекул как наименьших частиц ...Основные положения МКТ
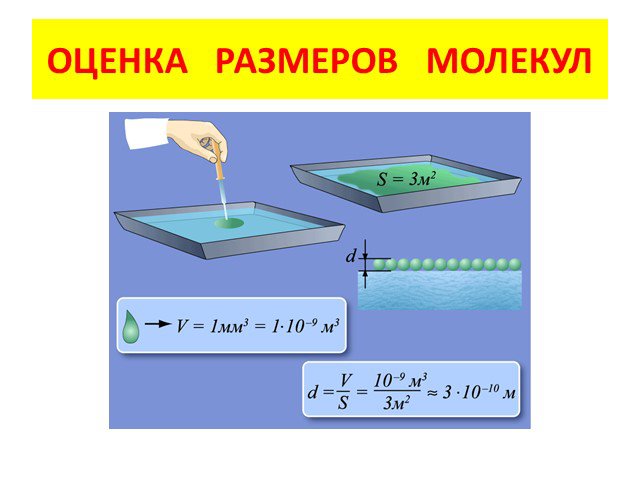
Доказательство существования молекул: 1.Броуновское движение. . Доказательство существования молекул: 2. электронный микроскоп. Размеры молекул. Доказательство ...Основные положения МКТ
Молекулярно- кинетическая теория объясняет свойства макроскопических тел и тепловые процессы, протекающие в них, на основе представлений о том, что ...Светотехника. Основные понятия
ПРЕДМЕТ ИЗУЧЕНИЯ СВЕТОТЕХНИКИ. Предметом изучения светотехники являются: - Оптическое излучение и его характеристики; - Источники оптического излучения; ...Основные газовые законы
Цели урока:. изучить газовые законы; научиться объяснять законы с молекулярной точки зрения; изображать графики процессов; продолжить обучение решать ...Основные характеристики звёзд
Расстояния до звезд. Для сравнительно близких звезд расстояние определяется методом параллакса. Он известен более 2 тыс. лет, а к звездам его стали ...Основные свойства воздуха
Воздух прозрачный и бесцветный. Голубое небо – толстый слой воздуха, освещённый солнцем. Атмосфера Земли – вид из космоса. Прозрачный воздух пропускает ...Основные понятия ядерной физики
Символическая запись ядра:. «X» – символ химического элемента «Z» - величина заряда (определяется количеством протонов в ядре (зарядовое число) ) ...Основные понятия кинематики
Тот предмет, который считается неподвижным и относительно которого рассматривается движение других тел ,называют телом отсчета. Механическим движением ...Описание дефектов кристаллической структуры в рамках теории упругости
В настоящем разделе рассматриваются задачи, в которых концентрацию дефектов считается малой, то есть можно предполагать, что дефекты образуют в матрице ...Основные направления эконофизики. Фрактальный анализ финансовых рядов
Эконофизика. Этапы развития. 1995 1997 2001 2002 2009 Настоящее время. Появление термина для обозначения работ специалистов по статфизике в области ...Основные законы электротехники
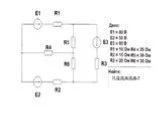
65 I11 – 25 I22 – 30I33 = 80 – 25 I22 – 75 I22 – 35I33 = – 50 – 30 I33 – 35 I11 – 85I22 = 60. Решить систему трех уравнений с тремя неизвестными с ...Основные единицы СИ
Система Интернациональная. СИ (SI, фр. Le Système International d'Unités), (Система Интернациональная) — международная система единиц, современный ...Элементы специальной теории относительности
Согласно классическим представлениям о пространстве и времени, считавшимся на протяжении веков незыблемыми, движение не оказывает никакого влияния ...Элементы теории относительности
Цели урока. Ознакомить учащихся с теорией относительности и её основоположником А. Энштейном. Развивать научное мировоззрение о пространстве и времени. ...Конспекты
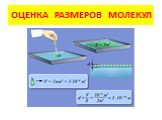
Основные положения молекулярно-кинетической теории и ее опытное подтверждение.Масса и размеры молекул
Бегимбаева Жумагуль Купжасаровна. Учитель физики сш №5. Актюбинская область. . Города Шалкар. Тема урока:. "Основные положения ...Основные положения молекулярно-кинетической теории
Обобщающий урок по теме «Основные положения молекулярно-кинетической теории». Цель урока. : обобщение знаний по основным положениям МКТ. Задачи ...Основные положения молекулярно – кинетической теории
Тема: Основные положения молекулярно – кинетической теории. Цель урока. : 1.Учащиеся смогут описывать тепловые явления с помощью статического метода, ...Экспериментальные доказательства молекулярно – кинетической теории
Урок физики в 10 классе. «Экспериментальные доказательства молекулярно – кинетической теории». Подготовила:. Врясова ...Принцип относительности в механике. Постулаты теории относительности
Цуканова Наталья Рефатовна. Преподаватель физики, вторая категория. КГУ «Машиностроительный колледж города Петропавловска». Казахстан ,СКО,г.Петропавловск. ...Основы молекулярно – кинетической теории
Цикл уроков физики в 10 классе. Тема: Основы молекулярно – кинетической теории (5 часов). В процессе работы над модулем вы должны изучить. :. ...Основные сведения о строении атома
Конспект урока с применением ЛСМ (логико-смысловой модели). Тема «Основные сведения о строении атома». . 11 класс (базовый уровень). Цель: ...Задачи и вопросы по теории относительности
Задачи и вопросы по теории относительности. В небольшой, но содержательной теме по элементам специальной теории относительности у учителя нет возможностей ...Большой взрыв. Основные этапы эволюции Вселенной
. Предмет физика. 11 кл. Тема:. Большой взрыв. Основные этапы эволюции Вселенной. . . Цель:. Обучающая :. познакомить учащихся. с понятием ...Атмосферное давление. Основные пояса атмосферного давления на Земле
Разработка урока для 6 класса. . Учитель Загария Ирина Владимировна. СОШ № 34 г. Енакиево Донецкая область Украина. Тема:. Атмосферное давление. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 января 2015
Категория:Физика
Содержит:20 слайд(ов)
Поделись с друзьями:
Скачать презентацию