Презентация "Изменение агрегатного состояния вещества" по физике – проект, доклад
Презентацию на тему "Изменение агрегатного состояния вещества" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 17 слайд(ов).
Слайды презентации
Список похожих презентаций
Три состояния вещества
Состояние вещества. В природе вещества встречаются в трех состояниях:. В твердом Жидком Газообразном. Твердое тело имеет собственную форму и объём. ...«Агрегатные состояния вещества»
ЦЕЛЬ: изучить физические особенности в строении и свойствах различных веществ. ДЕМОНСТРАЦИИ: модели кристаллических решеток, наблюдение за процессами ...Изменение агрегатных состояний вещества. Испарение
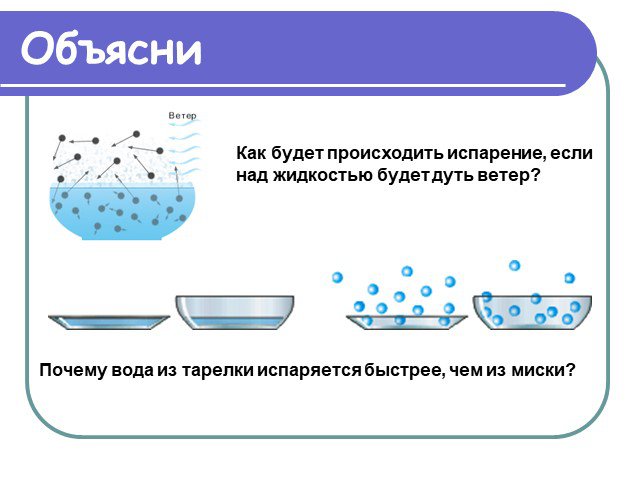
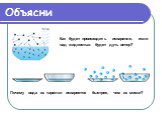
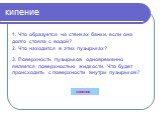
Содержание. Испарение Кипение Парообразование Задача Формулы Домашнее задание. Испарение. Явление превращения жидкости в пар называется парообразованием. ...Три состояния вещества. Различие в молекулярном строении твердых тел, жидкостей и газов
В природе вещества встречаются в трех состояниях:. в твердом в жидком в газообразном. Твердое тело имеет собственную форму и объем. Жидкости легко ...Изменение агрегатных состояний вещества
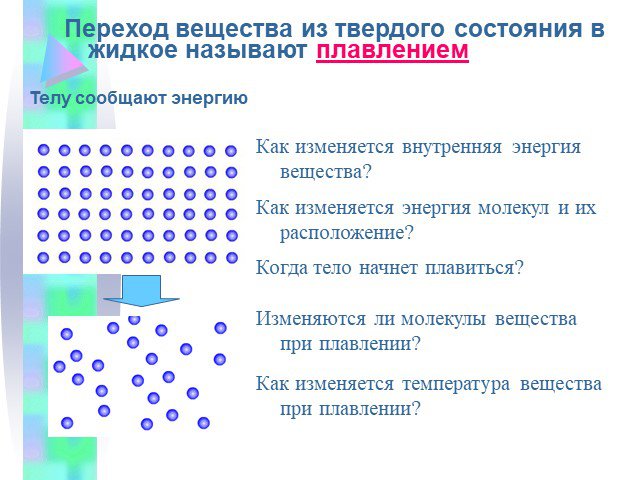
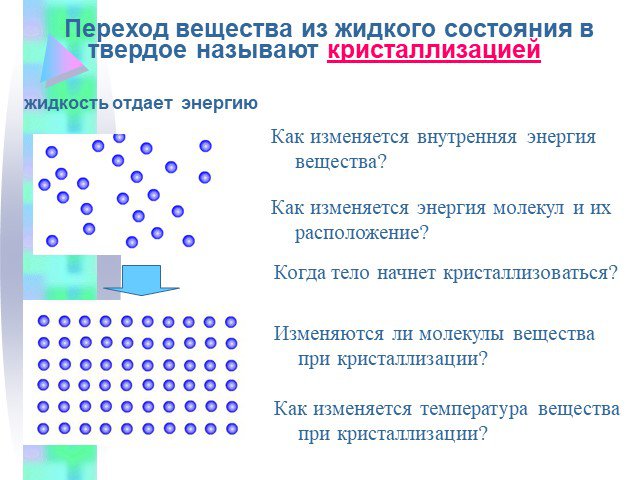
Часть 1 Урок № 1. Три состояния вещества Плавление и кристаллизация Температура плавления. Три состояния вещества. Газообразное Жидкое Твердое. Газ. ...Изменение агрегатных состояний вещества
Оглавление. 1. Агрегатные превращения вещества. Слайд 3. 2. Фронтальный опрос. Слайд 4. 3. Что происходит в природе. Слайд 5. 4. Испарение и кипение. ...Агрегатные состояния вещества. Плавление и отвердевание кристаллических тел
Цель урока: Изучить физические особенности в строении и свойствах различных веществ. Научиться понимать суть тепловых явлений. Изучить особенности ...Агрегатные состояния вещества. 7-й класс
В природе вещества встречаются в 3-х состояниях:. Твёрдом; Жидком; Газообразном; Примеры; Вопросы; Вывод; Тест; Домашнее задание. Твёрдое состояние. ...Агрегатные состояния вещества. Плавление и кристаллизация
Большинство веществ в зависимости от внешних условий (давления и температуры) могут быть либо твердыми, либо жидкими, либо газообразными. Любое вещество ...Агрегатные состояния вещества
Всем известно что вещества существуют в трех состояниях. Каких? Три состояния вещества. Твердое Жидкое Газообразное. Твердое состояние вещества. Упругость ...Агрегатные состояния вещества.
Количество теплоты. Количество теплоты-это энергия, которую получает или теряет тело при теплопередаче. Количество теплоты обозначают буквой Q и измеряется ...Агрегатные состояния вещества
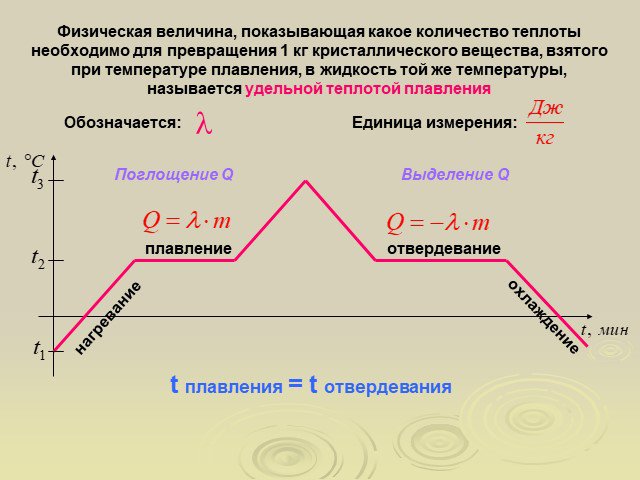
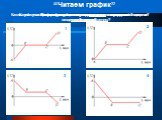
Какой металл, находясь в расплавленном состоянии, может заморозить воду? Свинец Олово Ртуть. На рисунке представлен график охлаждения и кристаллизации ...Агрегатные состояния вещества
Повторим:. В каких состояниях может находится вещество? Приведите свои примеры. Перечислите свойства твёрдых тел. Назовите свойства жидкостей. Какими ...Агрегатные состояния вещества
Вода бывает разной:. жидкой и газообразной. . Плавление металлов. Холодильная установка. Паровая турбина. Процессы перехода. десублимация парообразование ...Агрегатные состояния вещества. Строение твердых, жидких и газообразных тел
Тип урока: сообщение новых знаний. Цели урока: дать понятие агрегатного состояния вещества; объяснить свойства твердых тел, жидкостей и газов; ознакомить ...Изменение агрегатных состояний вещества
Объяснить некоторые механические свойства твердых тел, жидкостей и газов. Показать наличие взаимодействия между молекулами твердых тел и жидкостей. ...3 состояния вещества
в твердом жидком газообразном. Любое вещество в зависимости от внешних условий может находиться в одном из трех агрегатных состояний:. Свойства твердых ...Агрегатные состояния вещества
Цель урока. Повторить понятия, изучаемые в данной теме. Продолжить формировать умения применять знания, полученные ранее при решении качественных ...Три состояния вещества
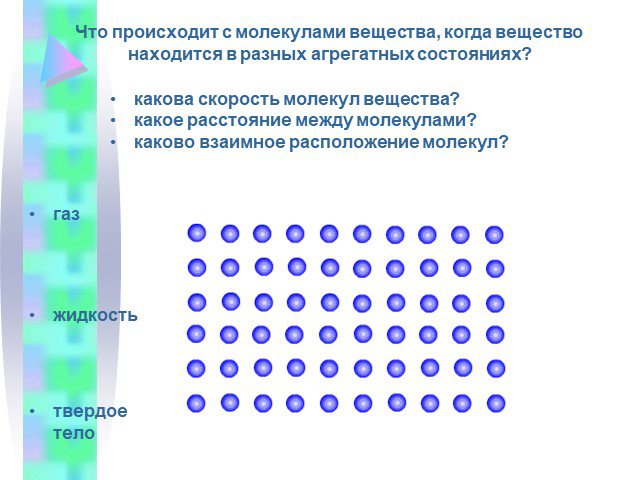
Что происходит с молекулами вещества, когда вещество находится в разных агрегатных состояниях? Твердое тело. Жидкость. Газ. Вопросы: Можно ли открытый ...Строение вещества
Из чего состоит вещество? ? Твердые тела:. -при нагревание расширяются -при охлаждении сжимаются. Газы. При нагревание расширяются При охлаждении ...Конспекты
Агрегатные состояния вещества. Плавление и отвердевание кристаллических тел
Конспект урока на тему "Агрегатные состояния вещества. Плавление и отвердевание кристаллических тел". . Цели урока:. . . дать понятие агрегатного ...Агрегатные состояния вещества
Bulanova Vera school. 2087. . Урок в 10 классе. Выполнил:. учитель физики. Буланова В.А. Методическая разработка урока ...Агрегатные состояния вещества
ПЛАН-КОНСПЕКТ УРОКА. . Агрегатные состояния вещества. ФИО. . Шаронова Селена Михайловна. . . . Место работы. . МБОУ ...Агрегатные состояния вещества
Открытый урок по физике в 7 классе. Агрегатные состояния вещества. . Подготовила:. учитель физики и математики. II. категории. КУ ...Агрегатные состояния вещества
МБОУ «Гимназия №4» г.о. Дзержинский. Открытый урок. . Урок по теме: «Агрегатные состояния вещества». 7 класс. ...Агрегатные состояния вещества
. МЕТОДИЧЕСКАЯ РАЗРАБОТКА УРОКА ПО ФИЗИКЕ. . Тема: Агрегатные состояния вещества. Автор: Митина Марина Анатольевна,. ...Агрегатные состояния вещества
. Муниципальное бюджетное общеобразовательное учреждение. . «Средняя общеобразовательная Шаталовская школа». Старооскольского района Белгородской ...Агрегатные состояния вещества
Сертакова Галина Александровна учитель физики. Государственное бюджетное специальное (коррекционное) образовательное учреждение. . для обучающихся ...Агрегатные состояния вещества. Плавление и отвердевание кристаллических тел. График плавления
Тема урока:. Агрегатные состояния вещества. Плавление и отвердевание кристаллических тел. График плавления. . Тип урока:. изучение нового ...Особенности внутреннего строения вещества в трех агрегатных состояниях
Сценарий урока «Особенности внутреннего строения вещества в трех агрегатных состояниях». Автор: Попова Людмила Ивановна, преподаватель физики. Полное ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:15 января 2015
Категория:Физика
Содержит:17 слайд(ов)
Поделись с друзьями:
Скачать презентацию