Слайд 1Актуальные вопросы регулирования обращения биологических препаратов
Ростова Наталья Борисовна Доцент, канд.фарм. наук Апрель, Москва, 2010 г.
Конгресс «Человек и Лекарство», Москва, апрель, 2010г.
Эритропоэтин человека, связанный с рецептором. По Elliott et al. 2003 Nature Biotechnology 21: 414-421.
Слайд 2Основные проблемы
Перспективы рынка биологических ЛС Биологическое ЛС, биоаналог – определения и отличия Свойства и особенности ЛС биологической природы Особенности регулирования обращения Взаимозаменяемость Выводы
Слайд 3Биофармацевтический рынок является привлекательным для фармацевтических компаний
Объем мировых продаж биофармацевтического рынка за период 2003-2005г. увеличился с 52,6 до 70,8 млрд. долл., т.е. на 34%1 Положительная динамика рынка делает его привлекательным для многих фармацевтических компаний1
М. Ченцова. Анализ мирового биофармацевтического рынка на 2003-2006 гг. Ремедиум, №5, 2007.
Слайд 4Препараты биологической природы
Первые биологические лекарственные средства начали использоваться в клинической медицине в 80-х гг. Более 150 препаратов в мире Более 370 препаратов в процессе разработки для терапии различных серьезных медицинских показаний
Biotechnology Industry Organization website (www.bio.org), 2004.
Слайд 5Биологические препараты
Группа ЛС, близких по строению/ составу к природным веществам, синтезируемым в организме человека/ животных/ микроорганизмов. любые сыворотки, белки, вакцины, вирусы, компоненты крови и препараты, выделенные из крови. В состав биопрепаратов могут входить сахара, белки, нуклеиновые кислоты или сложные комбинации этих веществ Могут представлять собой биологические объекты – например, клетки и ткани. Энциклопедический словарь терминов фармакологии, фармакотерапии и фармации под ред. Г.Я. Шварца
*EMEA directive (Directive 2003/63/EC from 25 June 2003 )
Слайд 6Биологическое лекарственное средство
иммунобиологические лекарственные средства; лекарственные средства, производимые путем биотехнологических процессов: технология рекомбинантной ДНК; контролируемая экспрессия генов, кодирующих выработку биологически активных белков, методы с использованием гибридом и моноклональных антител генотерапевтические и соматотерапевтические лекарственные средства
Классификация EMEA
Слайд 7Потенциал медицинского применения клеточных и генных биологических препаратов лечение многих заболеваний, неизлечимых в настоящий момент.
Инсулины; Соматотропный гормон; Интерфероны; Иммуноглобулины; Эритропоэтины;
Циклоспорины; Факторы свертывания крови; Колониестимулирующий фактор; Вакцины
Примеры:
Слайд 8Определение понятия «биологическое ЛС»
1 Определение EMEA
Слайд 9Чем отличаются биопрепараты от других ЛС?
Высоким молекулярным весом Сложностью пространственной структуры: Четвертичная структура Определенное соотношение изоформ Степень гликозилирования Следующими характеристиками: Длительной и наукоемкой технологией производства Высокой степенью биофармацевтической очистки Высокой чувствительностью к влиянию на стабильность различных факторов: Лекарственная форма Транспортировка Условия хранения Иммуногенностью
*Источник: Crommelin DJA, et al. Int J Pharm 2003;266:3-16.
Слайд 10Учитывая особенности препаратов биологической природы
Сложность (невозможность) воспроизведения каждого из этапов производства Непрогнозируемое изменение клинических последствий применения препарата при самом незначительном изменении процесса производства (при производстве воспроизведенных препаратов)
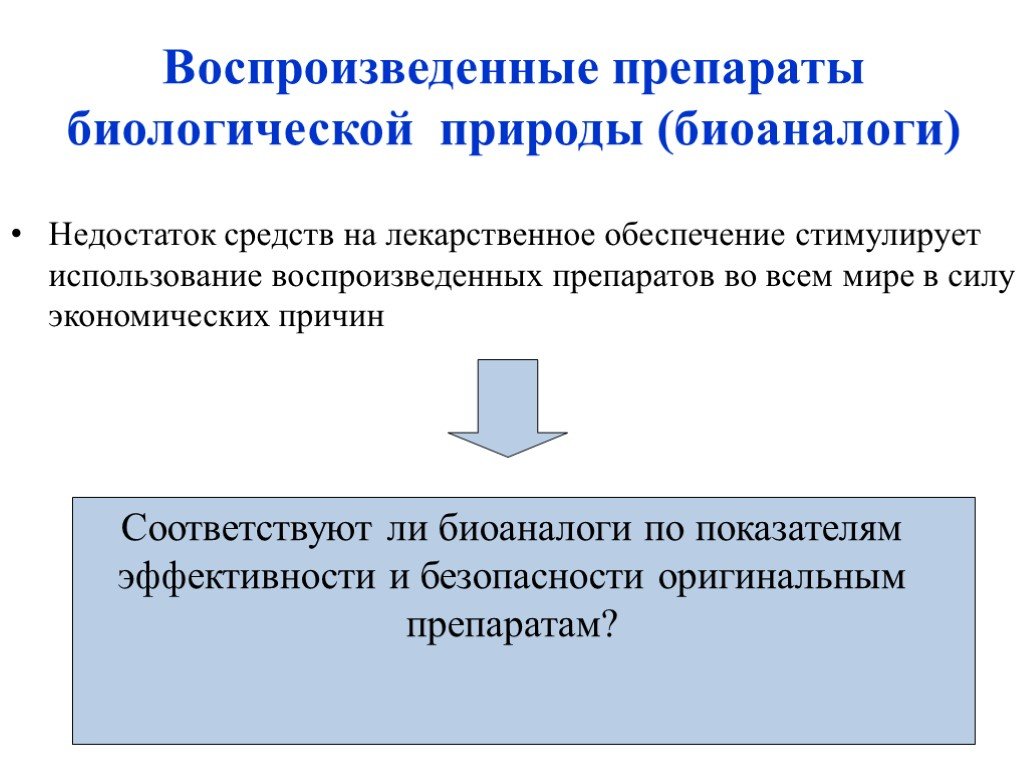
Слайд 11Недостаток средств на лекарственное обеспечение стимулирует использование воспроизведенных препаратов во всем мире в силу экономических причин
Соответствуют ли биоаналоги по показателям эффективности и безопасности оригинальным препаратам?
Воспроизведенные препараты биологической природы (биоаналоги)
Слайд 12Биоаналог = дженерик?
«Биоаналог - это биологическое лекарственное средство, схожее с оригинальным биологическим лекарственным средством, но не являющийся его дженериком в связи с различиями в исходном сырье и производстве оригинального биологического лекарственного средства и биоаналога,…»
Источник: Переведено из Article 10 (2) b of Directive 2001/83 as amended
Почему надо с особенной осторожностью говорить о равнозначности (взаимозаменяемости) биологических лекарственных средств?
Слайд 13Какова законодательная основа регуляции обращения воспроизведенных лекарственных средств в РФ?
Слайд 14Утвержден Приказом Министерства Здравоохранения и социального развития РФ от 30.10.06. №736 АДМИНИСТРАТИВНЫЙ РЕГЛАМЕНТ ФЕДЕРАЛЬНОЙ СЛУЖБЫ ПО НАДЗОРУ В СФЕРЕ ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ ПО ИСПОЛНЕНИЮ ГОСУДАРСТВЕННОЙ ФУНКЦИИ ПО ГОСУДАРСТВЕННОЙ РЕГИСТРАЦИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ
Слайд 15АДМИНИСТРАТИВНЫЙ РЕГЛАМЕНТ от 30.10.06. №736
«…В том случае, если отличия регистрируемого ЛС от ранее зарегистрированного относятся только к составу вспомогательных веществ и технологии производства и такие отличия не могут оказывать влияние на качество, эффективность и безопасность ЛС, должна быть применена процедура ускоренного рассмотрения документов и принятия решения о государственной регистрации…»
Слайд 16Для прохождения ускоренной процедуры рассмотрения документов и принятия решения о государственной регистрации, документы и данные указанные в подпунктах 11-13 пункта 3.3.3. настоящего Регламента могут быть представлены в виде ссылок на открытые литературные источники и в виде отчета об исследованиях биоэквивалентности, проведенных с учетом требований Приложения 1 к таким данным…….»

Слайд 171) заявление о государственной регистрации ЛС; 2) квитанцию об осуществлении платы за государственную регистрацию ЛС; 3) юридический адрес организации - производителя ЛС; 4) названия ЛС, включая МНН, научное название на латинском языке, основные синонимы; 5) оригинальное название ЛС, если оно зарегистрировано как торговый знак в соответствии с законодательством Российской Федерации о торговых знаках, знаках обслуживания и наименованиях мест происхождения товаров; 6) перечень компонентов, входящих в состав ЛС, их количество; 7) инструкцию по применению ЛС, оформленную в соответствии с требованиями статьи 16 Федерального закона от 22.06.98 N 86-ФЗ "О лекарственных средствах"; 8) сертификат качества ЛС; 9) данные о производстве ЛС, первоначальный текст фармакопейной статьи (нормативного документа); 10) методы контроля качества ЛС; 11) результаты доклинических исследований ЛС; 12) результаты фармакологических и токсикологических исследований ЛС; 13) результаты клинических исследований ЛС; 14) образцы ЛС для проведения экспертизы его качества; 15) предложения по цене ЛС; 16) документы, подтверждающие регистрацию ЛС, если оно зарегистрировано вне пределов РФ.
АДМИНИСТРАТИВНЫЙ РЕГЛАМЕНТ (продолжение)

Слайд 18Терапевтическая эквивалентность
Лекарственный препарат терапевтически эквивалентен другому препарату, если он содержит ту же активную субстанцию или лекарственное вещество и, по результатам клинических исследований, обладает такой же эффективностью и безопасностью, как и препарат сравнения, чья эффективность и безопасность установлены {EU}. Терапевтически эквивалентными лекарственные препараты могут считаться только в том случае, если они фармацевтически эквивалентны и можно ожидать, что они будут иметь одинаковый клинический эффект и одинаковый профиль безопасности при использовании пациентами в соответствии с указаниями на этикетке {FDA}.

Слайд 19Подтверждение терапевтической эквивалентности:
доказательство биоэквивалентности; сравнительное определение фармакодинамических характеристик; сравнительные клинические испытания; определение растворимости дозированной формы.
The rules governing medicinal products in the European Union. Investigation of Bioavailability and Bioequivalence. 1998, v. 3C, pp.231-244
Подтверждение биоэквивалентности ещё не свидетельствует о терапевтической эквивалентности сравниваемых препаратов.
Слайд 20Примеры отзывов биоаналогов с рынка
1996 г, рекомбинантный человеческий интерферон альфа (Lemery, Куба). 1997 г, эпоэтин альфа (Cryopharma) 1998 г, интерферон альфа (Fustery) Причина – большое количество побочных реакций, т.к. безопасность препарата не была изучена на момент регистрации
Мексика. HIS Global lnsight Article, 06March 2009, http://www.ibclifesciences.com/upload/wysiwyg/biopharma_series/B9194/BiosimilarsUS_IHSGlobalInsight.pdf
Слайд 21Учитывая вышесказанные аспекты в европейском и американском законодательстве предусмотрены особые требования по регистрации воспроизведенных ЛС биологической природы и их замены при назначении
Слайд 22Регистрация биоаналогов
Регуляторные органы в ЕС (ЕМЕА) и США (FDA) признают, что биоаналоги отличаются от генериковых препаратов, а именно по: размеру и сложности активной субстанции Гетерогенности продукта Безопасности и эффективности, зависящим от исходного материала и процесса производства Невозможности полностью определить структуру молекулы современными аналитическими методами, что может повлиять на эффективность и безопасность Иммунной реакции организма (иммуногенность)
Принципы регистрации генериковых препаратов не могут быть применимы к биоаналогам

Слайд 23Регистрация биоаналогов в ес
Появление Директив, описывающих регистрацию биоаналогов в ЕС: Directive 2003/63/EC of 25 June 2003 (Annex I): deadline for national implementation 1 July 2003 Directive 2004/27/EC of 31 March 2004 (amending Directive 2001/83/EC): deadline for national implementation 30 October 2005 Regulation 726/2004 of 31 March 2004: came into force as of 20 November 2005
Четко прописаны определения, требования и процесс регистрации для биоаналогов
Слайд 24Законодательная основа для биоаналогов
Directive 2004/27/EC – Article 10.4 (Определение): «В случае если биологический препарат аналогичный оригинальному биологическому препарату не подпадает под определение генерического препарата, особенно при наличие отличий в исходных материалах и процессе производства, необходимо предоставить результаты доклинических тестов и клинических испытаний при его регистрации».
Биоаналог Генерик
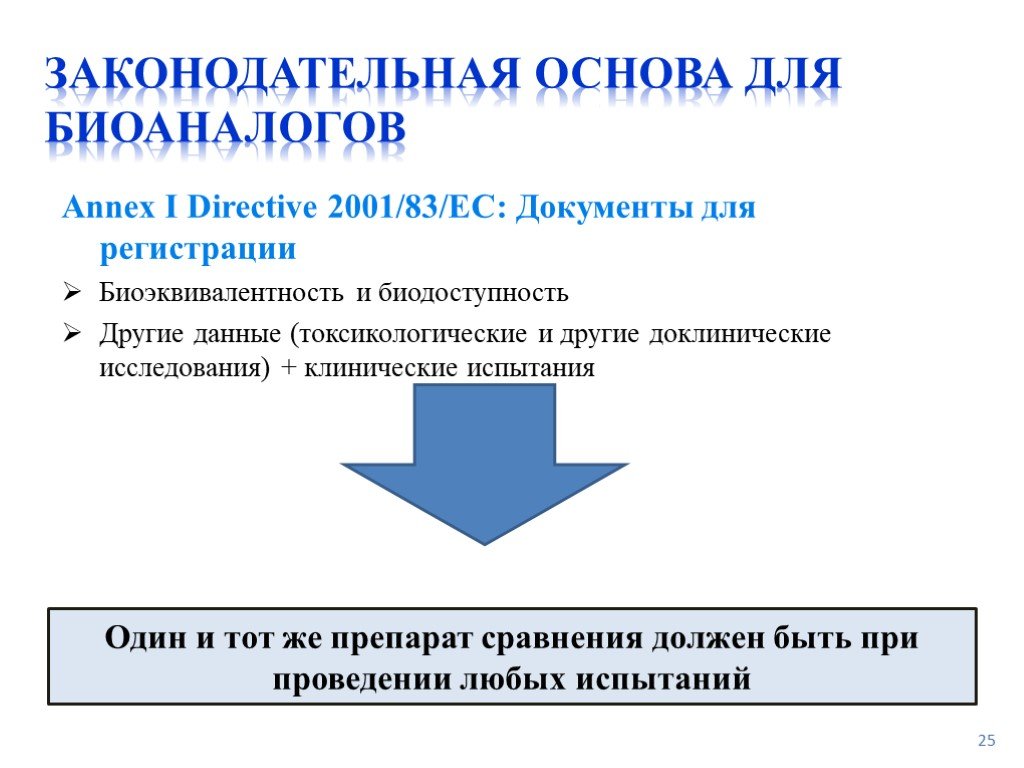
Слайд 25Annex I Directive 2001/83/EC: Документы для регистрации Биоэквивалентность и биодоступность Другие данные (токсикологические и другие доклинические исследования) + клинические испытания
Один и тот же препарат сравнения должен быть при проведении любых испытаний
Слайд 26Основные аспекты новых требований в ес
Процедура центральной регистрации (Centralized procedure) для всех биопрепаратов и их аналогов Жесткие требования при оценке документов, поданных на регистрацию с точки зрения эффективности, безопасности и качества Препарат сравнения должен иметь регистрацию в ЕС Индивидуальный подход при регистрации каждого биоаналога
Слайд 27В зависимости от показаний к применению биоаналога
CHMP (EMEA) определяет какую информацию подавать при регистрации и какие клинические испытания проводить
Слайд 28EMEA не гарантирует взаимозаменяемость биологических лекарственных препаратов
EMEA не гарантирует взаимозаменяемость биологических лекарственных средств и аналогов, в отличие от традиционных дженериков (“the decision … outside the organization's remit”- EMEA Executive Director Thomas Lonngren)
Органы здравоохранения должны решать вопрос взаимозаменяемости
Источник: European Union: 26 May 2006: Generics Industry Leader Warns of Stumbling Blocks to European Biosimilars Market
Слайд 29Обзор взаимозаменяемости биологических лекарственных средств в различных странах
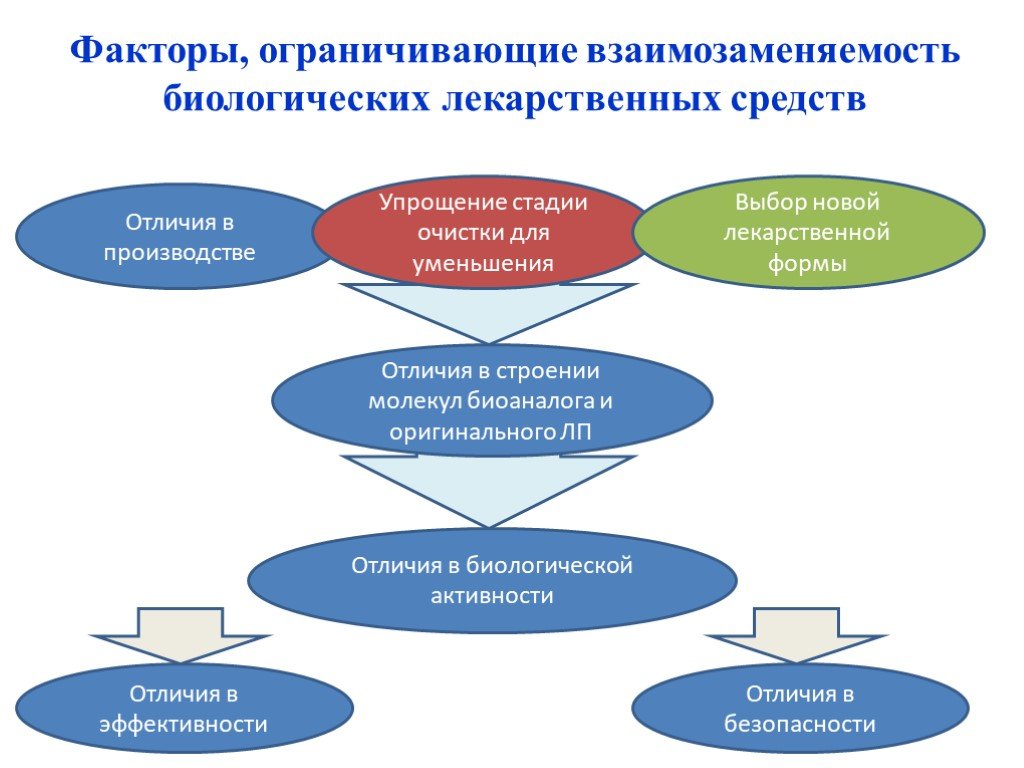
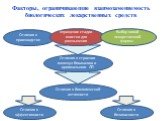
Слайд 30Отличия в производстве
Упрощение стадии очистки для уменьшения
Выбор новой лекарственной формы
Отличия в строении молекул биоаналога и оригинального ЛП
Отличия в биологической активности
Отличия в эффективности
Отличия в безопасности
Факторы, ограничивающие взаимозаменяемость биологических лекарственных средств
Слайд 31Регулирование взаимозаменяемости биологических лекарственных средств в Российском законодательстве
При отпуске препарата по рецепту врача разрешается отпуск любого препарата в рамках одного МНН Проведение закупок препаратов в рамках государственных программ по МНН не учитывает особенности действия различных групп лекарственных препаратов и делает возможным выбор препарата по единственному показателю - цена Первый шаг по регулированию взаимозаменяемости на российском рынке – разрешение закупок инсулинов и циклоспорина по торговым наименованиям
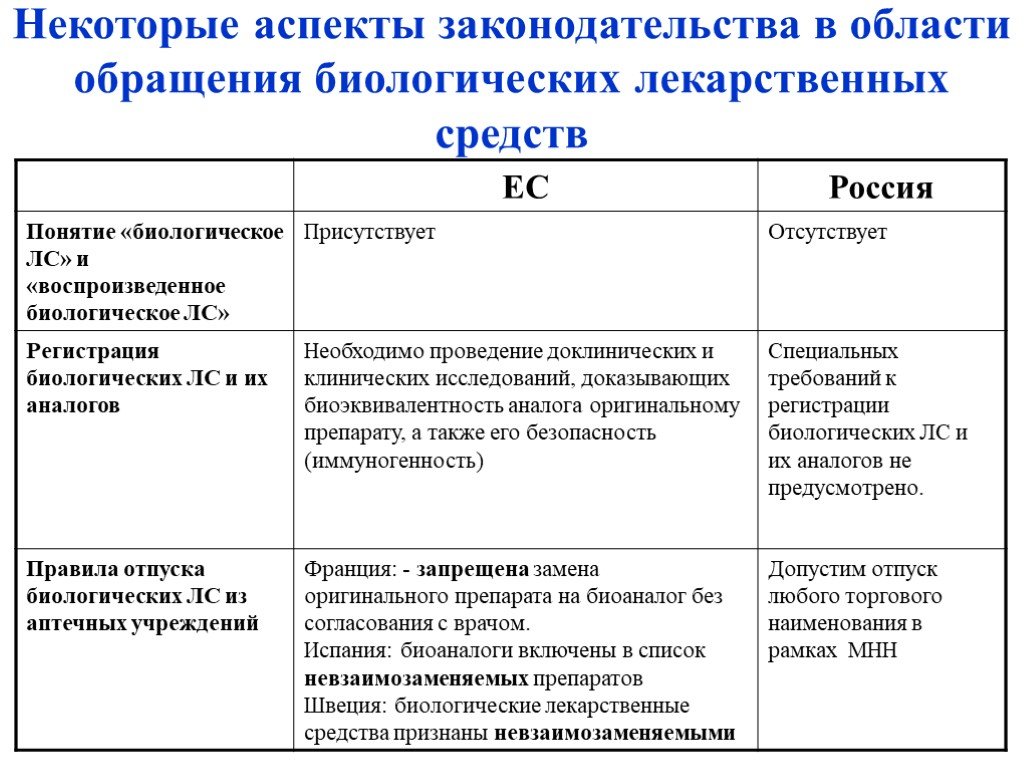
Слайд 32Некоторые аспекты законодательства в области обращения биологических лекарственных средств
Слайд 33Выводы:
Гармонизация российского законодательства в области обращения биологических ЛС с законодательством стран Европы Внесение определения «биологические ЛС» и «воспроизведенные биологические ЛС» в действующее законодательство. Регламентация регистрации воспроизведенных биологических ЛС, с учетом требований к предоставлению данных сравнительных клинических исследований биоаналога и оригинального препарата. Регламентация порядка замены оригинального биологического ЛС на воспроизведенное в аптечном учреждении только по согласованию с врачом. Разработка списка невзаимозаменяемых лекарственных препаратов. Получение одобрения на составление заявок на закупку биологических ЛС по торговому наименованию
Слайд 34Существующие аспекты регулирования обращения препаратов биологической природы в РФ не гарантируют качества, эффективности безопасности оказываемой лекарственной терапии при выборе биоаналога для организации лекарственного обеспечения
Слайд 35
Слайд 36