Конспект урока «ГИДРОЛИЗ СОЛЕЙ» по химии для 10 класса
Тема открытого урока: «ГИДРОЛИЗ СОЛЕЙ»
10-11 классы (12.12.2012 г.)
(Данный урок был дан мной на конкурс Муниципального этапа
«Учитель года -2013»)
-
АКТИВИЗАЦИЯ ОПОРНЫХ ЗНАНИЙ И УМЕНИЙ.
Учащийся зачитывает стихотворение о воде, одновременно просматривается учащимся видеоролик. Учитель задаёт вопрос: почему было прочитано данное стихотворение? (примерный ответ учащихся: мы сегодня, наверное, будем говорить о воде)
Стихотворение (читает ученица полностью наизусть, здесь приводится только отрывок)
Безбрежная ширь океана
И тихая заводь пруда
Струи водопада
И брызги фонтана
А в сущности только вода…
Разминка.
-
Электролиты
-
Электролитическая диссоциация.
-
Кислоты
-
Основания
-
Соли
-
Катион
-
Анион
-
Индикатор
-
Водородный показатель
-
Назовите формулы сильных оснований.
-
Назовите формулы слабых оснований.
-
Назовите формулы сильных кислот.
-
Назовите формулы слабых кислот.
-
По какому признаку эти вещества классифицируют на сильные и слабые?
-
Какие ионы образуются при диссоциации оснований?
-
Какова среда раствора в данном случае?
-
Какие ионы образуются при диссоциации кислот?
-
Какова среда раствора?
-
Сделайте вывод, присутствие каких ионов обуславливает щелочную и кислотную реакцию среды.
-
Как изменится цвет лакмуса в щелочной и кислотной среде?
-
Как изменится цвет фенолфталеина в щелочной и кислотной среде?
-
Как изменится цвет метилового оранжевого индикатора в щелочной и кислотной среде?
Химический эксперимент (работа в парах)
Перед вами три пробирки, в которых растворы кислоты, щелочи,
дистиллированная вода, водопроводная вода. Подтвердим ваши ответы экспериментом. При работе не забывайте о правилах ТБ при обращении с химическими веществами (ТБ учащиеся рассказывают в стихотворной форме)
Какова окраска универсальной индикаторной бумаги в пробирках?
Результаты реакций в 1-3 пробирках мы легко можем объяснить. А как объяснить слабощелочную реакцию среды в пробирке с водопроводной водой?
Вспомним, в чем различие дистиллированной воды и воды водопроводной. (присутствие растворенных солей). Значит, окраску лакмуса обуславливает наличие в воде растворенных солей.
Можем ли мы, основываясь на имеющихся знаниях, объяснить результаты 4 опыта? Действительно, вы столкнулись с неизвестным пока для вас явлением, которое не можете грамотно истолковать на основании имеющегося у вас опыта и знаний. Это явление – гидролиз солей в водных растворах, и ему мы посвятим сегодняшний урок.
Запишите тему урока:
ГИДРОЛИЗ СОЛЕЙ.
Наша цель – изучить сущность гидролиза солей в водных растворах.
Задачи – сформулировать определение понятия «гидролиз», научиться объяснять химические процессы, протекающие в водных растворах солей, записывать уравнения реакций гидролиза, предсказывать и объяснять изменение кислотности среды и образование кислых и основных солей в этом процессе, познакомиться с ролью гидролиза солей в природе, хозяйственной деятельности и повседневной жизни человека, познакомиться с гидролизом белков, жиров, углеводов в организме человека, с гидролизом мыла.(учащиеся, цель и задачи урока формулируют сами)
В заключении урока планируется тестовый контроль.
II. ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА.
Рассмотрим название явления «гидролиз». Данный термин состоит из двух составных частей от греческого «гидро» – вода, «лизис» – разложение. Дословно, гидролиз – разложение водой.
Думаю, к концу занятия нам удастся сформулировать полное определение понятия «гидролиз».
Лабораторная работа: «Определение среды растворов в солях»
Учащиеся работают в парах по инструктивной карточке. Учащиеся самостоятельно делают выводы и записывают реакции гидролиза солей.
В трёх пробирках находятся вещества: раствор хлорида алюминия, карбонат натрия, хлорид натрия. Учащиеся, используя универсальную индикаторную бумагу, исследуют растворы этих веществ. Как видите, в первой пробирке среда – кислая пробирке хлорид алюминия (РН меньше 7) во второй– карбонат натрия (РН больше 7) – щелочная, в четвёртой (РН = 7) – хлорид натрия нейтральная. Следовательно, можно сделать вывод, что
в 1й пробирке присутствуют ионы_ водорода_
во 2й пробирке ионы гидроксогруппы
в третьей пробирке ионы водорода и гидроксогруппы
Попробуем разобраться, что же произошло.
Вода, как вы знаете, является слабым электролитом и диссоциирует на положительные ионы водорода и гидроксид-ионы.
H
 2O H+ + OH-
2O H+ + OH-
Мы знаем, что соли – производные кислот и оснований.
Растворимая соль в воде диссоциирует на составляющие ее ионы.
Хлорид алюминия – соль, образованная слабым основанием и сильной кислотой, диссоциирует следующим образом
 Al(NO3)3 Al3+ + 3NO3-
Al(NO3)3 Al3+ + 3NO3-
О чевидно, что в растворе данной соли противоположно заряженные ионы объединятся.
чевидно, что в растворе данной соли противоположно заряженные ионы объединятся.
A
 l3+ + 3NO3- + H+ + OH- Al OH2- + H+ + 3NO3-
l3+ + 3NO3- + H+ + OH- Al OH2- + H+ + 3NO3-
Катионы алюминия прочно связывают гидроксид-ионы, так как гидроксид алюминия слабое основание и не подвергается диссоциации.
Хлорид-ионы не могут быть связаны катионами водорода, так как азотная кислота – сильная и диссоциирует полностью.
В результате – в растворе избыток катионов водорода, вследствии этого – среда раствора кислотная.
Al(NO3)3

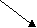
Al(OH)3HNO3
слабое основание сильная кислота
[OH]-H]+
Кислотная среда
Для того, чтобы записать уравнение гидролиза, воспользуемся памяткой.
-
Определим состав соли:
Al(NO3)3
сл. осн с. к-та
2. Возьмем ион слабого электролита и напишем уравнение его взаимодействия с составными частями воды:
A
 l3+ + HOH AlOH2+ + H+
l3+ + HOH AlOH2+ + H+
3. На основании краткого ионного уравнения напишем молекулярное уравнение. Исходные вещества известны – соль и вода, продукты гидролиза составим, связывая образовавшиеся ионы с теми ионами соли, которые не участвуют в гидролизе:
A l(NO3)3+ H2O AlOH(NO3 )2 + HNO3
l(NO3)3+ H2O AlOH(NO3 )2 + HNO3
О дним из продуктов данной обменной реакции является основная соль.
дним из продуктов данной обменной реакции является основная соль.
Сформулируем вывод:
Раствор соли, образованной слабым основанием и сильной кислотой, имеет кислотную реакцию, так как в растворе избыток катионов водорода.
Карбонат натрия – соль, образованная сильным основанием и слабой кислотой, диссоциирует следующим образом
N
 a2CO3 2Na+ + CO32-
a2CO3 2Na+ + CO32-
Карбонат-ионы прочно связываюткатионы водорода, так как угольная кислота слабая.
Катионы натрия не могут быть связаныгидроксид-ионами, так как гидроксид натрия – сильное основание и диссоциирует полностью.
2 Na+ + CO32- + H+ +OH- HCO3-+ 2Na+ + OH-
Na+ + CO32- + H+ +OH- HCO3-+ 2Na+ + OH-
В результате в растворе избыток гидроксид-ионов, вследствие чего среда щелочная.
результате в растворе избыток гидроксид-ионов, вследствие чего среда щелочная.
Na2CO3
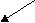

NaOH H2CO3
сильное основание слабая кислота
[OH]- > [H]+
Щелочная среда
 Воспользовавшись памяткой, самостоятельно составьте молекулярное уравнение гидролиза карбоната натрия.
Воспользовавшись памяткой, самостоятельно составьте молекулярное уравнение гидролиза карбоната натрия.
C O32- + H++OH- HCO3- + OH-
O32- + H++OH- HCO3- + OH-
N
 a2CO3 + H2O NaHCO3 + Na OH
a2CO3 + H2O NaHCO3 + Na OH
Одним из продуктов данной обменной реакции является кислая соль.
Сформулируем вывод:
Раствор соли, образованной сильным основанием и слабой кислотой, имеет щелочную реакцию, так как в растворе избыток гидроксид-ионов.
Хлорид натрия – соль, образованная сильным основанием и сильной кислотой.
N
 aCl Na+ + Cl-
aCl Na+ + Cl-
H
 2O H+ + OH-
2O H+ + OH-
Хлорид натрия гидролизу не подвергается,
так как в составе соли нет иона, который мог бы при взаимодействии с водой образовывать слабый электролит.
NaCl
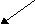

NaOH HCl
сильное основание сильная кислота
[OH]- ═ [H]+
 Среда нейтральная
Среда нейтральная
N aCl + H2O
aCl + H2O
С формулируем вывод:
формулируем вывод:
Раствор соли, образованной сильным основанием и сильной кислотой, имеет нейтральную реакцию, так как в растворе равное количество катионов водорода и гидроксид-ионов.
Случай, когда соль образована слабым основанием и слабой кислотой более сложный и будет рассмотрен. Продукты гидролиза зависят от соотношения констант диссоциации основания и кислоты. Отмечу лишь, что зачастую гидролиз в данном случае идет необратимо, соль полностью разлагается водой. В этом случае в таблице растворимости в ячейке соответствующей соли стоит прочерк. Учитель объясняет гидролиз сульфида алюминия.
Думаю, теперь мы сможем сформулировать определение понятия «гидролиз»
Проанализируйте записи молекулярных уравнений рассмотренных процессов:
К какому типу мы отнесем данные реакции?
Какие вещества в них участвуют?
В чем заключается сущность гидролиза? Какие продукты данных взаимодействий с точки зрения теории электролитической диссоциации мы получили?
Итак, гидролиз – это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита.
III. ЗАКРЕПЛЕНИЕ
Можно ли по составу соли сделать заключение о возможности ее гидролиза?
Это возможно с помощью таблицы растворимости. Нерастворимые соли гидролизу практически не подвергаются. Если соль в воде растворима, то следует выяснить, входит ли в ее состав катион, отвечающий слабому основанию, или анион, отвечающий слабой кислоте.
Так отчего же водопроводная вода имеет слабощелочную среду? Из-за гидролиза солей, которые в качестве примесей имеются в водопроводной воде. Можем предположить, что это соли, образованные слабым основанием и сильной кислотой. Предлагаю в качестве домашнего задания следующее: выяснить из дополнительных источников , какие соли находятся в нашей воде и составить уравнения их гидролиза.
Заполнение таблицы
| Уравнение гидролиза | Среда раствора | Окраска лакмусовой бумаги | |
| Карбонат калия | | | |
| Нитрат железа (II) | | | |
| Хлорид бария | | | |
IY. ИЗУЧЕНИЕ НОВОГО МАТЕРИАЛА.
Роль и практическое применение гидролиза (сообщения учащихся)
Гидролиз в природе.
Обменные реакции между солями и водой широко распространены в природе.
Явление гидролиза играет огромную роль в химическом преобразовании земной коры. Многие минералы земной коры - это сульфиды металлов, которые хотя и плохо растворимы в воде, постепенно взаимодействуют с ней. Такие процессы идут и на поверхности Земли, и особенно интенсивно в ее глубинах при повышенной температуре. В результате образуется огромное количество сероводорода, который выбрасывается на поверхность при вулканической деятельности. А силикатные породы постепенно переходят в гидроксиды, а затем в оксиды металлов. В результате гидролиза минералов – алюмосиликатов – происходит разрушение горных пород.
Известный нам малахит (Cu2(OH)2CO2) – не что иное, как продукт гидролиза природных карбонатов.
В Мировом океане соли также интенсивно взаимодействуют с водой. Выносимые речной водой гидрокарбонаты кальция и магния придают морской воде слабощелочную реакцию. Именно в такой слабощелочной среде прибрежных вод
РН приблизительно равно 9 наиболее интенсивно протекает фотосинтез в морских растениях и наиболее быстро развиваются морские животные. А если вспомнить о составе РН крови млекопитающих, в том числе и человека, то вы сможете не только сделать вывод о единстве животного мира на Земле но и сформулировать и некоторые гипотезы происхождении жизни на планете.
Гидролиз в народном хозяйстве.
Гидролиз доставляет немало хлопот нефтяникам. Как известно, в нефти имеются примеси воды и многих солей, особенно хлоридов кальция и магния. При нагревании нефти в процессе ее переработки до 250 град С и выше происходит интенсивное взаимодействие указанных хлоридов с водяным паром. Образующийся при этом газообразный хлороводород вступает в реакцию с металлом, из которого сделано оборудование, разрушает его, что резко увеличивает стоимость нефтепродуктов.
Впрочем, на счету гидролиза немало и добрых дел. Например, образующийся при взаимодействии сульфата алюминия с водой мелкодисперсный осадок гидроксида алюминия уже несколько веков используется в качестве протравы при крашении. Оседая на ткань и прочно соединяясь с ней, гидроксид алюминия затем легко адсорбирует красители и образует весьма устойчивые красящие слои, которые выдерживают многократную стирку ткани. Без протравы качественной окраски тканей не получится.
Этот же процесс используют для очистки питьевой воды и промышленных стоков: рыхлый аморфный осадок гидроксида алюминия обволакивает частички грязи и адсорбирует вредные примеси, увлекая все это на дно. Примерно таков же механизм очистки природной воды глинами, которые представляют собой соединения алюминия.
Гидролиз солей Na2CO3Na3PO4 применяется для очистки воды и уменьшения ее жесткости.
Известкование почв с целью понижения их кислотности также основано на реакции гидролиза
C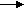
 O32- + НОН НСО3- + ОН+
O32- + НОН НСО3- + ОН+
Посредством гидролиза в промышленности из непищевого сырья (древесины, хлопковой шелухи, подсолнечной лузги, соломы вырабатывается ряд ценных продуктов: этиловый спирт, белковые дрожжи, глюкоза, сухой лед.
Гидролиз в жизни человека
В повседневной жизни мы постоянно сталкиваемся с явлением гидролиза – при стирке белья, мытье посуды, умывании мылом. Даже процессы пищеварения, в частности, расщепление жиров, белков, углеводов протекают благодаря гидролизу (сообщение учащихся)
Одной из важнейших функций системы пищеварения (демонстрируется таблица “Пищеварительная система”) является химическая переработка пищи, в результате которой сложные органические вещества превращаются в более простые. Они всасываются во внутреннюю среду, а затем используются клетками организма. Используя достаточное количество пищи, мы снабжаем себя необходимыми
веществами и получаем достаточное количество энергии. Но прежде чем получитьнеобходимые вещества, пища подвергается в организме атаке ферментов, гидролизу. И только тогда, раздробленная пища усваивается организмом. Так как белки являются полипептидами, то полный гидролиз, например, трипептида можно представить так. Белки в желудке под действием ферментов находящихся в желудочном соке расщепляются до аминокислот. (слайд № )
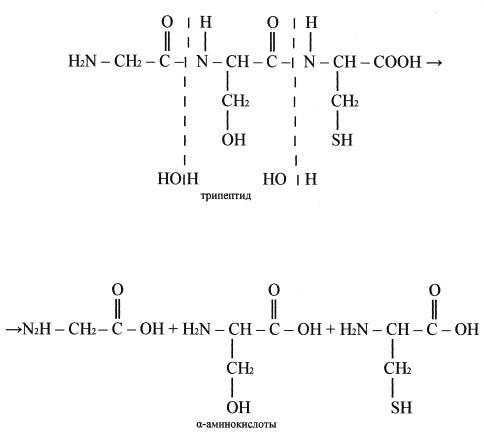
В кишечнике под действием фермента липазы жиры пищи гидролизуются на глицерин и карбоновые кислоты, всасываются и синтезируются новые жиры, свойственные данному организму (слайд №) Учащиеся записывают реакции на доске и в тетрадях.
Углеводы являются важным компонентом нашей пищи. Причем ди-(сахароза, лактоза, мальтоза) и полисахариды (крахмал, гликоген) непосредственно не усваиваются организмом. Они сначала подвергаются гидролизу. Гидролиз полисахарида, например крахмала, идет ступенчато (слайд № ) Крахмал подвергается гидролизу под действием фермента слюны (амилазы). Схематически его можно изобразить так:
![]()
Поскольку пища в ротовой полости пребывает недолго, то крахмал здесь переваривается лишь частично. Основным же местом переваривания крахмала служит тонкий кишечник, куда поступает амилаза в составе сока поджелудочной железы.
Y. ПЕРВИЧНЫЙ КОНТРОЛЬ УСВОЕНИЯ МАТЕРИАЛА.
Выполнение тестового задания. 1 вариант
-
Гидролиз солей – это:
А) обменная реакция соли с водой;
Б) растворение соли в воде;
В) диссоциация соли в воде.
2. Сущность гидролиза заключается:
А) в диссоциации молекул соли на ионы;
Б) в образовании слабодиссоциирующих веществ;
В) в образовании молекул сильных электролитов.
3. Раствор нитрата магния Mg(NO3)2 имеет
А) кислотную среду;
Б) щелочную среду;
В) нейтральную среду.
4. Используя памятку «Составление уравнений гидролиза солей» и таблицу растворимости, напишите полное ионное, сокращенное ионное и молекулярное уравнение гидролиза сульфида калия K2S.
5. В результате гидролиза углеводов в ротовой полости образуется:
а) аминокислота б) глюкоза в) глицерин г) фосфорная кислота
6. В результате гидролиза жиров в организме человека образуются: а) аминокислоты и жирные кислоты б) глицерин и жирные кислоты в) глицерин и глюкоза г) глюкоза
7. Гидролиз белка протекает:
а) в желудке
б) в кишечнике
в) в ротовой полости
г) в толстой кишке
Выполнение тестового задания. 2 вариант
-
Гидролиз солей – это:
А) растворение соли в воде;
Б) обменная реакция соли с водой;
В) диссоциация соли в воде.
2. Сущность гидролиза заключается:
А) в диссоциации молекул соли на ионы;
Б) в образовании молекул сильных электролитов;
В) в образовании слабодиссоциирующих веществ.
3. Раствор фосфата калия K3PO4 имеет
А) кислотную среду;
Б) щелочную среду;
В) нейтральную нейтральную среду.
4. Используя памятку «Составление уравнений гидролиза солей» и таблицу растворимости, напишите сокращенное ионное и молекулярное уравнение гидролиза сульфата магния MgSO4.
5. В результате гидролиза белков в пищеварительном тракте человека образуется: а) аминокислота б) глюкоза в) глицерин г) фосфорная кислота
6. Хлорид натрия имеет среду раствора:
а) кислую б) щелочную в) слабокислую г) нейтральную
7. В ротовой полости гидролизу подвергается:
а) крахмал,
б) жир,
в) белок.
Поведение итогов выполнения задания. Верные ответы, ключ для оценки успешности выполнения теста.
YI. ПОДВЕДЕНИЕ ИТОГОВ УРОКА .
Итак, как вы считаете, смогли ли мы решить в ходе урока поставленную цель?
Что вы узнали, чему научились?
Домашнее задание:
-
Заполните таблицу:
| Уравнение гидролиза | Среда раствора | Окраска лакмусовой бумаги | |
| Нитрат цинка | | | |
| Сульфат калия | | | |
| Сульфид натрия | | | |
2. Почему дистиллированная вода имеет нейтральную реакцию, а водопроводная – слабощелочную? Выясните из дополнительных источников, какие соли находятся в нашей водопроводной воде и составьте уравнения их гидролиза.
3*. Вспомните, какие соли входят в состав крови человека. Используя знания о гидролизе, объясните, почему среда плазмы слабощелочная. Составьте уравнения соответствующих реакций гидролиза.
Завершая наше путешествие, я хочу напомнить, что, созерцая красоту нежной, молодой зелени, пёстрые краски лета, золотые и багряные оттенки осени, мы во многом обязаны солям различных металлов, природные растворы которых скромно дарят нам такие неповторимые впечатления и ощущение.
ЛИТЕРАТУРА
-
Сгибнева Е.П., Скачков А.В. «Современные открытые уроки химии», Ростов-на –Дону, «Феникс», 2002г;
-
Четверова Л.М. «Гидролиз солей», «Химия», № 8, 2004г
-
Габриелян О.С., Лысова Г.Г., Введенская А.Г. «Настольная книга учителя. Химия 11 класс», Москва, «Дрофа», 2003г
-
Новошинский И.И., Новошинская Н.С. «Химия. 10 класс», Москва, «Оникс 21 век», 2004г
Ко всему уроку имеется и презентация.
Инструктивная карточка к лабораторной работе по теме:
«Гидролиз солей».
-
Возьмите стаканчик с водой растворите в нём нитрат алюминия № 1 – добавьте в полученный раствор лакмус.
-
Запишите свои наблюдения, сделайте вывод о среде раствора и наличие каких ионов в растворе об этом свидетельствуют.
-
Возьмите стаканчик с водой растворите в нём карбонат натрия № 2 – добавьте в полученный раствор лакмус.
-
Запишите свои наблюдения, сделайте вывод о среде раствора и наличие каких ионов в растворе об этом свидетельствуют.
-
Возьмите стаканчик с водой растворите в нём хлорид натрия № 3 – добавьте в полученный раствор лакмус.
-
Запишите свои наблюдения, сделайте вывод о среде раствора и наличие каких ионов в растворе об этом свидетельствуют.
Инструктивная карточка к лабораторной работе по теме:
«Изменения цвета универсальной индикаторной бумаги в растворах
кислот и щелочей».
-
Возьмите пробирку № 1 с раствором воды опустите в неё универсальную индикаторную бумагу.
-
Отметьте цвет индикаторной бумаги, сделайте вывод.
-
Возьмите пробирку № 2 с раствором кислоты опустите в неё универсальную индикаторную бумагу.
-
Отметьте цвет индикаторной бумаги, сделайте вывод.
-
Возьмите пробирку № 3 с раствором щёлочи опустите в неё универсальную индикаторную бумагу.
-
Отметьте цвет индикаторной бумаги, сделайте вывод.
| Окраска индикатора в среде | |||
| | Кислая[H+] > [OH-] рН | Нейтральная[H+] = [OH-] рН = 7 | Щелочная[OH-] > [H+] рН > 7 |
Лакмус | красный | фиолетовый | синий |
| Фенолфталеин | бесцветный | бесцветный | малиновый |
| Метилоранж | розовый | оранжевый | желтый |
ТЕХНОЛОГИЧЕСКАЯ КАРТА УРОКА ХИМИИ в 10 и 11 классах «ГИДРОЛИЗ ВЕЩЕСТВ».
| ГИДРОЛИЗ | |
| Место урока в теме | Первый урок |
| Тип урока | Повторение, обобщение, систематизация знаний по теме. |
| Вид урока | Комбинированный |
| Цели урока: Образовательные | Сформировать представление о процессе гидролиза солей, гидролизе органических веществ и их сущности. Научить учащихся составлять уравнения гидролиза веществ. Совершенствовать умение объяснять реакцию среды раствора присутствием соответствующих ионов. Дать представление о практическом значении гидролиза в природе, народном хозяйстве, повседневной жизни человека. |
| развивающие | Развивать: учебно-информационные навыки: умение извлекать информацию из устного сообщения, справочных таблиц, наблюдаемых процессов; учебно-логические: умение анализировать данные, выявлять сущность наблюдаемых процессов, обобщать и делать выводы, формулировать определения понятий; учебно-организационные: организовывать самостоятельную деятельность, совершенствовать навыки самооценки знаний и умений. |
| воспитательные | Совершенствовать коммуникативные умения в ходе коллективного обсуждения, развивать умение формулировать и аргументировать собственное мнение, развивать самостоятельность. Продолжить формирование убеждения учащихся в необходимости привлечения средств химии к пониманию и описанию процессов, происходящих в окружающем мире. |
| Содержание урока | Механизм гидролиза солей различного состава, суть процесса гидролиза, роль гидролиза в природе и жизни человека. |
| Требования к знаниям и умениям учащихся: | Должны знать: понятие «гидролиз солей», его сущность, зависимость среды раствора и продуктов гидролиза от состава исходной соли; значение гидролиза в природе и жизни человека, практическое значение гидролиза органических веществ, гидролиз органических веществ в организме человека |
| Должны уметь: объяснять процессы, протекающие в растворах солей, предсказывать реакцию раствора в зависимости от состава соли, подвергающейся гидролизу, образование кислых и основных солей в реакциях гидролиза записывать сокращенные ионные и молекулярные уравнения реакций гидролиза | |
| Этапы | Организационный этап – 0,5 мин Подготовка к основному этапу усвоения учебного материала – 5 мин Усвоение новых знаний и способов действия – 27 мин Первичная проверка степени усвоения материала – 5мин (при проведении урока в 40 минут, этот этап исключить) Контроль и самопроверка знаний (тест) – 5 мин. Подведение итогов – 2 мин Домашнее задание – 0,5 мин |
| Средства обучения | Компьютер, мультимедийное сопровождение, оборудование и реактивы для демонстрационного эксперимента и эксперимента учащихся, памятка по составлению уравнений реакций гидролиза, справочная таблица «Растворимость оснований, кислот, солей в воде», учебник, тесты, инструктивные карточки к лабораторной работе, тексты с домашним заданием, памятка – таблица «Изменение цвета индикаторов в растворах веществ», видеоролик. |
| Методы обучения | Проблемно-поисковый, практический, объяснительно- иллюстративный. |
| Способы мотивации учения | Связь темы с повседневной жизнью. Влияние гидролиза на процесс геологической, химической и биологической эволюции планеты. Межпредметные связи: география, биология. |
| Формы организации учебной деятельности | Коллективная – фронтальная, самостоятельная - индивидуальная, парная. |
| Виды познавательной деятельности | Эксперимент, наблюдение за демонстрационным экспериментом, участие в проблемной беседе |
| Способы управления познавательной деятельностью | Ознакомление с целями и задачами урока, видами контроля. |
| Способы отслеживания результатов | Тесты для контроля и самопроверки знаний (5 мин)1 задание контролирует знание понятия «гидролиз» 2 задание – знание сущности процесса гидролиза 3 задание - умение предсказывать среду раствора соли по ее составу 4 задание – умение составлять уравнения гидролиза, верно записывать ионы, определять их заряд, пользоваться таблицей растворимости. 5 – 7 задания – знание гидролиза органических веществ в организме человека. «Гидролиз солей» 1 вариант
А) обменная реакция соли с водой; Б) растворение соли в воде; В) диссоциация соли в воде. 2. Сущность гидролиза заключается: А) в диссоциации молекул соли на ионы; Б) в образовании слабодиссоциирующих веществ; В) в образовании молекул сильных электролитов. 3. Раствор нитрата магния Mg(NO3)2 имеет А) кислотную среду; 4. Используя памятку «Составление уравнений гидролиза солей» и таблицу растворимости, напишите сокращенное ионное и молекулярное уравнение гидролиза сульфида калия K2S. 5. В результате гидролиза углеводов в ротовой полости образуется: а) аминокислота б) глюкоза в) глицерин г) фосфорная кислота 6. В результате гидролиза жиров в организме человека образуются: а) аминокислоты и жирные кислоты б) глицерин и жирные кислоты в) глицерин и глюкоза г) глюкоза 7. Гидролиз белка протекает: а) в желудке б) в кишечнике в) в ротовой полости г) в толстой кишке
«Гидролиз солей» 2 вариант
А) растворение соли в воде; Б) обменная реакция соли с водой; В) диссоциация соли в воде. 2. Сущность гидролиза заключается: А) в диссоциации молекул соли на ионы; Б) в образовании молекул сильных электролитов; В) в образовании слабодиссоциирующих веществ. 3. Раствор фосфата калия K3PO4 имеет А) кислотную среду; 4. Используя памятку «Составление уравнений гидролиза солей» и таблицу растворимости, напишите сокращенное ионное и молекулярное уравнение гидролиза сульфата магния MgSO4. 5. В результате гидролиза белков в пищеварительном тракте человека образуется: а) аминокислота б) глюкоза в) глицерин г) фосфорная кислота 6. Хлорид натрия имеет среду раствора: а) кислую б) щелочную в) слабокислую г) нейтральную 7. В ротовой полости гидролизу подвергается: а) крахмал, б) жир, в) белок.
Верные ответы: 1 вариант: 1а, 2б, 3а, 4. S2- + H+ + OH- = HS- + OH-; 5.б, 6. б, 7. а 2 вариант: 1б, 2в, 3б, Mg2+ + H+ + OH- = MgOH+ + H+; 5. а 6. г 7. а Ключ к оценке качества выполнения теста: «5» - 1 ошибка; «4» - 2 ошибки «3» - 3 ошибки |
| Литература | Сгибнева Е.П., Скачков А.В. «Современные открытые уроки химии», Ростов-на –Дону, «Феникс», 2002г;Четверова Л.М. «Гидролиз солей», «Химия», № 8, 2004г Габриелян О.С., Лысова Г.Г., Введенская А.Г. «Настольная книга учителя. Химия 11 класс», Москва, «Дрофа», 2003г Новошинский И.И., Новошинская Н.С. «Химия. 10 класс», Москва, «Оникс 21 век», 2004г О.С. Габриелян «Химия 10 класс», «Химия 11 класс», М. «Дрофа», 2010 год. |
Далее представлен материал для оформление классной доски.




















Муниципальное общеобразовательное учреждение Дмитриево Помряскинская
средняя общеобразовательная школа.
Самоанализ урока в 10,11 классах по химии: «Гидролиз»
Дата: 11.12.2012 год. Урок был дан на районный конкурс «Учитель года – 2012»
-
Характеристика класса.
В 10 классе 7 учащихся, в 11 классе – 5 учащихся. В 10 классе - 5 ударников, в 11 классе –
4 ударника. Учащиеся имеют средний уровень усвоения предмета – химии.
2. Цели и задачи урока.
Учащиеся сами формулируют цель урока и его задачи исходя из темы урока. Целью урока является – выяснить в течение урока, в чём заключается суть процесса гидролиза.
Триединые задачи урока:
Обучающий аспект триединой цели урока сформулирован следующим образом: дать определение «гидролизу», научить учащихся составлять уравнения гидролиза веществ, совершенствовать умение объяснять реакцию среды раствора присутствием соответствующих ионов. Познакомить учащихся с практическим значением процесса гидролиза.
Развивающий аспект: продолжить развивать умения учащихся работать с таблицей растворимостью веществ; развитие познавательных действий: память, внимание, логическое мышление, умение сравнивать, анализировать, делать выводы, развивать умения учащихся ставить себе оценку.
Воспитывающий аспект: воспитывать культуру речи и поведения на уроке, толерантность, умение работать в парах, умение формулировать и аргументировать своё мнение, развивать самостоятельность; формировать убеждения учащихся, что знания о гидролизе веществ необходимы при описании процессов происходящих в природе.
Цели и задачи урока я считаю, были достигнуты. Учащиеся освоили материал, разобрались в понятие гидролиза, умеют определять среду растворов солей растворённых в воде при выполнении лабораторных работ, знают причину обуславливающую среду раствора (наличие ионов водорода или гидроксид ионов), узнали практическое применение процесса гидролиза, научились составлять логически – следственные связи по данной теме.
3. Методы урока.
Я использовала методы: объяснительно – иллюстративный (при повторении домашнего задания, изучении новой темы), частично – поисковый (при выведении определение «гидролиз», проведение лабораторной работы, закреплении)
4. Формы организации деятельности.
Использовала на уроке: коллективную форму деятельности (при фронтальном опросе класса – в начале и в качестве закрепления после изученной темы),
индивидуальную (тестирование – дифференцированное по вариантам), работу в парах (при проведении лабораторной работы)
5. Тип урока.
Комбинированный – повторение и изучение нового материала.
6. Метапредметные связи.
С биологией (сообщения учащихся при ознакомлении с значением процесса гидролиза), с литературой (стихотворение о воде, в стихотворной форме даётся техника безопасности при работе с химическими реактивами).
7. Место урока в теме.
Данный урок относится к 3 теме: «Химические реакции», 10 уроком в теме и первым из двух по данной теме. Он является продолжением при изучении окислительно-восстановительных реакций.
8. Использование современных информационных технологий и современных средств ТСО.
Я старалась использовать на данном уроке современные методы педагогических технологий в виде мультипроектора (презентации по данной теме), видеоролик «О воде», готовые дифференцированные тесты, микролабораторию; оформление доски: число, тема урока, девиз, химические понятия, инструкция по ТБ, домашнее задание.
8. Домашнее задание.
Домашнее задание мной было дано в полном объёме, оно соответствует санитарным нормам, дана памятка по составлению процесса гидролиза для каждого учащегося, памятка «Изменение цвета индикаторов в растворах кислот, оснований». Кратко мной домашнее задание было прокомментировано. Задание дано в виде таблицы и проблемных вопросов, при ответе на которые необходимо воспользоваться знаниями по биологии.
Вывод.
Я считаю, что урок достиг своей цели, учащиеся усвоили, что такое «гидролиз», смогли самостоятельно изучить и сделать вывод о различных типах солей, был заложен материал о составлении гидролиза солей. Урок соответствует современным требованиям, он был дан в форме деятельностного подхода. Задания учителем подбирались согласно психологическим и физиологическим и возрастным особенностям выпускников. Учащиеся показали средний уровень усвоения материала, смогли сами сделать вывод урока. Большинство учащихся были задействованы в форме проведения урока по мере своих способностей и склонностей по данному предмету. Каждый ученик был включён в активную познавательную деятельность. Каждый последующий момент урока тесно связан с предыдущим, продолжением его и сам является базой, продолжением предшествующего. Структура урока была подчинена триединой цели и содействовала достижению конечного результата.
Недостатки и замечания к уроку.
1. Не хватило времени на более глубокое рассмотрение вопроса о практическом применении процесса гидролиза (не были заслушаны сообщения учащихся)
2. Не все дети достаточно активны были на уроке.
Я считаю, что проведённый мной урок, учитывая недостатки и замечания можно оценить
на «хорошо».
Учитель химии, биологии, географии I квалификационной категории
_______________ Витман Диана Александровна
Здесь представлен конспект к уроку на тему «ГИДРОЛИЗ СОЛЕЙ», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (10 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

