Слайд 1Производные пиримидин-2,4,6-триона (барбитуровой кислоты)
Сибирский государственный медицинский университет
Слайд 2Основные программные вопросы
Химико-фармакологическая классификация производных барбитуровой кислоты (барбитуратов). Структурные формулы, химические и латинские названия производных барбитуровой кислоты: барбитал и его натриевая соль, гексобарбитал-натрий (гексенал), фентобарбитал-натрий, тиопентал-натрий, фентобарбитал, бензобарбитал (бензонал), бензобамил. Физические свойства барбитуратов. Общие химические свойства производных барбитуровой кислоты, используемые для их идентификации. Отличительные химические свойства барбитуратов. Методы количественного определения барбитуратов. Особенности хранения производных барбитуровой кислоты. Применение препаратов группы барбитуратов.

Слайд 31. Химико-фармакологическая классификация производных барбитуровой кислоты (барбитуратов)
По химическому строению: а) барбитураты кислоты (барбитал, фенобарбитал, бензонал, бензобамил); б) барбитураты соли (барбитал-натрий, этаминал-натрий, тиопентал-натрий, гексенал). По физиологическому действию: а) снотворные средства (барбитал, барбитал-натрий, этаминал-натрий); б) средства для неингаляционного наркоза (гексенал, тиопентал-натрий); в) противосудорожные средства (фенобарбитал, бензонал, бензобамил, гексамидин).
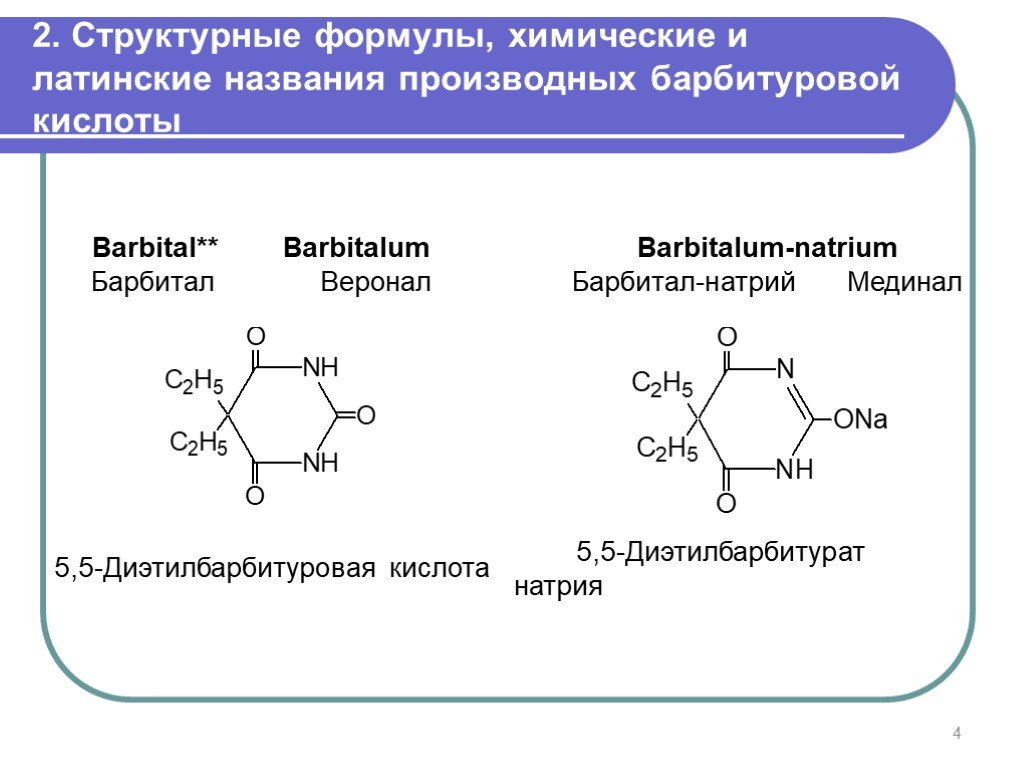
Слайд 42. Структурные формулы, химические и латинские названия производных барбитуровой кислоты
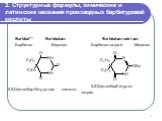
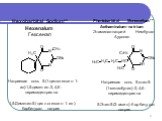
Barbital** Barbitalum Барбитал Веронал
5,5-Диэтилбарбитуровая кислота
Barbitalum-natrium Барбитал-натрий Мединал
5,5-Диэтилбарбитурат натрия
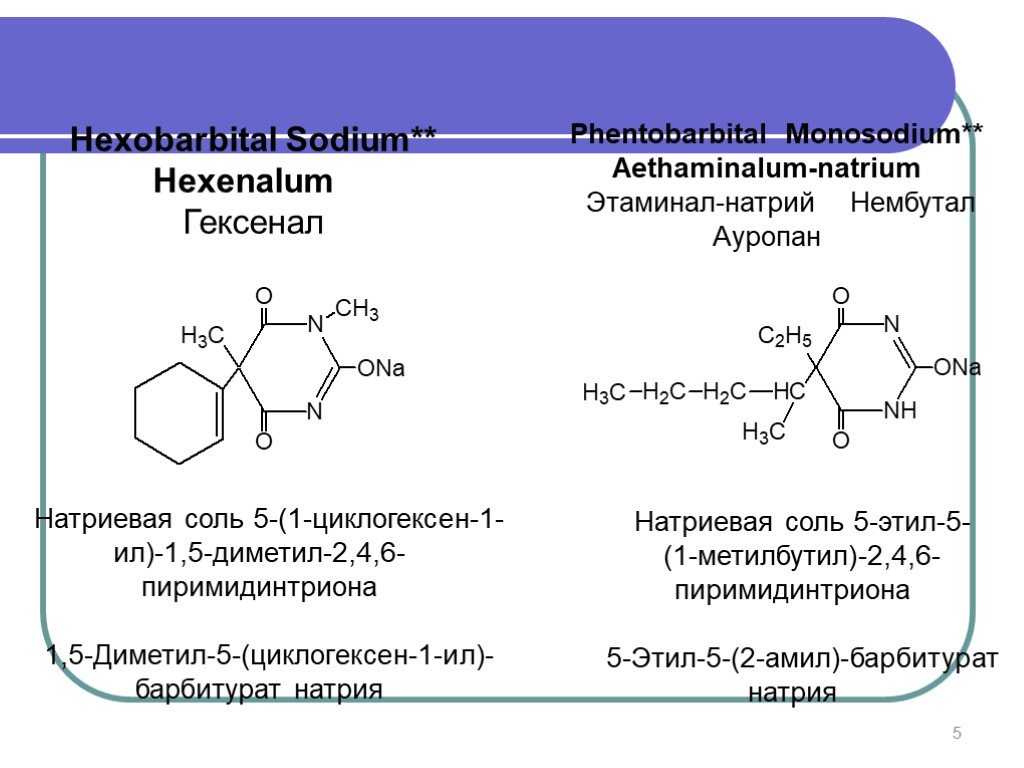
Слайд 5Hexobarbital Sodium** Hexenalum Гексенал
Натриевая соль 5-(1-циклогексен-1-ил)-1,5-диметил-2,4,6-пиримидинтриона 1,5-Диметил-5-(циклогексен-1-ил)-барбитурат натрия
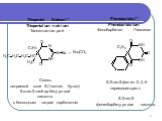
Phentobarbital Monosodium** Aethaminalum-natrium Этаминал-натрий Нембутал Ауропан
Натриевая соль 5-этил-5- (1-метилбутил)-2,4,6-пиримидинтриона 5-Этил-5-(2-амил)-барбитурат натрия
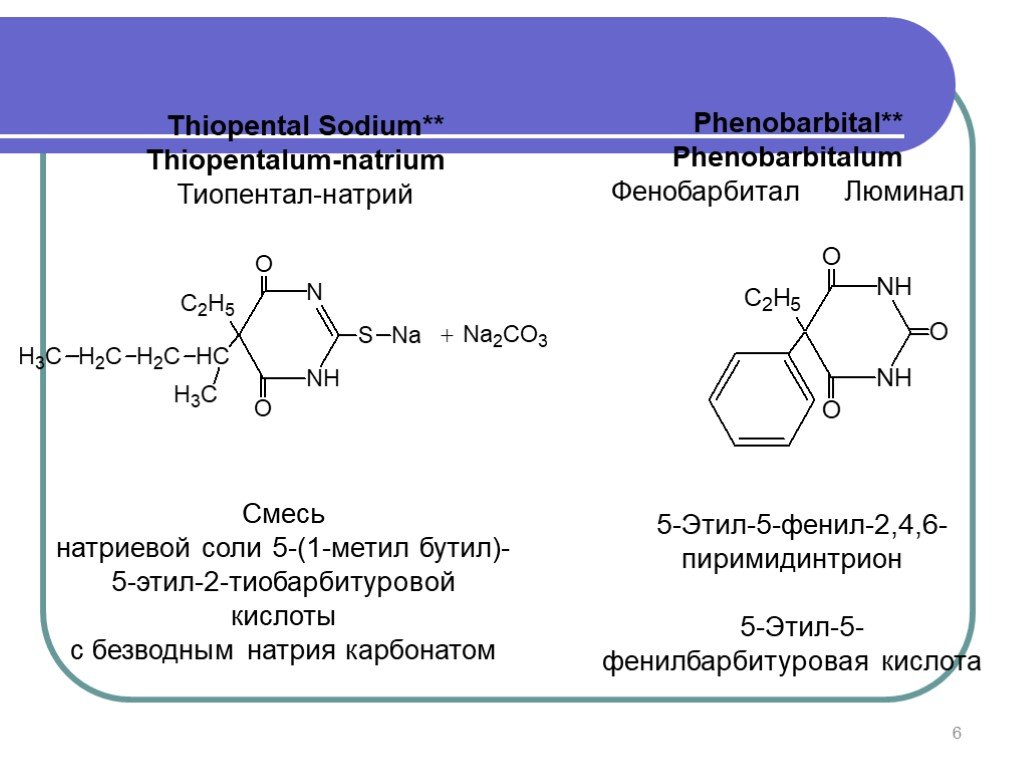
Слайд 6Thiopental Sodium** Thiopentalum-natrium Тиопентал-натрий
Смесь натриевой соли 5-(1-метил бутил)-5-этил-2-тиобарбитуровой кислоты с безводным натрия карбонатом
Phenobarbital** Phenobarbitalum Фенобарбитал Люминал
5-Этил-5-фенил-2,4,6-пиримидинтрион 5-Этил-5-фенилбарбитуровая кислота
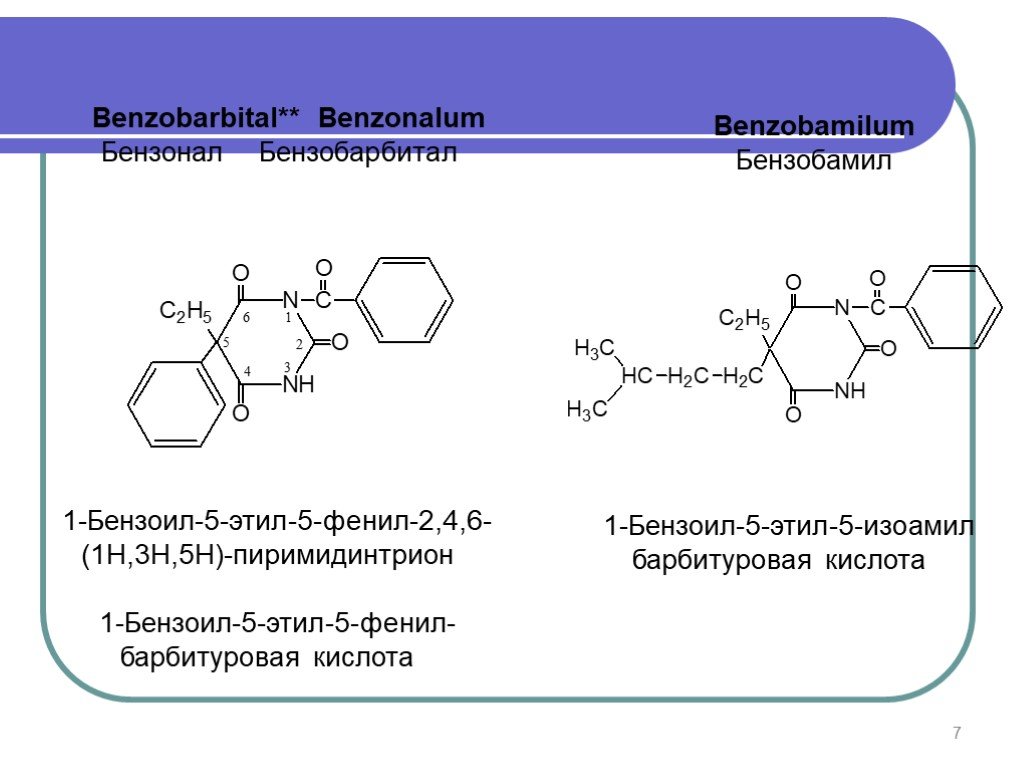
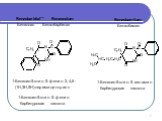
Слайд 7Benzobarbital** Benzonalum Бензонал Бензобарбитал
1-Бензоил-5-этил-5-фенил-2,4,6-(1Н,3Н,5Н)-пиримидинтрион 1-Бензоил-5-этил-5-фенил-барбитуровая кислота
Benzobamilum Бензобамил
1-Бензоил-5-этил-5-изоамил барбитуровая кислота
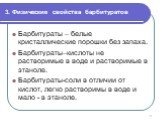
Слайд 83. Физические свойства барбитуратов
Барбитураты – белые кристаллические порошки без запаха. Барбитураты–кислоты не растворимые в воде и растворимые в этаноле. Барбитураты-соли в отличии от кислот, легко растворимы в воде и мало - в этаноле.
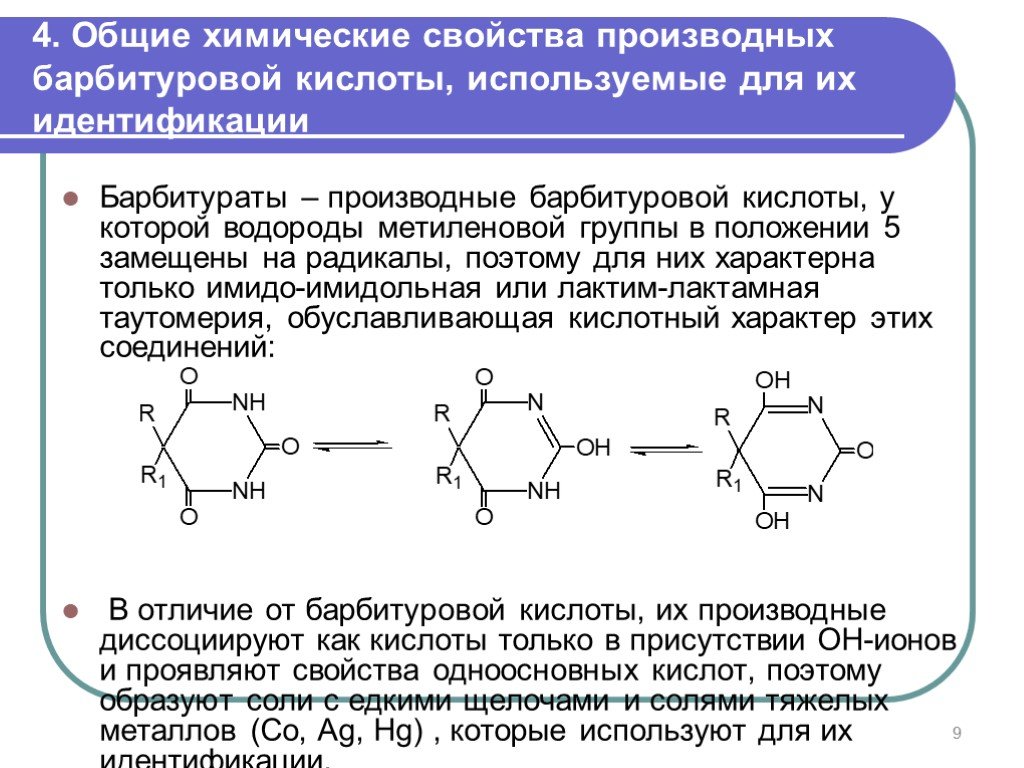
Слайд 94. Общие химические свойства производных барбитуровой кислоты, используемые для их идентификации
Барбитураты – производные барбитуровой кислоты, у которой водороды метиленовой группы в положении 5 замещены на радикалы, поэтому для них характерна только имидо-имидольная или лактим-лактамная таутомерия, обуславливающая кислотный характер этих соединений: В отличие от барбитуровой кислоты, их производные диссоциируют как кислоты только в присутствии ОН-ионов и проявляют свойства одноосновных кислот, поэтому образуют соли с едкими щелочами и солями тяжелых металлов (Co, Ag, Hg) , которые используют для их идентификации.
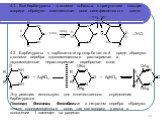
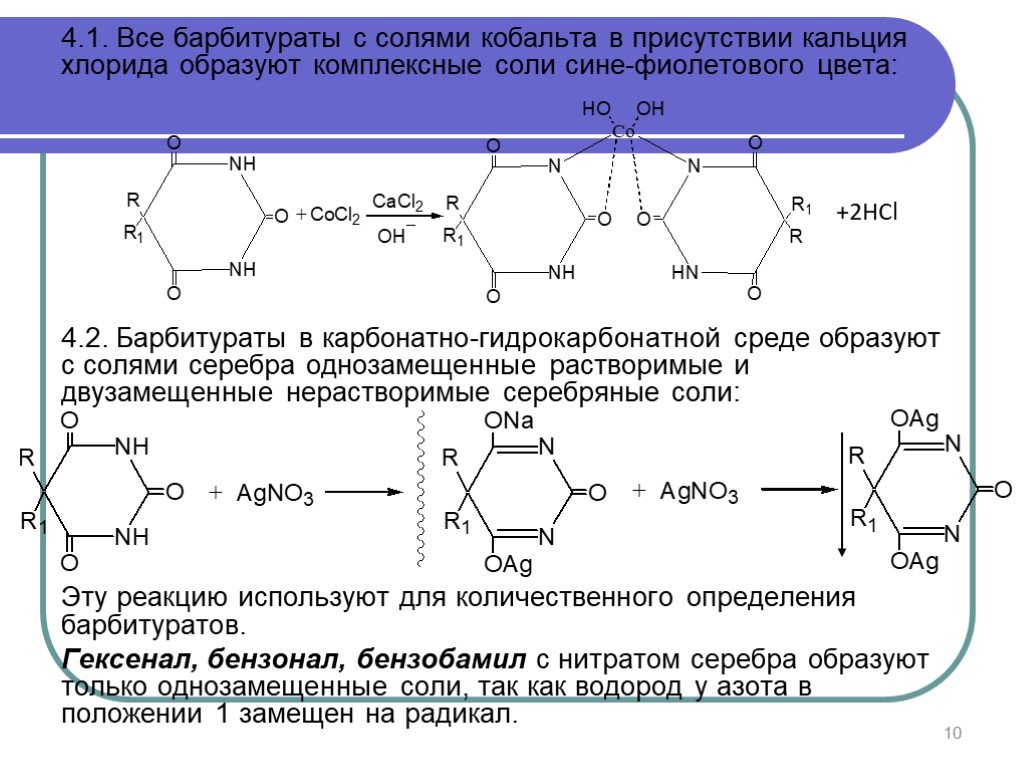
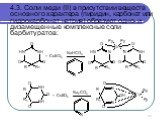
Слайд 104.1. Вce барбитураты с солями кобальта в присутствии кальция хлорида образуют комплексные соли сине-фиолетового цвета: 4.2. Барбитураты в карбонатно-гидрокарбонатной среде образуют с солями серебра однозамещенные растворимые и двузамещенные нерастворимые серебряные соли: Эту реакцию используют для количественного определения барбитуратов. Гексенал, бензонал, бензобамил с нитратом серебра образуют только однозамещенные соли, так как водород у азота в положении 1 замещен на радикал.
+2HCl
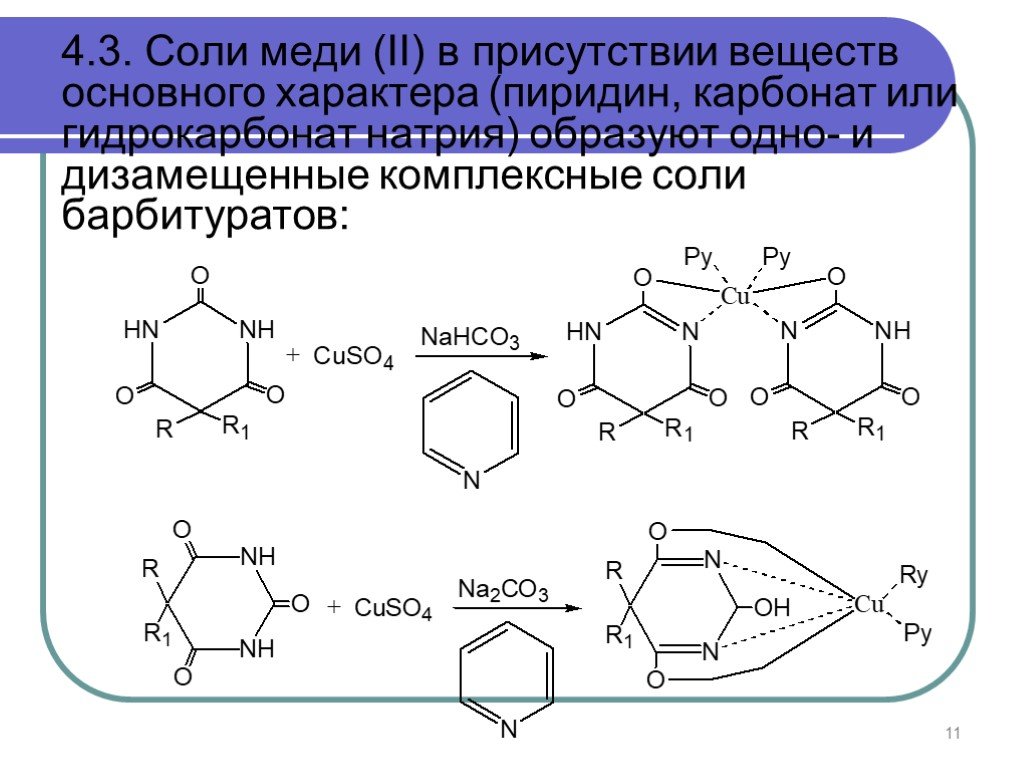
Слайд 114.3. Соли меди (II) в присутствии веществ основного характера (пиридин, карбонат или гидрокарбонат натрия) образуют одно- и дизамещенные комплексные соли барбитуратов:
Слайд 124.4. Все барбитураты при сплавлении с натрия гидроксидом разлагаются с образованием солей диалкилпроизводных уксусной кислоты, аммиака и натрия карбоната. 4.5. Реакции на пиримидиновый цикл – при взаимодействии с концентрированной серной кислотой и раствором калия дихромата появляется стойкое зеленое окрашивание. – при нагревании с реактивом Манделина появляется травянисто-зеленое окрашивание, переходящее в голубое. – при сплавлении с резорцином и концентрированной серной кислотой, последующем охлаждении и подщелачивании раствором натрия гидроксида появляется зеленая флуоресценция. – мурексидная проба: при нагреваний препаратов с пергидролем и HCl в присутствии аммония хлорида, с последующим прибавлением раствора аммиака, появляется пурпурное окрашивание.
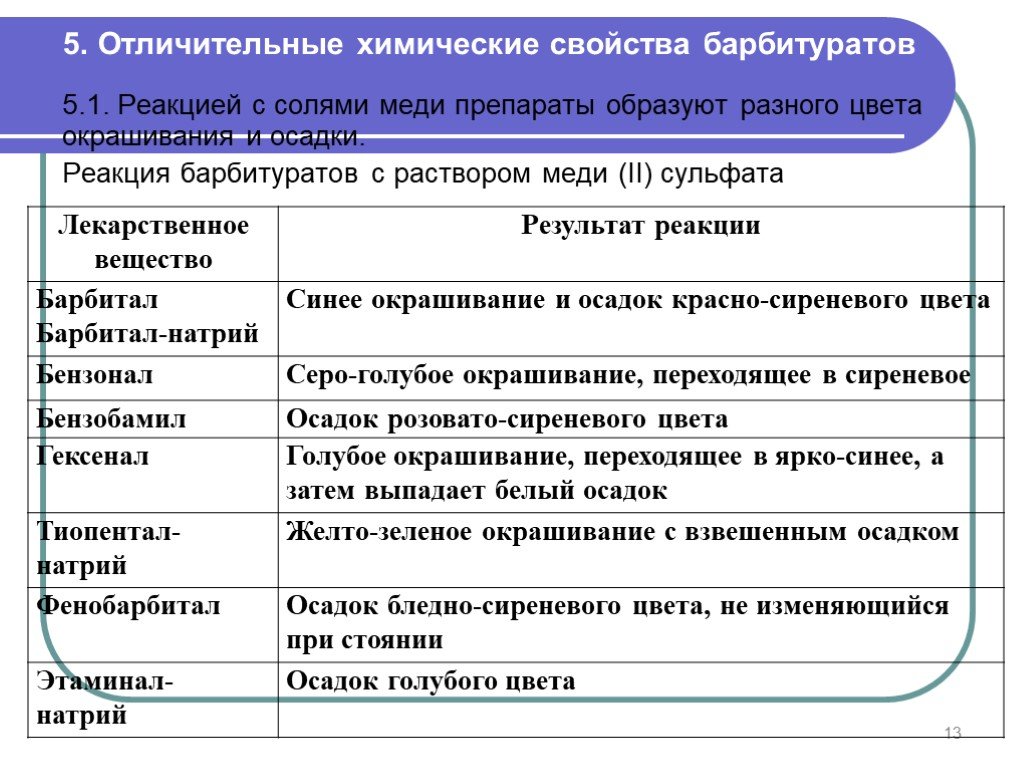
Слайд 135. Отличительные химические свойства барбитуратов
5.1. Реакцией с солями меди препараты образуют разного цвета окрашивания и осадки. Реакция барбитуратов с раствором меди (II) сульфата
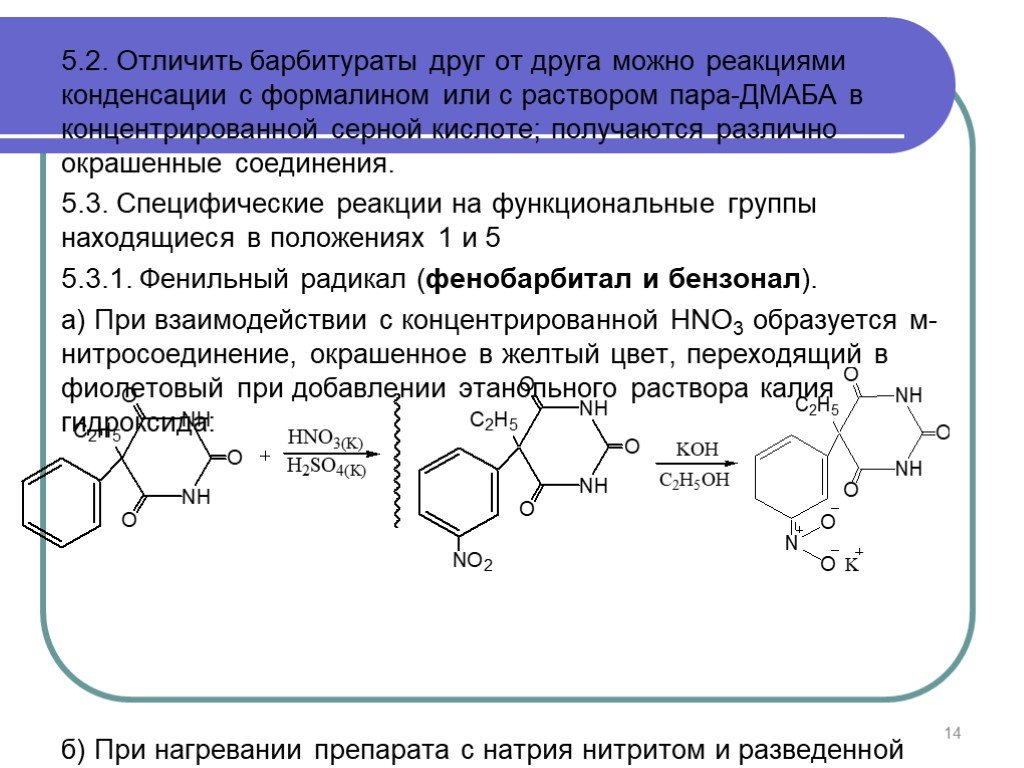
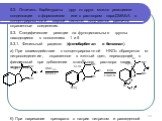
Слайд 145.2. Отличить барбитураты друг от друга можно реакциями конденсации с формалином или с раствором пара-ДМАБА в концентрированной серной кислоте; получаются различно окрашенные соединения. 5.3. Специфические реакции на функциональные группы находящиеся в положениях 1 и 5 5.3.1. Фенильный радикал (фенобарбитал и бензонал). а) При взаимодействии с концентрированной НNO3 образуется м-нитросоединение, окрашенное в желтый цвет, переходящий в фиолетовый при добавлении этанольного раствора калия гидроксида: б) При нагревании препарата с натрия нитритом и разведенной H2SO4 появляется оранжево-желтое окрашивание с коричневым оттенком.

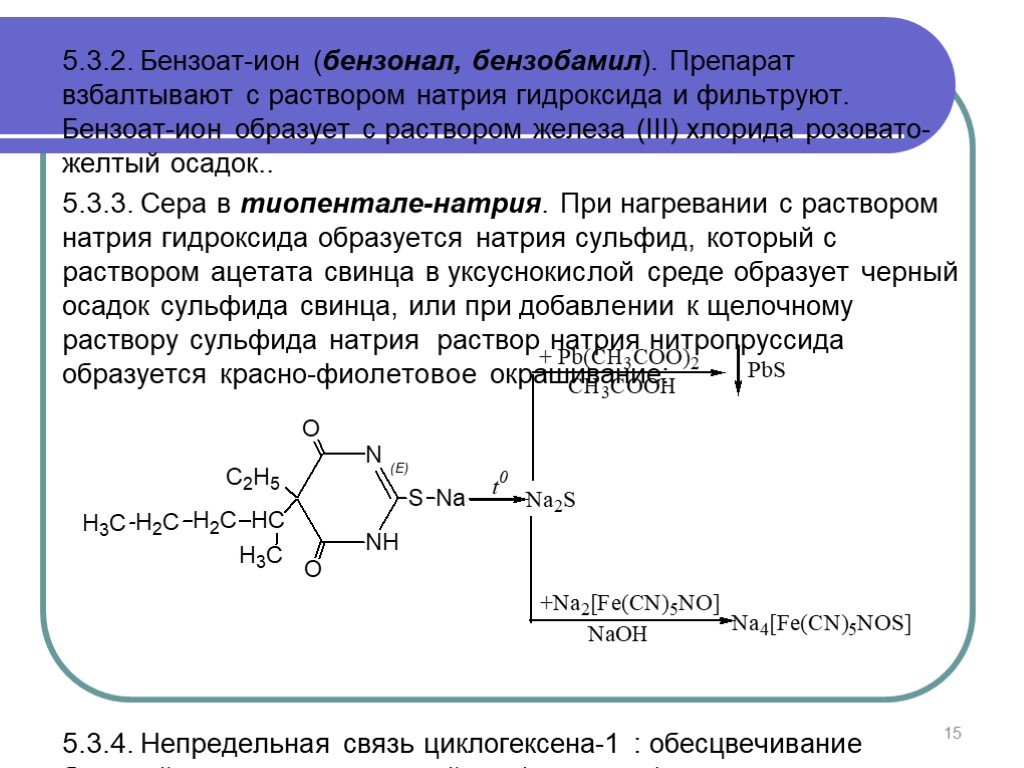
Слайд 155.3.2. Бензоат-ион (бензонал, бензобамил). Препарат взбалтывают с раствором натрия гидроксида и фильтруют. Бензоат-ион образует с раствором железа (III) хлорида розовато-желтый осадок.. 5.3.3. Сера в тиопентале-натрия. При нагревании с раствором натрия гидроксида образуется натрия сульфид, который с раствором ацетата свинца в уксуснокислой среде образует черный осадок сульфида свинца, или при добавлении к щелочному раствору сульфида натрия раствор натрия нитропруссида образуется красно-фиолетовое окрашивание: 5.3.4. Непредельная связь циклогексена-1 : обесцвечивание бромной воды или раствора йода (гексенал).
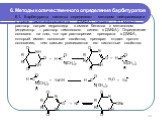
Слайд 166. Методы количественного определения барбитуратов
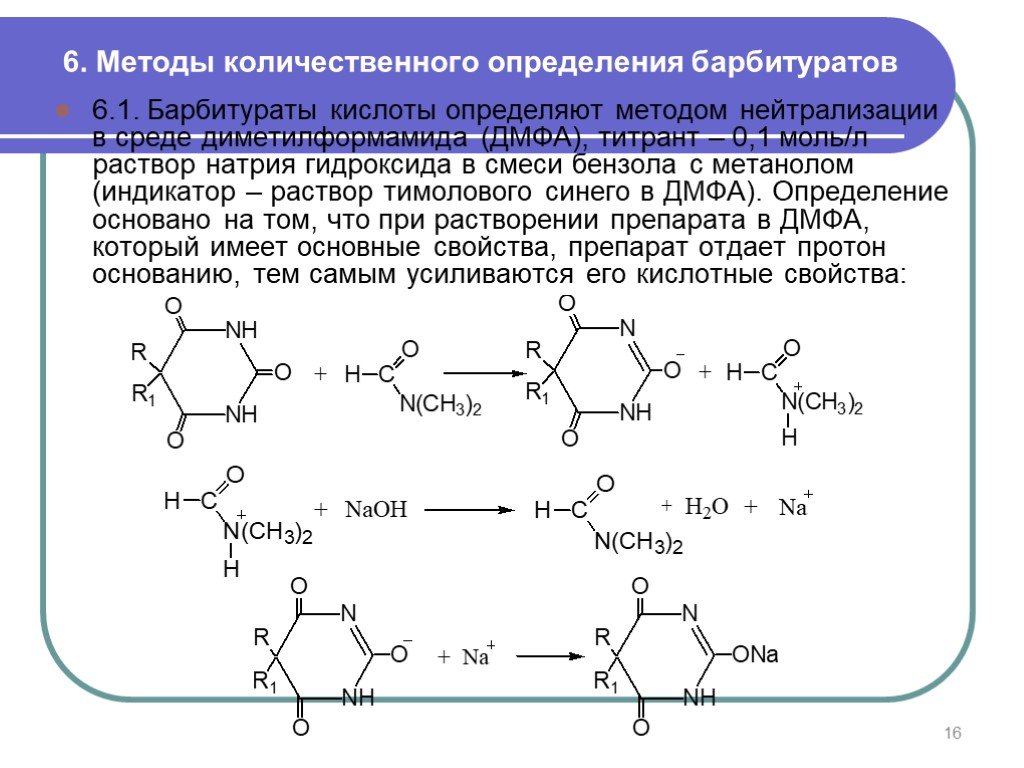
6.1. Барбитураты кислоты определяют методом нейтрализации в среде диметилформамида (ДМФА), титрант – 0,1 моль/л раствор натрия гидроксида в смеси бензола с метанолом (индикатор – раствор тимолового синего в ДМФА). Определение основано на том, что при растворении препарата в ДМФА, который имеет основные свойства, препарат отдает протон основанию, тем самым усиливаются его кислотные свойства:

Слайд 176.2. В водно-этанольной среде. Препарат растворяют в этаноле и титруют 0,1 моль/л раствором натрия гидроксида (индикатор – тимолфталеин или фенолфталеин). 6.3. Барбитураты соли титруют 0,1 моль/л раствором хлороводородной кислоты (индикатор – метиловый-оранжевый). 6.4. Аргентометрический метод, основанный на образовании одно- и двузамещенных солей серебра. 6.5. Гравиметрический метод основан на переведении солей в свободные кислоты, которые извлекают эфиром или хлороформом. Затем растворитель удаляют, остаток высушивают до постоянной массы и рассчитывают содержание препарата. 6.6. Препарат тиопентал-натрий является смесью натриевой соли тиопентала с натрия карбонатом, поэтому при титровании раствором хлороводородной кислоты будет мешать Na2CO3. Вследствие этого тиопентал-натрий определяют гравиметрически, а натрия карбонат титруют 0,1 моль /л раствором хлороводородной кислоты (индикатор – метиловый красный). 6.7. УФ-спектрофотометрия в области 239-240 нм (боратный буферный раствор с рН 10).

Слайд 187. Особенности хранения производных барбитуровой кислоты
Барбитураты хранят в защищенном от света месте. Гексенал и тиопентал хранят в стеклянных флаконах, герметически закрытых резиновыми пробками, обжатыми алюминиевыми колпачками, в сухом, прохладном, защищенном от света месте, так как под влиянием света и СO2 они разлагаются.
Слайд 198. Применение препаратов группы барбитуратов
Препараты применяют как успокаивающие и снотворные средства; гексенал и тиопентал-натрий – как наркотические (чаще для наркоза в виде водного раствора) и снотворные средства. Фенобарбитал, бензонал и бензобамил – противосудорожные средства; применяют при эпилепсии.