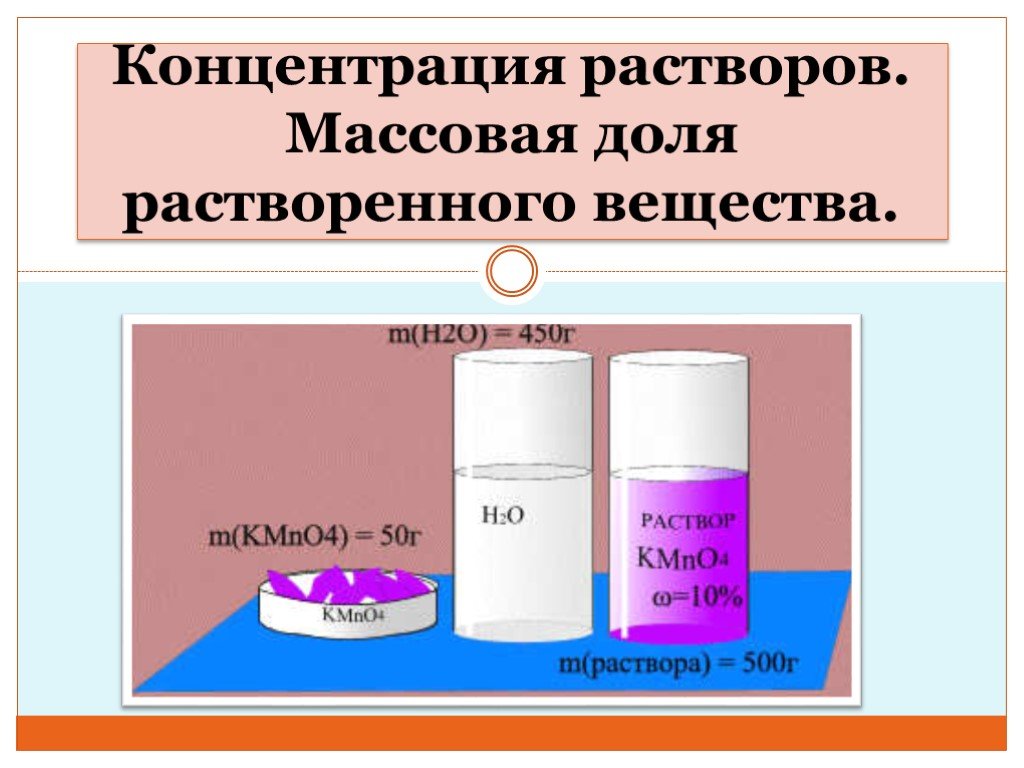
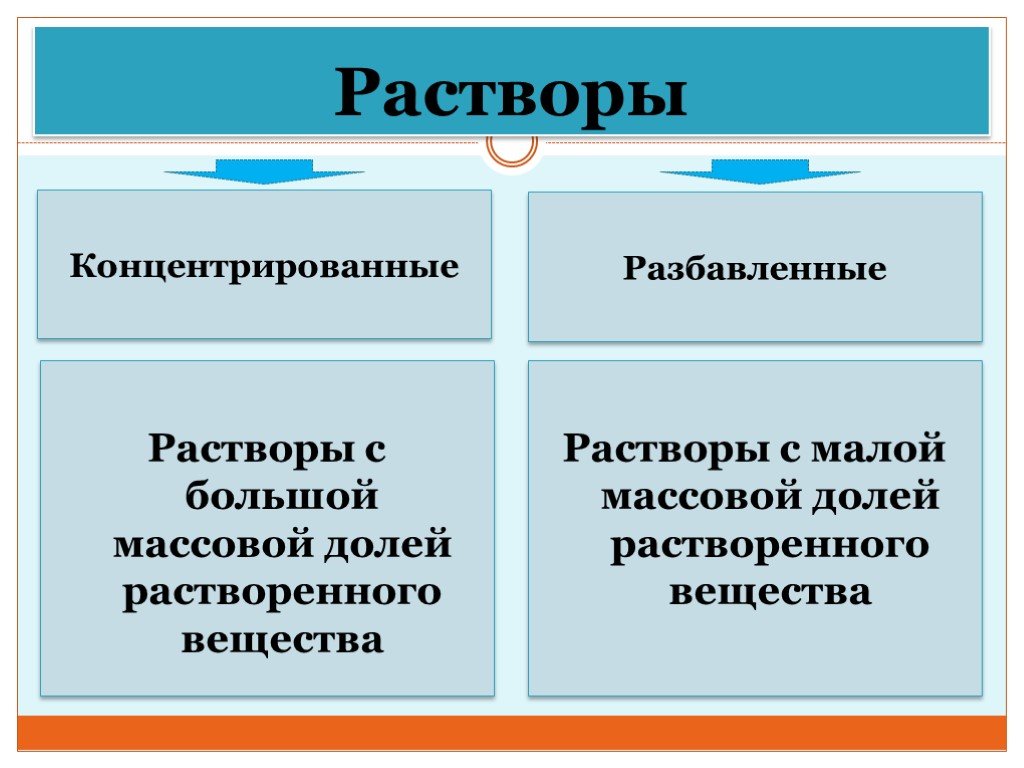
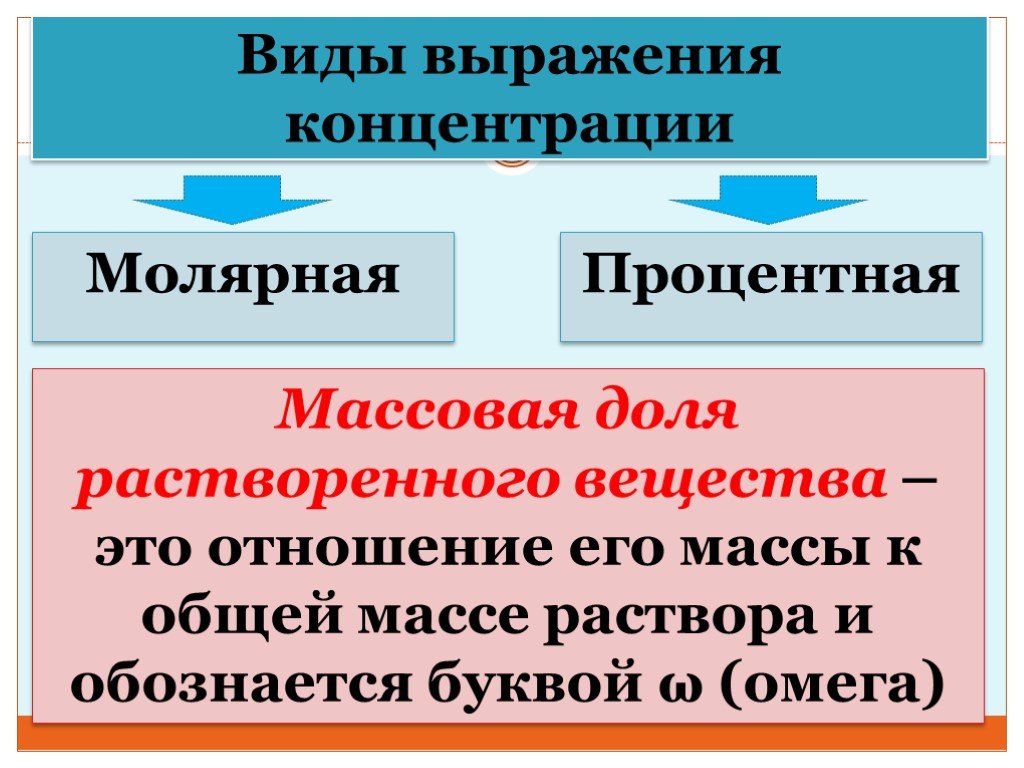
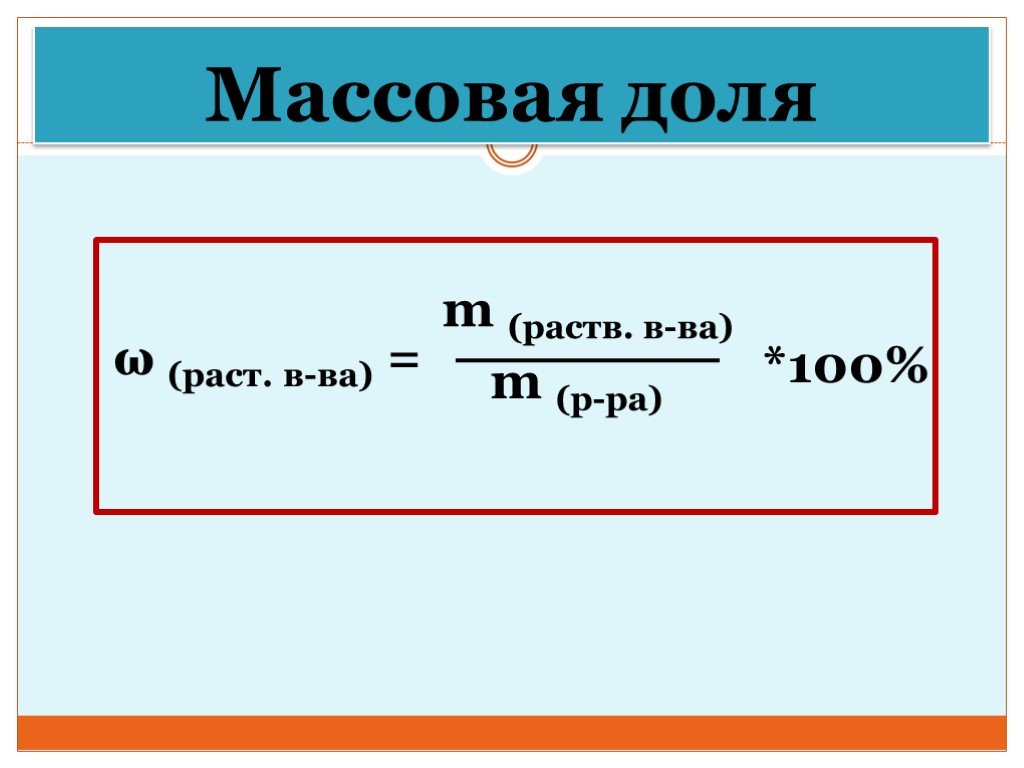
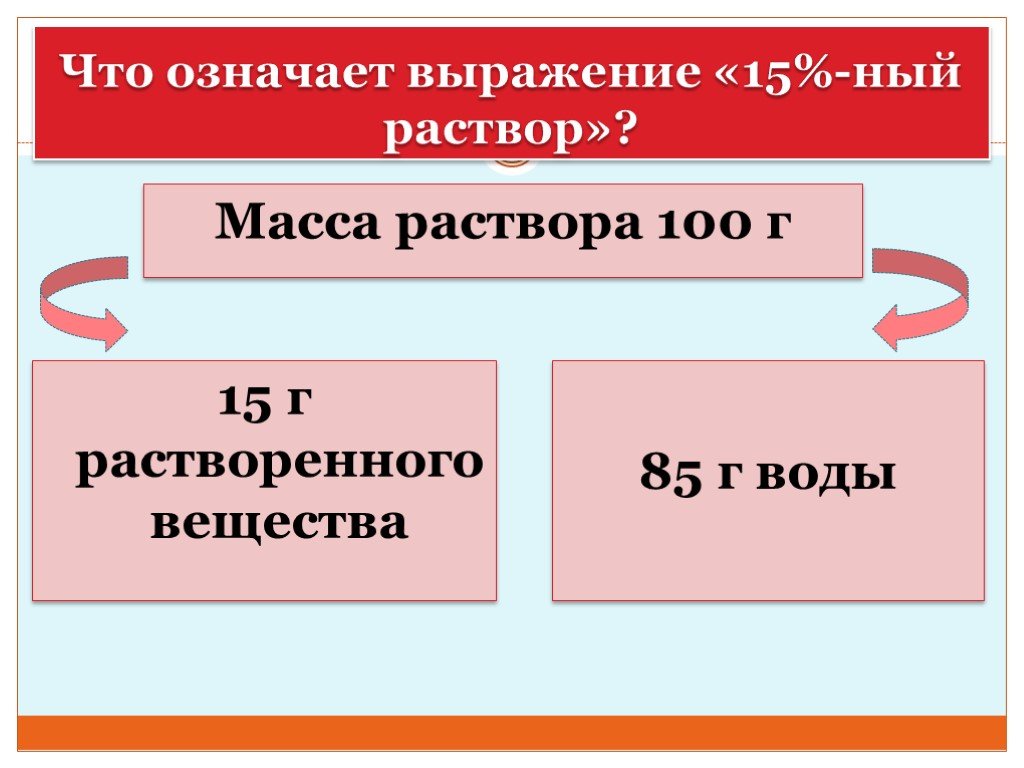
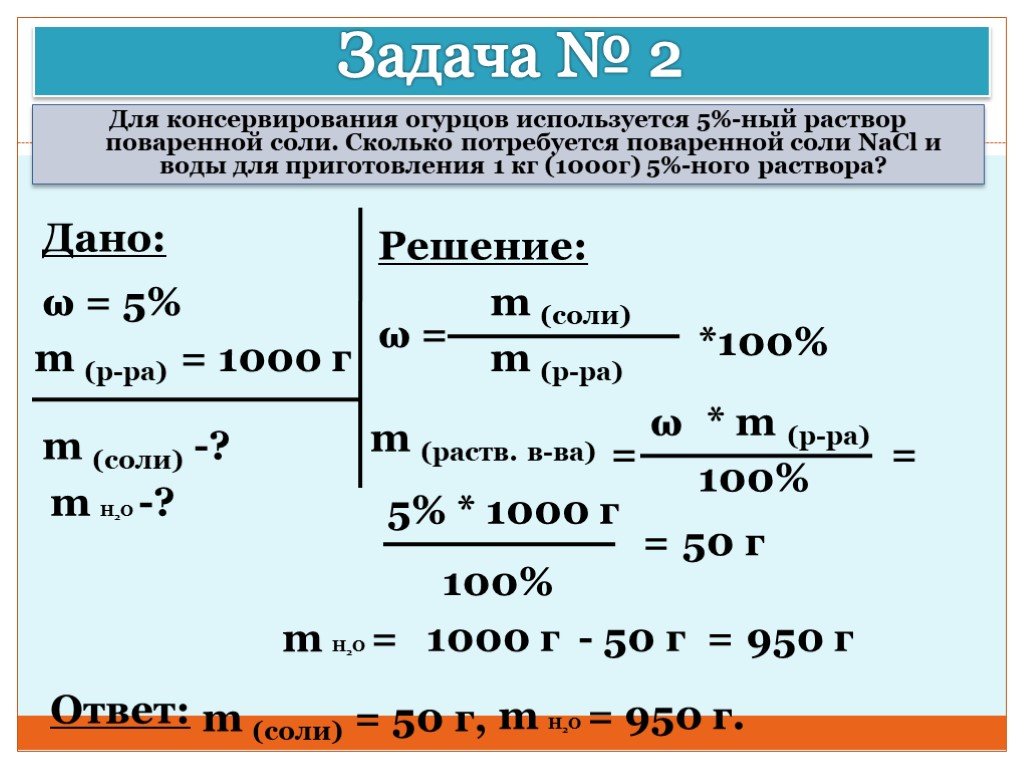
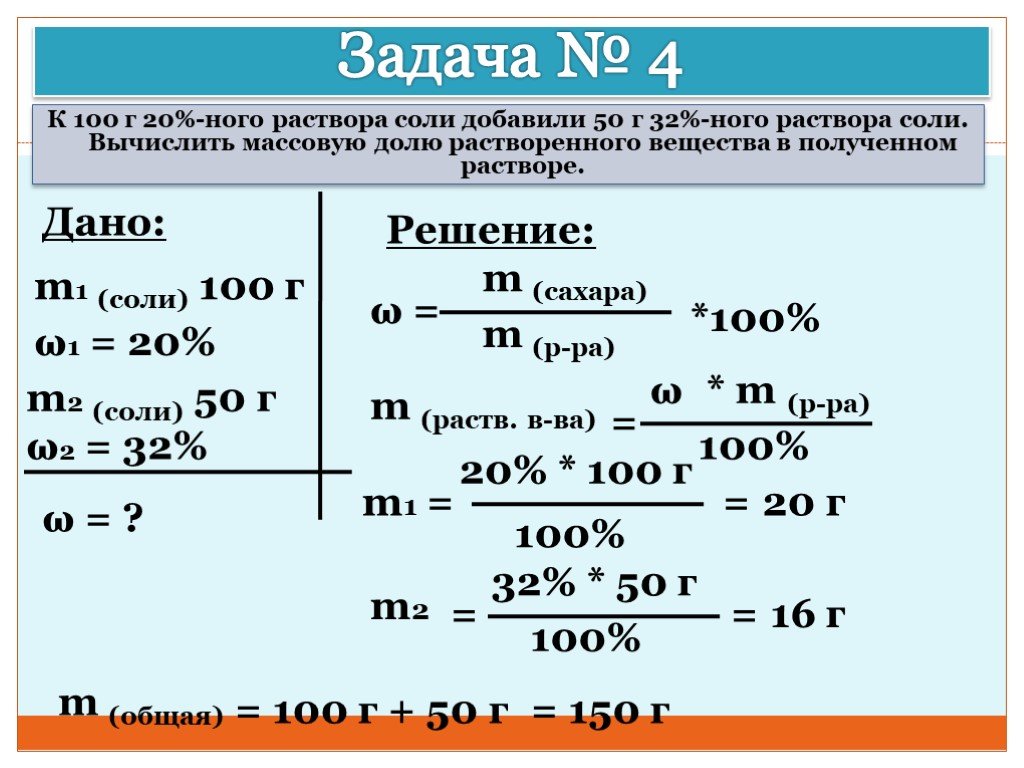
Презентация "Концентрация растворов. Массовая доля растворенного вещества." – проект, доклад
Презентацию на тему "Концентрация растворов. Массовая доля растворенного вещества." можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Разные. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 13 слайд(ов).
Слайды презентации
Список похожих презентаций
Токсичные химические вещества нейротоксического действия
Виды СДЯВ по клинической картине поражения:. Вещества с преимущественно удушающими свойствами. с выpаженным пpижигающим действием (хлор,трихлористый ...Психоактивные вещества
Психоактивное вещество. Любое вещество (или смесь) естественного или искусственного происхождения, которое влияет на функционирование центральной ...Тема урока: Чистые вещества и смеси. Методы разделения и очистки веществ.
Смесь – это то, что образуется при перемешивании двух и более различных по свойствам веществ. Вещества составляющие смесь называют компонентами. Если ...Обобщение по теме: Органические вещества
1.Углеводород, относящийся к классу алканов, - это. А) C2H4 Б) C3H4 В) C4H10 Г) C7H8. 2. Общая формула алкенов. А) CnH2n - 6 Б) CnH2n - 2 В) CnH2n ...Питательные вещества
Органические макровещества. Белки Углеводы Жиры. Белки. Являются основным строительным материалом организма. Получаем из : молока, сыра, творога, ...Битумные и дёгтевые вяжущие вещества и материалы на их основе
Битумы природные. Различают природный битум, образовавшийся в естественных условиях, и нефтяной битум, который получают при перегонке нефти. Природный ...Обеспечение санитарно-противоэпидемического режима. Понятие о дезинфекции, приготовление растворов
Санитарно - противоэпидемический режим – это комплекс мероприятий, осуществляемый в ЛПУ с целью предупреждения ВБИ и создания оптимальных гигиенических ...Массовая паника
Паника. Па́ника (др.-греч. πανικός — безотчётный ужас, букв. внушаемый богом лесов Паном) — отрицательно окрашенный аффект, вызываемый действительной ...Массовая психика. Особенности толпы
Представление о толпе обычно рождается из личного опыта людей. Практически каждый либо бывал в толпе, либо видел ее поведение со стороны. Иногда, ...Магнезиальные вяжущие вещества
Магнезиальные вяжущие вещества относятся к группе минеральных воздушных вяжущих. Особенность этих порошкообразных материалов состоит в том, что после ...Массовая культура
Массовая культура-это. это культура масс, культура, предназначенная для потребления народом; это сознание не народа, а коммерческой индустрии культуры; ...Лекарственная форма. Вспомогательные вещества используемые в изготовлении ЛФ. Название лекарственных средств.
Лекарственная форма — это придаваемое лекарственному средству удобное для применения состояние (порошок, раствор, мазь, таблетки и т.д.), при котором ...Контрастные вещества применяемые в лучевой диагностике.
Рентгеноконтрастные препараты. применяются для улучшения визуализации внутренних органов и анатомических структур при лучевых методах исследования. ...Взрывчатые вещества
Взрыв. Процесс очень быстрого превращения взрывчатого вещества в большое количество сильно сжатых и нагретых газов, которые, расширяясь, производят ...Токсичные химические вещества цитотоксического действия
Виды СДЯВ по клинической картине поражения:. Вещества с преимущественно удушающими свойствами. с выpаженным пpижигающим действием (хлор,трихлористый ...Минеральные вещества
Что это? Минеральные вещества – это неорганические вещества, которые находятся в пище в виде минеральных солей, органических кислот и других органических ...Эмульсионные взрывчатые вещества
История эмульсионных взрывчатых веществ (ЭВВ) началась в 1961 году, когда Ричард Эгли и Альберт Некар подали заявку на патент в патентное ведомство ...Биологически активные вещества в нашей жизни
Общая характеристика. Препараты, влияющие на центральную и вегетативную нервные системы, характеризуются довольно широким спектром фармакологического ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:13 августа 2019
Категория:Разные
Содержит:13 слайд(ов)
Поделись с друзьями:
Скачать презентацию