Слайд 1Питательные среды для медицинской микробиологии. Методы и техники посевов микроорганизмов
Слайд 2Метаболизм бактерий -
совокупность двух противоположных, но взаимосвязанных процессов — катаболизма, или энергетического метаболизма, и анаболизма, или пластического (конструктивного) метаболизма. У прокариот, так же как у эукариот, в процессе ферментативных катаболических реакций происходит выделение энергии, которая аккумулируется в молекулах АТФ. В процессе ферментативных анаболических реакций эта энергия расходуется на синтез многочисленных макромолекул органических соединений, из которых в конечном итоге строятся составные части микробной клетки.
Слайд 3Типы питания бактерий
Слайд 4Таблица 1 Приблизительный элементарный состав бактериальных клеток (Р. Стейниер, Э. Эдельберг, Дж. Ингрем,1979)
Слайд 5Источники углерода и азота
В микробиологии источником органических веществ являются: 1. Мясной экстракт, настой - продукты специальной обработки мяса животных 2. Пептон – продукт ферментативного (пепсин, трипсин) гидролиза белков мяса 3. Рыбный гидролизат (ГРМ) 4. Дрожжевой автолизат и гидролизат 5. Казеин – фосфорсодержащий белок молока – гидролизат 6. Гидролизаты растительного происхождения (соевый) 7. Другие продукты
Слайд 6Факторы роста бактерий
аминокислоты, пуриновые и пиримидиновые основания, липиды, витамины, железопорфирины (гем) и другие соединения.
Слайд 7Питательные среды. Состав
Натуральные – состоят из продуктов животного или растительного происхождения и имеют неопределенный химический состав. Например: овощные и фруктовые соки, животные ткани, кровь, молоко, яйца и т.д. (МПА, МПБ). Полусинтетические – в состав входят соединения известной химической природы и вещества неопределенного состава. Например: МПБ с глюкозой, среда Эндо, среда Сабуро. Синтетические – содержат только химически чистые соединения в точных концентрациях. Применяют в лабораторных экспериментах. Например: среда Чапека, Омелянского, Ушинского и т.д.

Слайд 8Питательные среды. Назначение
Универсальные (общего назначения)- пригодны для выращивания многих видов микроорганизмов и применяются как основа для специальных питательных сред. Примеры: МПБ, МПА, среда Хоттингера, ГРМ, тиогликолевая среда. Специальные применяют в тех случаях, когда микроорганизмы не растут на простых средах. К ним принадлежит кровяной, сывороточный агар, сывороточный бульон, асцитический бульон, асцит-агар и другие. 1. Элективные среды - на них одни микроорганизмы растут быстрее и более интенсивно, чем другие виды бактерий. Например, 1 % щелочная пептонная вода является элективной средой для холерных вибрионов, среды Ру и Леффлера – для возбудителей дифтерии. 2. Селективные - благодаря селективным добавкам (желчь, краски, антибиотики и др.) способны подавлять развитие одних видов микроорганизмов, но не влияют на другие виды. Примеры: среда Мюллера является селективной для тифо-паратифозных бактерий, фуразолидоно-твиновий агар – для коринебактерий и микрококков. Добавление антибиотиков в состав сред делает их селективными для грибов (напр. среда Сабуро и др.).

Слайд 93. Дифференциально-диагностические - группа сред, которые позволяют определить биохимические свойства микроорганизмов и провести их дифференциацию. Они разделяются на среды для определения протеолитических, пептолитических, сахаролитических, гемолитических, липолитических, редуцирующих свойств (среды Эндо, Левина, Плоскирева, Гисса). 4. Консервирующие (траспортные)- предназначены для сохранения жизнеспособности микроорганизмов от момента взятия биоматериала до посева для диагностики
Среда Левина Среда Плоскирева Среды Гисса

Слайд 10Категории питательных сред по консистенции:
Жидкие (бульоны) – изучение физиолого-биохимических особенностей и накопление биомассы микроорганизмов Полужидкие (1% агара) – хранение культур и культивирование анаэробов Плотные (3-5% агара)– выделение чистых культур, накопление, количественный учет, изучение культуральных свойств, антагонистические взаимоотношения Сыпучие – хранение посевного материала в промышленности (пшено, отруби) Сухие – выпускаются промышленностью для приготовления питательных сред
Слайд 11Уплотнители питательных сред
Роберт Кох предложил использовать желатин для того, чтобы превращать питательный бульон в плотную массу. Недостаток: плавится при Т=250С.
Вальтер Хессе (1846 - 1911)
В. Хессе предложил использовать агар-агара в качестве уплотнителя среды для культивирования микроорганизмов.
Роберт Кох (1843-1910)
Слайд 12Агар-Агар
Водоросли Gracilaria и Gelidium - два основных источника для коммерческого производства агара
Сухие пластинки агар-агара. Плавится при Т=80-1000С, застывает при Т=37-400С
Слайд 13Транспортная система со средой Стюарта
Среда Стюарта представляет собой полужидкий, бедный питательными веществами субстрат для сохранения и транспортировки широкого спектра патогенных микроорганизмов, таких, как Neisseria gonorrhoeae, Haemophilus influenzae, Corynebacterium diphteriae, Trichomonas vaginalis, Streptococcus sp., Salmonella sp., Shigella sp. и др. Наиболее требовательные микроорганизмы сохраняются в данной среде более суток, прочие – до нескольких дней. Наличие в среде тиогликолата подавляет ферментативную активность бактерий, а отсутствие азота предотвращает их размножение.
Натрия тиогликолят 1,00 г/л Натрия глицерофосфат 10,00 Кальция хлорид 0,10 Метиленовый синий 0,002 Агар-агар 3,00 Конечное значение рН (при 25°С) 7,4 ± 0,2

Слайд 14Транспортная система со средой Кери Блэйр
Транспортная среда Кери Блейр представляет собой модификацию базовой транспортной среды Стюарта, предназначенную специально для фекальных образцов. Глицерофосфат, являющийся метаболитом некоторых энтеробактерий (Escherichia coli, Klebsiella pneumoniae, и др.), заменен неорганическим фосфатом, удален метиленовый синий и рН среды увеличена до 8,4. Среда Кери Блейр позволяет сохранять большинство патогенов, включая требовательные микроорганизмы, такие как Neisseria sp., Haemophilus sp., Streptococcus sp. Данная среда является стандартной для транспортировки анаэробов.

Слайд 15Транспортная система со средой Эймса
Транспортная среда Эймса представляет собой очередную модификацию базовой транспортной среды Стюарта, в которой глицерофосфат заменен неорганическим фосфатом, поскольку глицерофосфат является метаболитом некоторых энтеробактерий (Escherichia coli, Klebsiella pneumoniae, ets.) и может поддерживать рост некоторых грамотрицательных микроорганизмов. Метиленовый синий заменен на активированный уголь фармацевтического качества. В среду добавлены кальций и магний для поддержания проницаемости бактериальных клеток. Эта среда способна более 3 дней поддерживать такие микроорганизмы, как Neisseria sp., Haemophilus sp., Corynebacteria, Streptococci, Enterobacteriaceae и др., однако наилучшие результаты дает культивирование в течение первых 24 часов.

Слайд 16Универсальные накопительные среды Мясопептонный агар (МПА) и мясопептонный бульон (МПБ)
Являются основными средами для посевов микроорганизмов, для проверки чистоты культур перед биохимическим и серотипированием. Их используют для культивирования и подсчета неприхотливых микроорганизмов. В полужидком виде среда может быть использована для хранения контрольных (эталонных) микроорганизмов.
Состав (г/л): Пептический перевар животной ткани 5,00 Мясной экстракт 1,50 Дрожжевой экстракт 1,50 Натрия хлорид 5,00 Агар-агар 15,00 Конечное значение рН (при 25°С) 7,4 ± 0,2
Аналог – среда ГРМ (гидролизат рыбной муки)

Слайд 17Универсальные накопительные среды Среда Хоттингера
Предназначен для культивирования различных микроорганизмов, таких как энтеробактерии, синегнойная палочка, стафилококки, некоторые виды стрептококков. При необходимости может быть обогащен углеводами, солями. Содержит гидролизат Хоттингера, который получают путём ферментативного гидролиза мясного фарша (говяжьего) панкреатином с последующим фильтрованием и добавлением хлороформа в качестве консерванта.
Состав (г/л): Ферментативный гидролизат животной ткани 5,00 Фосфат калия 10,0 Натрия хлорид 5,00 Агар-агар 15,00 Конечное значение рН (при 25°С) 7,4 ± 0,2
Слайд 18Универсальные накопительные среды Среда Мюллера-Хинтона
Эту среду используют для культивирования Neisseria sp. и для определения чувствительности микроорганизмов к антимикробным средствам.
Состав (г/л): Мясной настой 300,00 Гидролизат казеина 17,50 Крахмал 1,50 Агар-агар 17,00 Конечное значение рН (при 25°С) 7,3 ± 0,2
Слайд 19Специальные дифференциально-диагностические среды
Предназначены для выявления биохимических особенностей, характерных для данной таксономической группы
Слайд 20
Слайд 21Дифференциально-диагностические среды Среда МакКонки
Среды МакКонки в качестве дифференциальных рекомендуют для селективного выделения энтеробактерий и близких к ним грамотрицательных палочек.
Рост на среде МакКонки (M082) колоний Escherichia coli (крупные красные), Salmonella серовара Typhi (бесцветные), Staphylococcus aureus (мелкие красные) Enterococcus faecalis (точечные)
Основные компоненты среды МакКонки: Питательная основа: Пептический перевар животной ткани, Протеозопептон, Гидролизат казеина, Панкреатический перевар желатина, Лактоза Дифференцирующий фактор Соли желчных кислот (1,5г/л), Натрия хлорид (5г/л) Индикатор Кристаллический фиолетовый, Нейтральный красный
Лактозоположительные штаммы растут с образованием розовых или красных колоний, которые могут быть окружены зоной преципитации желчных солей. Красный цвет появляется в результате закисления среды продуктами разложения лактозы (при падении рН ниже 6,8) и адсорбции нейтрального красного. Штаммы, не ферментирующие лактозу (шигеллы, сальмонеллы), обычно образуют прозрачные бесцветные колонии и не изменяют среду.

Слайд 22Дифференциально-диагностические среды Среда Эндо
Эту среду рекомендуют для выделения и дифференциации грамотрицательных микроорганизмов кишечной группы. Эта среда разработана Endo как культуральная среда для дифференциации микроорганизмов, ферментирующих и неферментирующих лактозу. Она используется для микробиологического исследования воды, стоков, молочных и других пищевых продуктов. Сульфит натрия и основной фуксин обладают подавляющим эффектом на грамположительные микроорганизмы. Лактоза разлагается микроорганизмами до альдегида и кислоты. Альдегид в свою очередь освобождает фуксин из фуксин-сульфитного комплекса, усиливая красное окрашивание колоний. У кишечных палочек эта реакция очень выражена и сопровождается кристаллизацией фуксина, что проявляется зеленоватым металлическим блеском (фуксиновый глянец) колоний.
Состав (г/л): Пептический перевар животной ткани 10,00 Лактоза 10,00 Калия гидрофосфат 3,50 Натрия сульфит 2,50 Фуксин основной 0,50 Агар-агар 15,00 Конечное значение рН (при 25°С) 7,5 ± 0,2
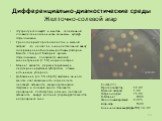
Слайд 23Дифференциально-диагностические среды Желточно-солевой агар
Эту среду используют в качестве селективной для выделения клинически значимых культур стафилококков. Среда содержат протеозопептон и мясной экстракт, что делает ее очень питательной ввиду содержания необходимых ростовых факторов. Вместе с тем рост бактерий, кроме стафилококков, подавляется высокой концентрацией (7,5%) хлорида натрия. Маннит является ферментируемым и дифференцирующим субстратом, а также источником углерода. Добавление (до 5% об/об) эмульсии яичного желтка дает возможность определить липазную активность микроорганизмов. Эмульсия в солевой среде становится прозрачной, поэтому при наличии липазной активности вокруг колоний формируется желтая непрозрачная зона.
Состав (г/л): Протеозопептон 10,00 Мясной экстракт 1,00 Натрия хлорид 75,00 D-Маннит 10,00 Феноловый красный 0,025 Агар-агар 15,00 Конечное значение рН (при 25°С) 7,4 ± 0,2
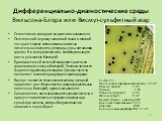
Слайд 24Дифференциально-диагностические среды Вильсона-Блера или Висмут-сульфитный агар
Селективная среда для выделения сальмонелл. Пептический перевар животной ткани и мясной экстракт служат источником азотистых питательных веществ, углерода, серы, витаминов группы В и микроэлементов, необходимых для роста указанных бактерий. Бриллиантовый зеленый подавляет рост всех грамположительных бактерий. Глюкоза является ферментируемым углеводом. Сульфат железа позволяет выявить продукцию сероводорода. Висмут является тяжелым металлом, который подавляет рост большинства грамотрицательных кишечных бактерий, кроме сальмонелл. Сальмонеллы восстанавливают сульфат железа в присутствии глюкозы и сульфита висмута до сульфида железа, который окрашивает их колонии в черный цвет.
Состав (г/л): Пептический перевар животной ткани 10,00 Мясной экстракт 5,00 Глюкоза 5,00 Натрия гидрофосфат 4,00 Железа сульфат 0,30 Висмута сульфит, индикатор 8,00 Бриллиантовый зеленый 0,025 Агар-агар 20,00 Конечное значение рН (при 25°С) 7,7 ± 0,2

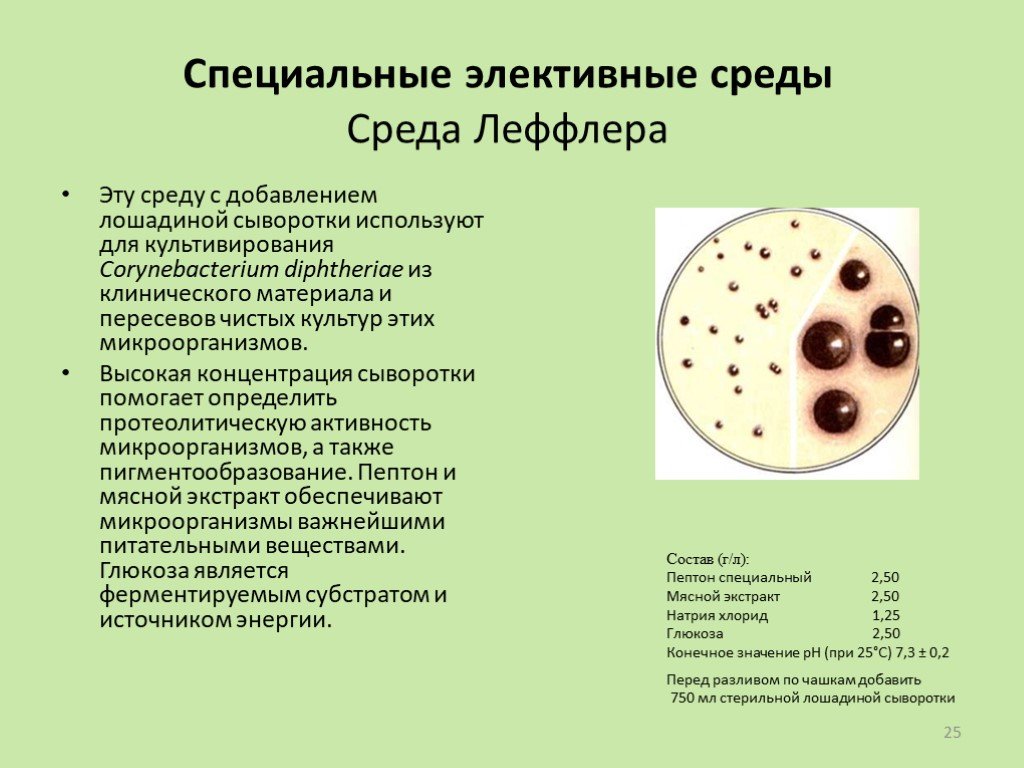
Слайд 25Специальные элективные среды Среда Леффлера
Эту среду с добавлением лошадиной сыворотки используют для культивирования Corynebacterium diphtheriae из клинического материала и пересевов чистых культур этих микроорганизмов. Высокая концентрация сыворотки помогает определить протеолитическую активность микроорганизмов, а также пигментообразование. Пептон и мясной экстракт обеспечивают микроорганизмы важнейшими питательными веществами. Глюкоза является ферментируемым субстратом и источником энергии.
Состав (г/л): Пептон специальный 2,50 Мясной экстракт 2,50 Натрия хлорид 1,25 Глюкоза 2,50 Конечное значение рН (при 25°С) 7,3 ± 0,2
Перед разливом по чашкам добавить 750 мл стерильной лошадиной сыворотки

Слайд 26Специальные селективные среды Кампилобакагар
Селективная среду для кампилобактерий которая состояла из основы кровяного агара с бараньей кровью или лошадиной кровью и антибиотиками . Антимикробные компоненты, существенно подавляют рост нормальной микрофлоры, способствуя росту и выделению из испражнений Campylobacter fetus ssp. jejuni. Присутствие амфотерицина В в добавке существенно или полностью подавляет рост грибов, введенный позже цефалотин усиливает подавление нормальной кишечной микрофлоры . Колонии Campylobacter fetus ssp. jejuni имеют слизистый характер, плоские серые с неправильными очертаниями или приподнятые, округлые, без гемолиза. Некоторые штаммы могут образовывать желто-коричневые или розоватые колонии. На влажной поверхности среды может наблюдаться слияние роста или роение.
Селективная добавка : Полимиксин В 1250 МЕ Ванкомицин 5,0 мг Триметоприм 2,5 мг Амфотерицин В 1,0 мг Цефалотин 7,5 мг
Основа состав (г/л): Протеозопептон 15,00 Печеночный перевар 2,50 Дрожжевой экстракт 5,00 Натрия хлорид 5,00 Агар-агар 12,00 Конечное значение рН (при 25°С) 7,4 ± 0,2
Перед розливом среды в нее добавляют: стерильную лизированную кровь лошади (до 5-7% об/об) или стерильную дефибринированную баранью кровь (до 10%) и селективную добавку для кампилобактеров

Слайд 27Техника посева на питательные среды
Слайд 28Методы выделения чистой культуры
Чистой культурой называют такую культуру, которая содержит микроорганизмы одного вида. Выделение чистых культур бактерий - обязательный этап бактериологического исследования в лабораторной диагностике инфекционных болезней, в изучении микробной загрязненности различных объектов окружающей среды, и, в целом, при любой работе с микроорганизмами. Исследуемый материал (гной, мокрота, фекалии, кровь и другой материал от больных; вода, почва, воздух, пищевые продукты, трупы животных и человека, переносчики) обычно содержит ассоциации микробов. Выделение чистой культуры позволяет изучить морфологические, культуральные, биохимические, антигенные и другие признаки, по совокупности которых определяется видовая и типовая принадлежность возбудителя, то есть производится его идентификация.
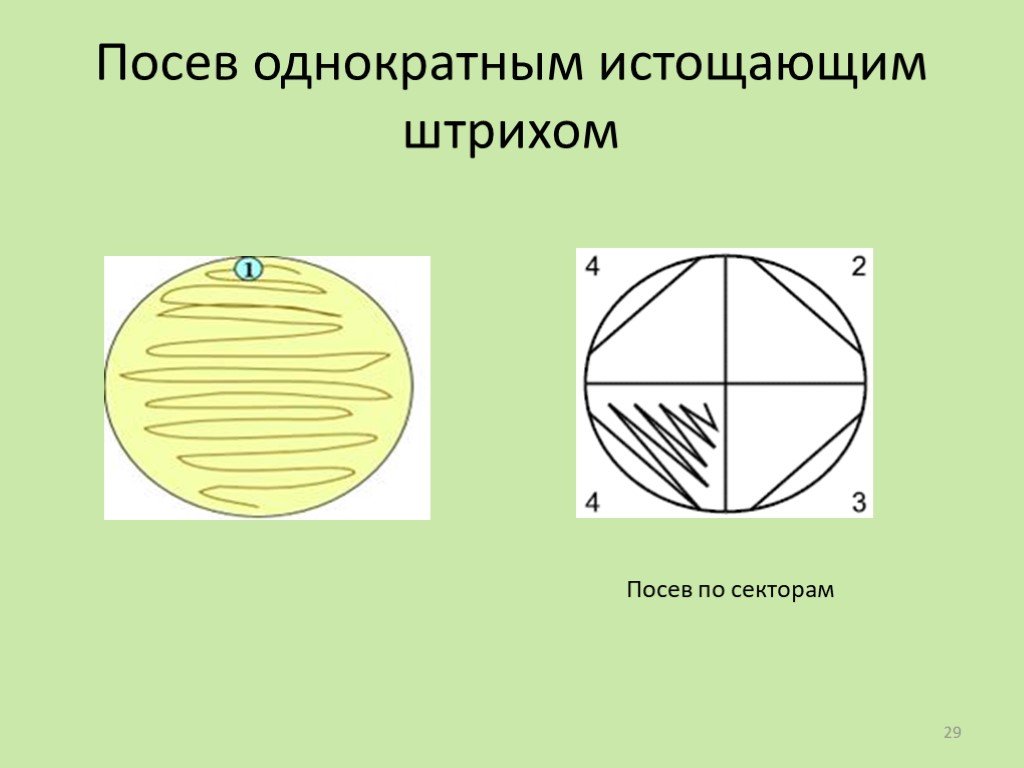
Слайд 29Посев однократным истощающим штрихом
Посев по секторам
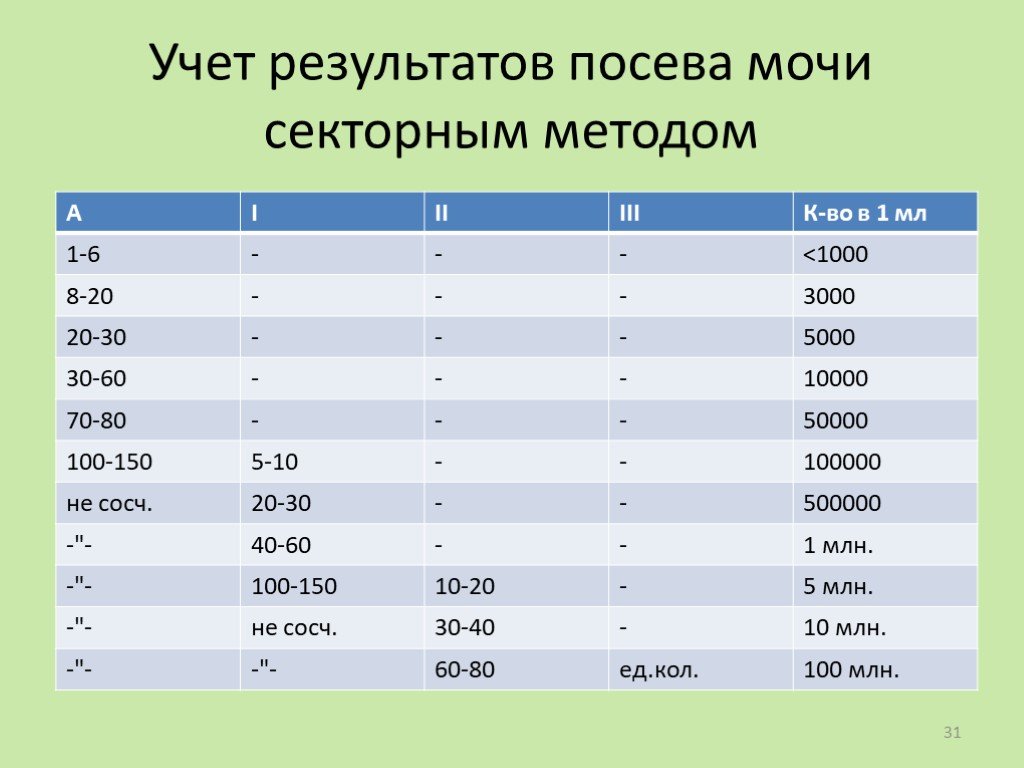
Слайд 30Посев истощающим штрихом секторами
Применяют для определения микробного числа мочи
Слайд 31Учет результатов посева мочи секторным методом
Слайд 32Посев на скошенный агар, метод Шукевича
Место посева культуры по Шукевичу
Посев однократным штрихом
Посев на скошенный агар применяют для накопления и хранения чистой культуры бактерий Метод Шукевича - применяется для получения чистой культуры протея и других микроорганизмов обладающих «ползущим» ростом. Посев исследуемого материала производят в конденсационную воду у основания скошенного агара . Подвижные микроорганизмы (протей) способны подниматься вверх по скошенному агару , неподвижные формы остаются расти внизу на месте посева. Пересевая верхние края культуры можно получить чистую культуру.

Слайд 34Метод Дригальского
0,1мл материала вносят в первую чашку и стерильным стеклянным шпателем распределяют по поверхности среды. Затем этим же шпателем (не прожигая его в пламени горелки) делают такой же посев во второй и третьей чашках. С каждым посевом бактерий на шпателе остается все меньше и меньше и, при посеве на третью чашку, бактерии будут распределяться по поверхности питательной среды отдельно друг от друга. Через 1-7 сут выдерживания чашек в термостате (в зависимости от скорости роста микроорганизмов) на третьей чашке каждая бактерия дает клон клеток, образуя изолированную колонию, которую пересевают на скошенный агар с целью накопления чистой культуры.
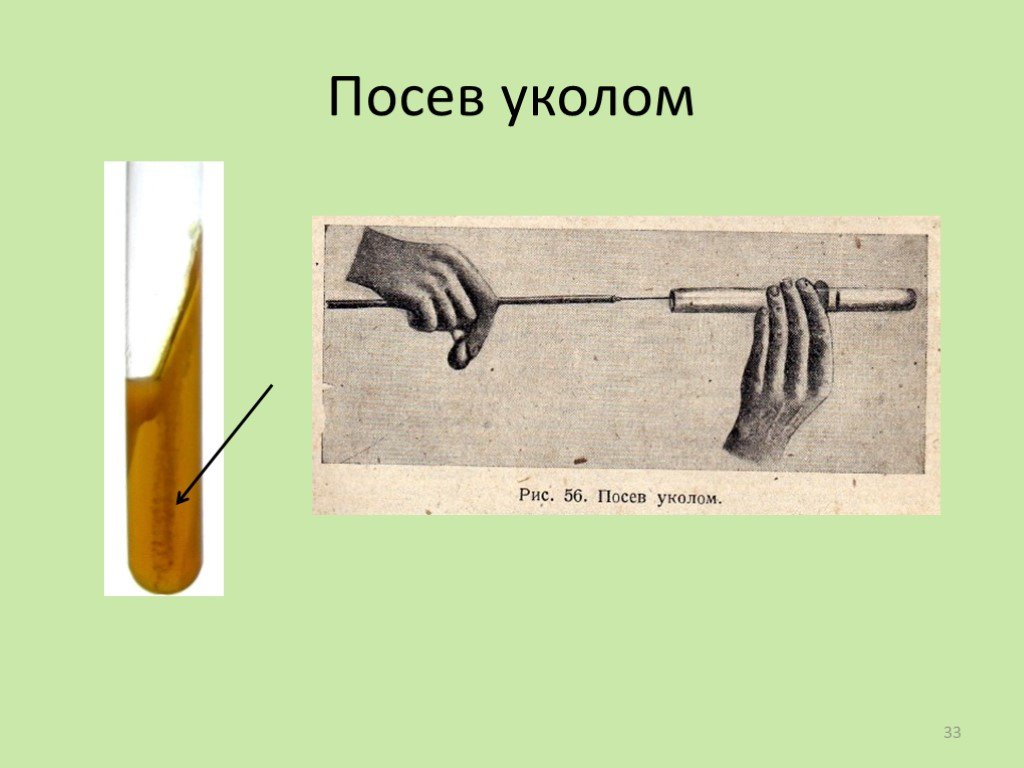
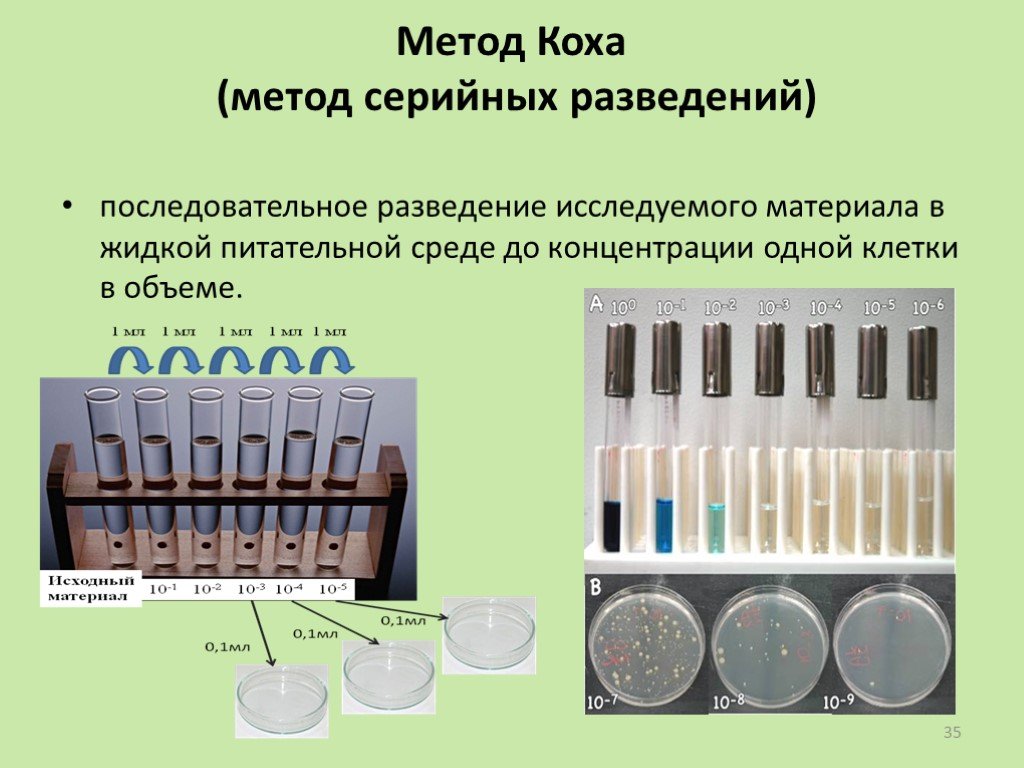
Слайд 35Метод Коха (метод серийных разведений)
последовательное разведение исследуемого материала в жидкой питательной среде до концентрации одной клетки в объеме.
Слайд 36Метод мембранных фильтров
Слайд 37Спасибо за внимание!