Презентация "Производные углеводородов" по химии – проект, доклад
Презентацию на тему "Производные углеводородов" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 30 слайд(ов).
Слайды презентации
Список похожих презентаций
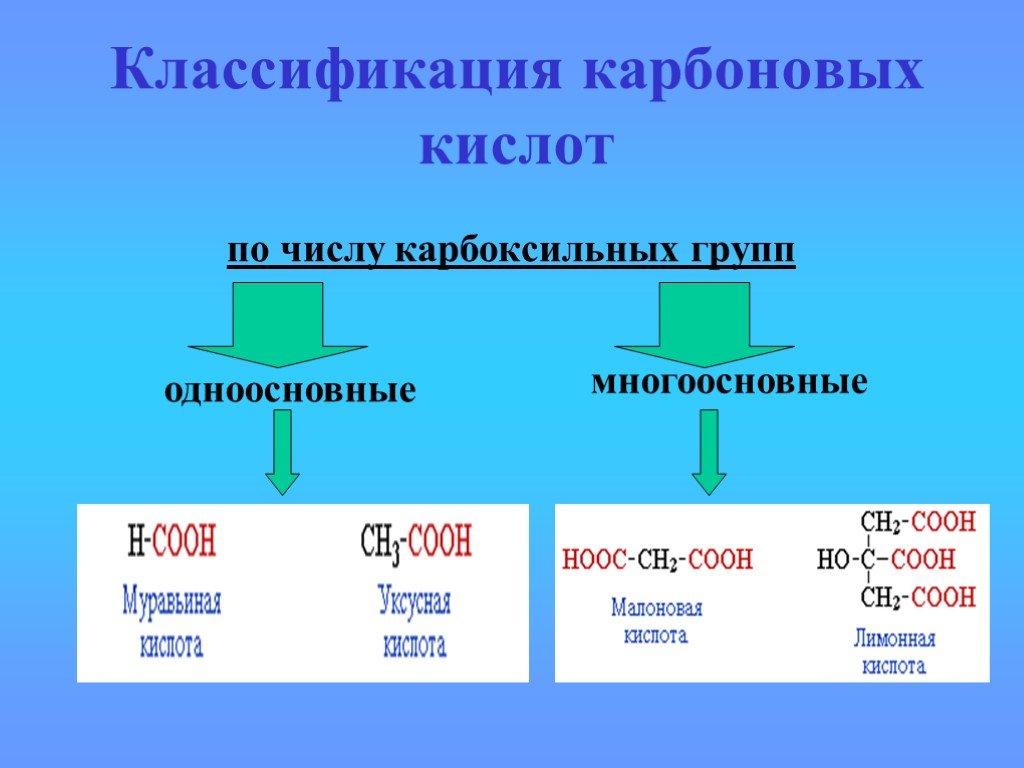
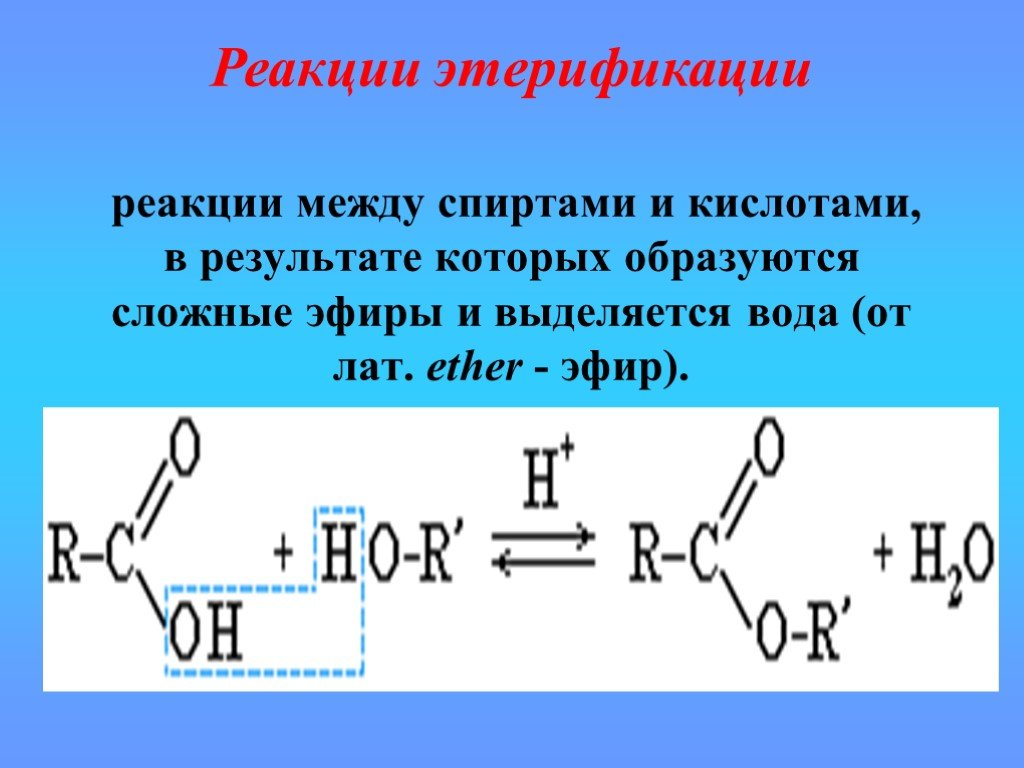
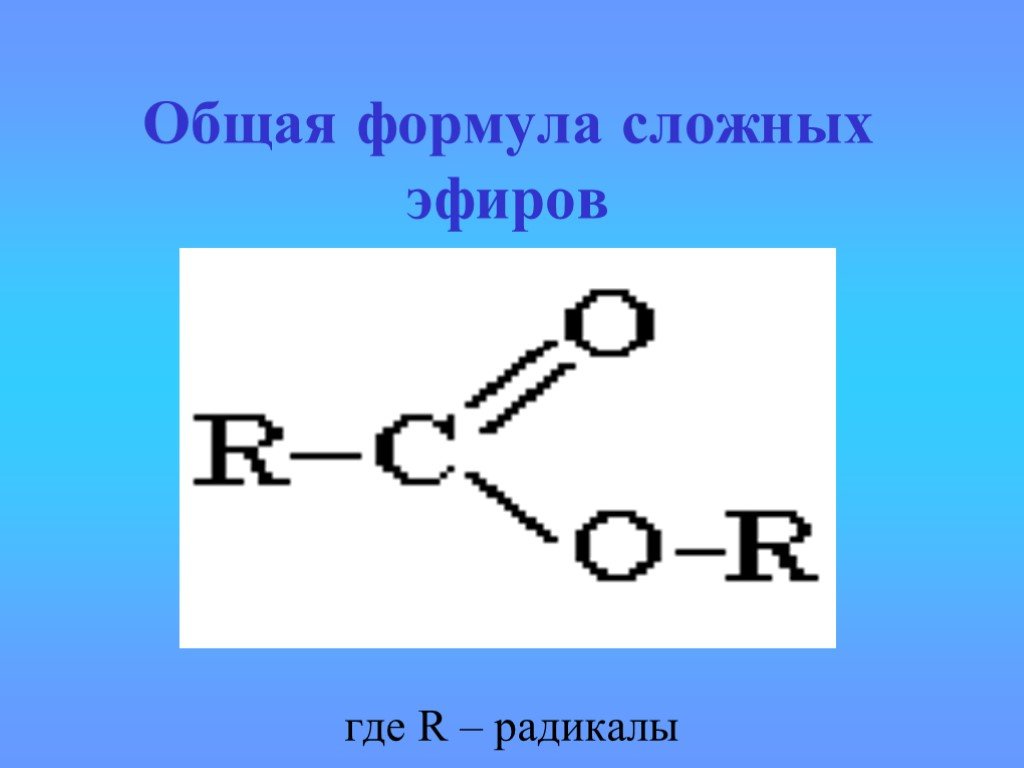
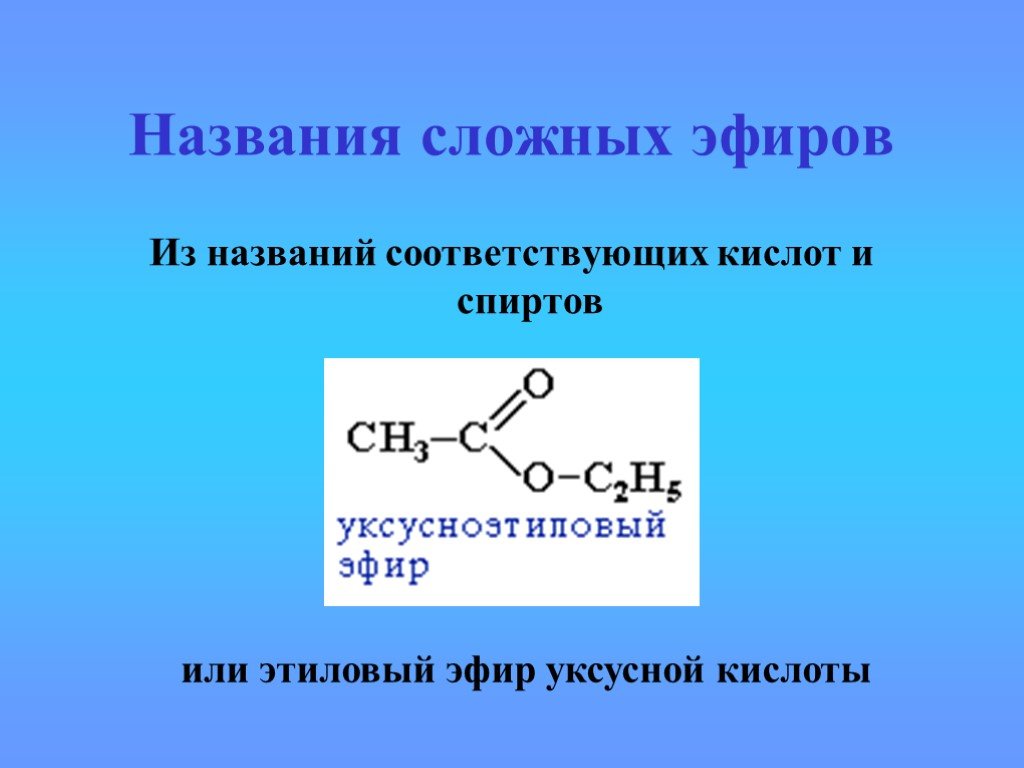
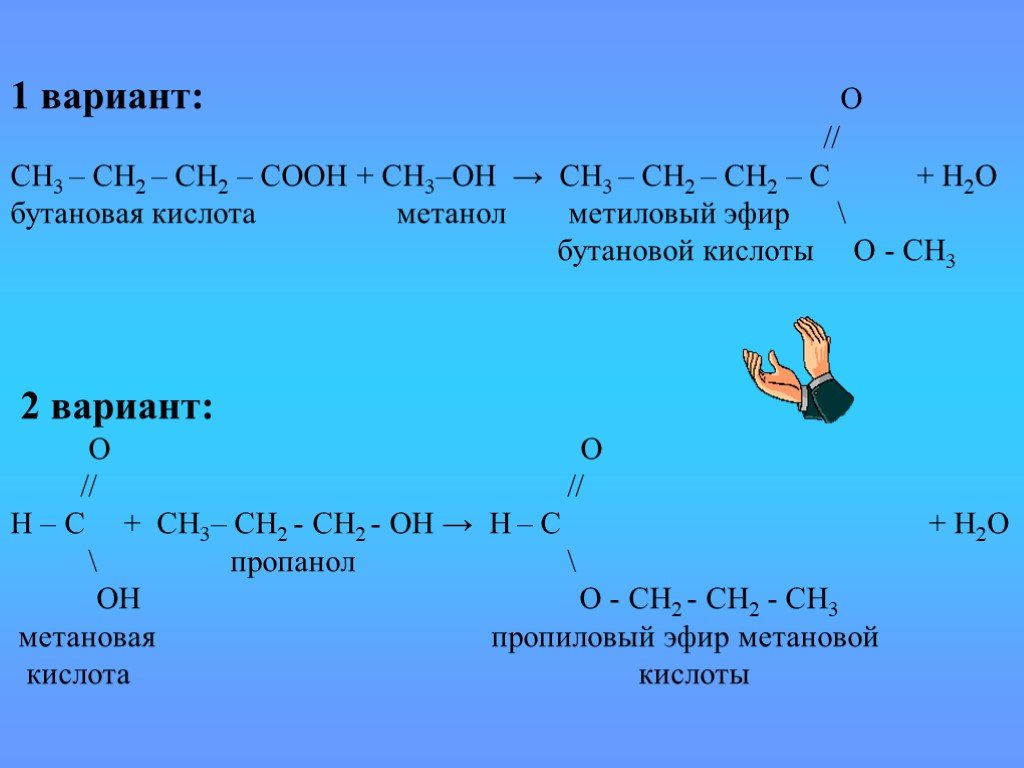
Производные карбоновых кислот
карбоксил карбонил R. Полярная группа или атом. Функциональные производные карбоновой кислоты. Кетон. Углеводородный радикал. Галоген Hal Галоген ...Происхождение углеводородов
Природный и попутный нефтяной газ Нефть Каменный уголь Горный воск Горная смола асфальт. Нефтяные скважины в Нью-Мексико. Портовый город Дубаи является ...Природные источники углеводородов
Содержание. Блиц-опрос Знаете ли вы, что … Природный и попутный нефтяные газы Нефть Первичная переработка нефти Вторичная переработка нефти Коксохимическое ...Природные источники углеводородов и их переработка
Проблемные вопросы:. 1. Кто такие углеводороды? 2. Что объединяет следующие формулы: С2Н2 , С2Н6, С2Н4, С3Н8, СН4. 3.Где можно встретить эти углеводороды? ...Теории происхождения углеводородов
Главными источниками углеводородов являются нефть и природный газ. Основные теории происхождения нефти. Абиогенная (карбидная, неорганическая,минеральная). ...Источники углеводородов
Цели:. Образовательная – познакомить с происхождением нефти и природного газа, методами их переработки, использованием продуктов, получаемых из них. ...Природные источники углеводородов
Нефть Уголь Природный газ. Попутный нефтяной газ. Нефть – маслянистая жидкость от желтого или светло-бурого до черного цвета с характерным запахом. ...Свойства ароматических углеводородов
Физические свойства. Бензол и его ближайшие гомологи – бесцветные жидкости со специфическим запахом. Ароматические углеводороды легче воды и в ней ...Природные источники углеводородов
Наиболее важные источники углеводородов. Источники углеводородов. Природный газ. Попутный нефтяной газ. Нефть Каменный уголь. Характеристика природного ...Природные источники углеводородов
Природные источники углеводородов. Цель: показать значение природных источников углеводородов и продуктов их переработки как источников энергии и ...Применение углеводородов
Цели:. Изучить области применения такого класса углеводородов как алканы; сделать вывод по заданной теме; Предоставить задания для самопроверки. Предельные ...Основные природные источники углеводородов
Нефть Природный газ. Попутный нефтяной газ. Каменный уголь. Добыча и потребление нефти - важный показатель промышленного развития государств; организация ...Многообразие углеводородов
Давайте вспомним, что мы знаем о важнейших классах углеводородов, сравним их строение, физические и химические свойства. Возможно нам удастся: увидеть ...Путешествие в мир углеводородов нефти
«МОРЕ ФАКТОВ». Нефть - это черное золото планеты, чудесный дар природы. Человек познакомился с нефтью еще за 5-6 тыс. лет до н. э. «нафата »- просачиваться. ...Природные источники углеводородов
Природный газ. Важнейшие месторождения газа. Состав природного газа. ЭФФЕКТИВНОЕ И ДЕШЁВОЕ ТОПЛИВО ИСТОЧНИК СЫРЬЯ ДЛЯ ХИМИЧЕСКОЙ ПРОМЫШЛЕННОСТИ. Применение ...Ряд предельных углеводородов
Цель урока:. рассмотреть гомологический ряд предельных УВ, строение молекул алканов. ознакомить учащихся с изомерией предельных УВ. физическими свойствами ...Природные источники углеводородов
Основными источниками углеводородов являются газообразные вещества – горючие природные и попутные газы, газы переработки нефти и каменного угля. Сравнительная ...Строение и свойства предельных и непредельных углеводородов
Разминка. I I Вариант. 1.Углеводороды, содержащие. только простые связи. 2.Вещесва, сходные по строению, но отличающие на одну или несколько групп ...Природные источники углеводородов
Уголь. Это твердое горючее полезное ископаемое растительного происхождения. Каменный уголь. Наибольшие запасы (более 90%) сосредоточены в Северном ...Химические свойства предельных углеводородов
Алканы CnH2n+2. Химические свойства. 1. Реакции замещения: CH₄ + Cl₂ → CH₃Cl + HCl Реакции протекают по радикальному механизму. 3.Реакции дегидрирования: ...Конспекты
Свойства углеводородов
9. . . Серебрянская Нелля Александровна. Учитель МОУ «Образцовская СОШ». Фроловского муниципального района. Волгоградской области. Аннотация ...Природные источники углеводородов и их переработка
Урок-конференция . в 10 классе. Тема: «Природные источники углеводородов и их переработка». Учитель химии Муниципального автономного общеобразовательного ...Распространение углеводородов в природе
Тема:. . Распространение углеводородов в природе. Цель:. изучить многообразие углеводородов в природе, их распространение в РК, применение;. ...Природные источники углеводородов
Учитель химии и биологии: Ли М. Н. 11 класс. Тема урока:. Природные источники углеводородов. . . Цели и задачи урока:. . Образовательные:. ...Природные источники углеводородов
. Комитет по образованию. . администрации. муниципального образования г. Ноябрьск. Муниципальное общеобразовательное учреждение. «Средняя общеобразовательная ...Природные источники углеводородов
Конспект урока по химии в 10 классе по теме: «Природные источники углеводородов». Цель урока:. Знакомство учащихся с природными источниками углеводородов, ...Природные источники углеводородов
Муниципальное бюджетное образовательное учреждение. «Вечерняя (сменная) общеобразовательная школа №1». Рузаевского муниципального района. ...Предельные углеводороды. Метан – представитель насыщенных углеводородов
Разработка урока по органической химии в 9 классе с рефлективным отчетом. Составитель: учитель химии Рысмухамбетова М.Д. г.Костанай. ГУ «Основная ...Общая характеристика предельных углеводородов
Министерство образования Республики Карелия. ГАПОУ РК «Сортавальский колледж». МЕТОДИЧЕСКАЯ РАЗРАБОТКА УРОКА. Общая характеристика ...Гомологические ряды, изомерия и номенклатура углеводородов
Серебрянская Нелля Александровна,. учитель МОУ «Образцовская СОШ». Фроловского муниципального района. Волгоградской области. Гомологические ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:27 октября 2018
Категория:Химия
Содержит:30 слайд(ов)
Поделись с друзьями:
Скачать презентацию