Презентация "Сероводород" по химии – проект, доклад
Презентацию на тему "Сероводород" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 8 слайд(ов).
Слайды презентации
Список похожих презентаций
Элемент водород
Содержание. Строение атома. История открытия и названия. Нахождение в природе. Элемент космоса. Физические свойства. Химические свойства. Получение. ...Химический элемент - водород
Краткая характеристика элемента. H 1 1,00794 1s1 Водород. Водоро́д — первый элемент периодической системы элементов. Широко распространён в природе. ...Химический элемент водород
Цели и задачи урока. повторить и закрепить знания, умения и навыки по теме «Свойства водорода и кислот. Формулы солей»; продолжить формирование познавательных ...Кислород и водород
повторить физические и химические свойства водорода и кислорода, распространение их в природе вспомнить уравнения горения простых и сложных веществ ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:14 сентября 2014
Категория:Химия
Автор презентации:Зорин Сергей, Шакенов Серик, Югай Дмитрий, Огай Артём
Содержит:8 слайд(ов)
Поделись с друзьями:
Скачать презентацию



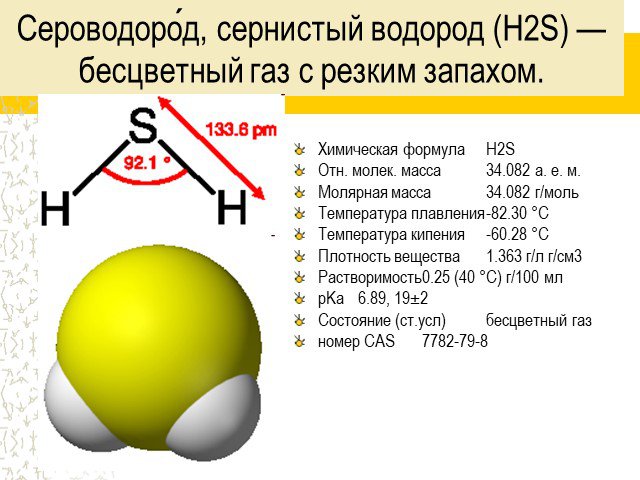











![Токсикология. Очень токсичен. При высокой концентрации однократное вдыхание может вызвать мгновенную смерть. При небольших концентрациях довольно быстро возникает адаптация к неприятному запаху «тухлых яиц», и он перестаёт ощущаться. Во рту возникает сладковатый металлический привкус [2] При большой Токсикология. Очень токсичен. При высокой концентрации однократное вдыхание может вызвать мгновенную смерть. При небольших концентрациях довольно быстро возникает адаптация к неприятному запаху «тухлых яиц», и он перестаёт ощущаться. Во рту возникает сладковатый металлический привкус [2] При большой](https://prezentacii.org/upload/cloud/14/09/4735/images/thumbs/screen8.jpg)













