Презентация "Ток в растворах" по физике – проект, доклад
Презентацию на тему "Ток в растворах" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 15 слайд(ов).
Слайды презентации
Список похожих презентаций
Электрический ток в растворах и расплавах электролитов
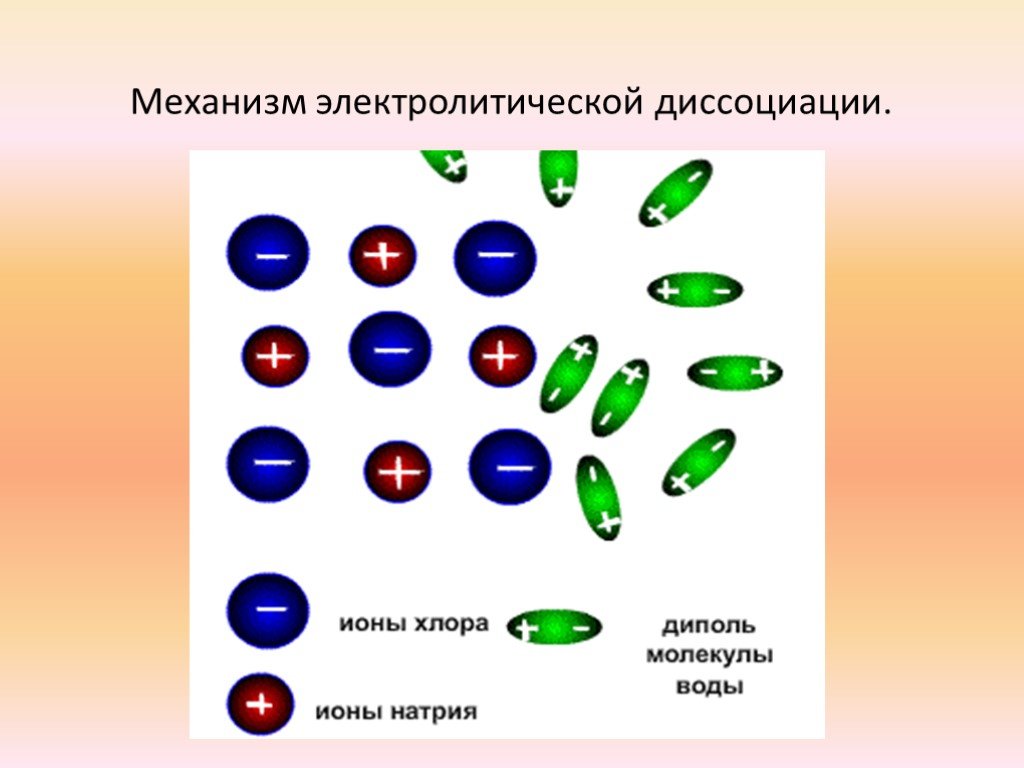
Электролиты. вещества, растворы и расплавы которых обладают ионной проводимостью. Na+ Cl- NaCl H2O. . . Электролитическая диссоциация. расщепление ...Ток в различных средах
Содержание. Ток в металлах Ток в вакууме Ток в газах ( плазме ) Ток в электролитах Ток в полупроводниках. Ток в металлах ИОНЫ ЭЛЕКТРОНЫ. Процесс испускания ...Ток в металлах и электролитах
Проверка домашнего задания. 1. Фронтальный опрос. 2. Тестирование по теме: «Постоянный ток. Законы постоянного тока. Сила тока. Условия, необходимые ...Ток в жидкостях. Электролиз
По способности переносить заряд жидкости можно разделить на. Жидкие проводники. Жидкие диэлектрики. Жидкости с ионным и ионноэлектронным механизмом ...Ток в вакууме
@ Краснополянская школа № 1 Домнин Константин Михайлович 2006 год. Электрический ток в вакууме. Электрический ток в различных средах. ВОПРОСЫ:. Вакуум. ...Ом Ток
Содержание:. Роль физики в жизни человека (3 слайд) Сведения об характеристиках электрического тока(4 -8 слайды) Гипотезы(8 слайд) Закон Ома(9-12 ...«Оптические приборы» физика
Содержание. 1.Телескоп 2.Строение телескопа 3.Разновидности телескопов 4.Рефлекторы 5.Использование телескопов 6.Микроскоп 7.Создание микроскопа 8.Использование ...Свет физика
В конце XVII века почти одновременно возникли две, казалось бы взаимоисключающие теории света. Они опирались на два возможных способа передачи действия ...Статистическая физика и термодинамика
На первый взгляд кажется, что изучение свойств любого макроскопического тела может быть сведено к решению механической задачи – нужно проследить за ...Поверхностное натяжение физика
Выдуйте мыльный пузырь и смотрите на него. Вы можете заниматься всю жизнь его изучением, не переставая извлекать из него уроки физики. Лорд Кельвин. ...Радиационная физика
Часть 2: Радиационная Физика. ЦЕЛЬ. Знакомство с основами радиационной физики, дозиметрическими величинами и единицами, необходимых для выполнения ...Молекулярная физика и термодинамика
Молекулярно-кинетическая теория. Молекулярно-кинетической теорией называют учение о строении и свойствах вещества на основе представления о существовании ...Мы и физика
Три закона КВНодинамики. 1 закон: Физика+Юмор=сопst. Чем больше физики, тем меньше юмора, и наоборот. 2 закон: в замкнутой системе зала, когда игрок ...Механическая работа физика
Значения слова «работа». обозначение профессии обозначение характера деятельности характеристика состояния оценка результатов труда характеристика ...Квантовая физика
Узнать основные свойства элементарных частиц. Рассмотреть изотопы водорода. Рассмотреть законы микромира. Рассмотреть с механизм ядерных реакций на ...«МКТ» физика
Содержание. Молекулярная физика Основы молекулярно-кинетической теории строения вещества (МКТ) Температура и внутренняя энергия тела Характеристика ...«Механические волны» физика
Цель исследования: установить с научной точки зрения, что такое звук. Задачи исследования: 1. Изучить физическую теорию звука. 2. Исследовать историю ...«Давление твёрдых тел» физика
Физический диктант. Обозначение площади – Единица площади – Площадь прямоугольника – Обозначение силы – Единица силы – Формула силы тяжести – Обозначение ...Компьютер и физика
Этапы внедрения компьютерных технологий в процесс обучения физике:. I этап — первоначальное накопление опыта: стихийные эксперименты, появление отдельных ...«Световые волны» физика
Оглавление:. Принцип Гюйгенса Закон отражения света Закон преломления света Полное отражение Линза Расчёт увеличения линзы Дисперсия света Интерференция ...Конспекты
Электрический ток в растворах и расплавах электролитов
Урок в 10 «А» классе. по теме: «Электрический ток в растворах и расплавах электролитов». Учитель: Сафронова Е.Г. Цель урока:. Дать ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:13 июня 2019
Категория:Физика
Содержит:15 слайд(ов)
Поделись с друзьями:
Скачать презентацию