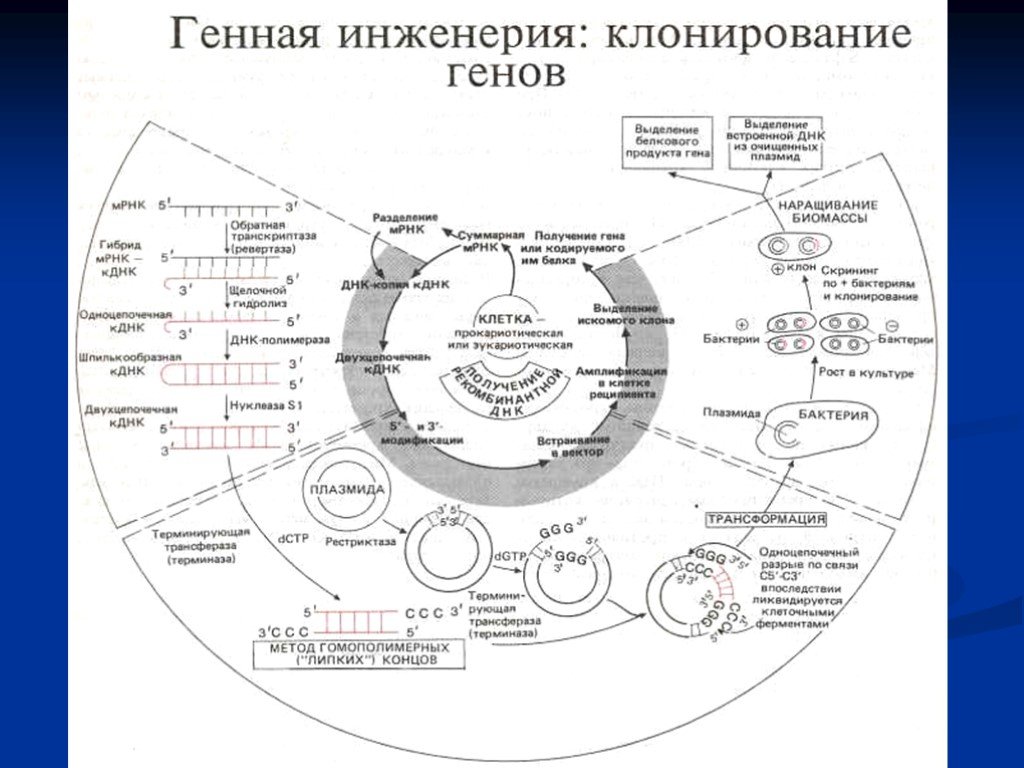
Слайд 1Биотехнология и генетическая инженерия
Слайд 2Биотехнология – совокупность методов естественных и инженерных наук, использующих свойства биологических систем различного уровня организации в технологических процессах.
Слайд 3Генетической инженерией называют прикладную молекулярную и клеточную генетику, разрабатывающую приемы экспериментального вмешательства, позволяющие по заранее намеченному плану перестраивать геном организмов, изменяя содержащуюся в нем наследственную (генетическую) информацию. В понятие генетической инженерии не включают перестройку геномов обычными генетическими методами, т.е. искусственным вызыванием мутаций и получением рекомбинаций путем скрещивания.
Слайд 4Разделы биотехнологии:
Генетическая инженерия – технологии основаны на получении гибридных молекул ДНК и введении их в клетки бактерий, растений и животных. Клеточная инженерия – технологии основаны на возможности выращивания тканей и клеток in vitro, слиянии соматических клеток или их протопластов. Биологическая инженерия – технологии основаны на изучении биологических особенностей клеток и внедрении компьютерных методов контроля технологических режимов, позволяющих максимально реализовывать полезные свойства клеток.

Слайд 5К генетической инженерии принято относить следующие операции:
1. синтез генов вне организма; 2. выделение из клеток отдельных генов или генетических структур (фрагментов хромосом, целых хромосом или даже целых клеточных ядер); 3. направленную перестройку выделенных структур; 4. копирование и размножение выделенных или синтезированных генов или генетических структур; 5. перенос и включение таких генов или генетических структур в подлежащий изменению геном; 6. экспериментальное соединение разных геномов в одной клетке.

Слайд 7Ферменты, используемые в генной инженерии.
Рестриктазы (рестрикционные нуклеазы) – ферменты, способные узнавать специфические последовательности ДНК (4-6 нуклеотидов) и расщепляющие их в строго определённых местах. Ревертаза (РНК-зависимая ДНК-полимераза) – фермент, синтезирующий ДНК по матрице РНК. Нуклеазы – большой класс ферментов, расщепляющих молекулы нуклеиновых кислот; имеются нуклеазы, расщепляющие одно- или двуцепочечные ДНК или РНК путём отщепления по одному нуклеотиду или небольших олигонуклеотидов. Терминальная трансфераза – наращивает на концах фрагментов ДНК однонитевые участки путём последовательного присоединения нуклеотидов; используется для создания на соединяемых фрагментах ДНК «липких» концов.
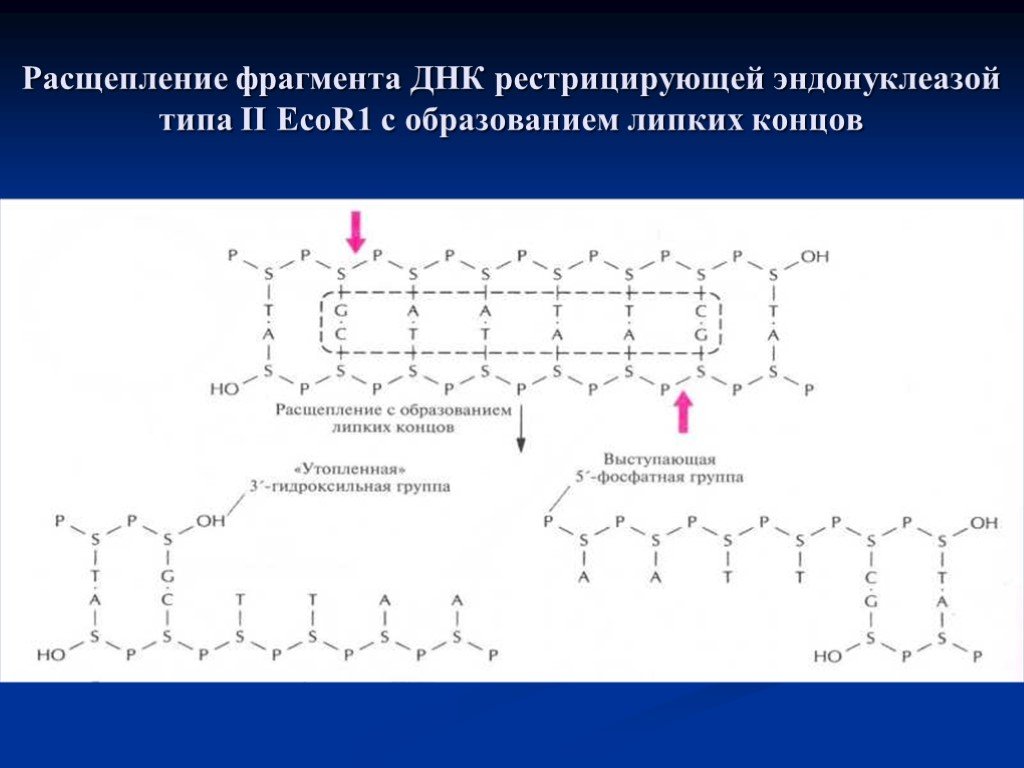
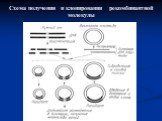
Слайд 8Расщепление фрагмента ДНК рестрицирующей эндонуклеазой типа II EcoR1 с образованием липких концов
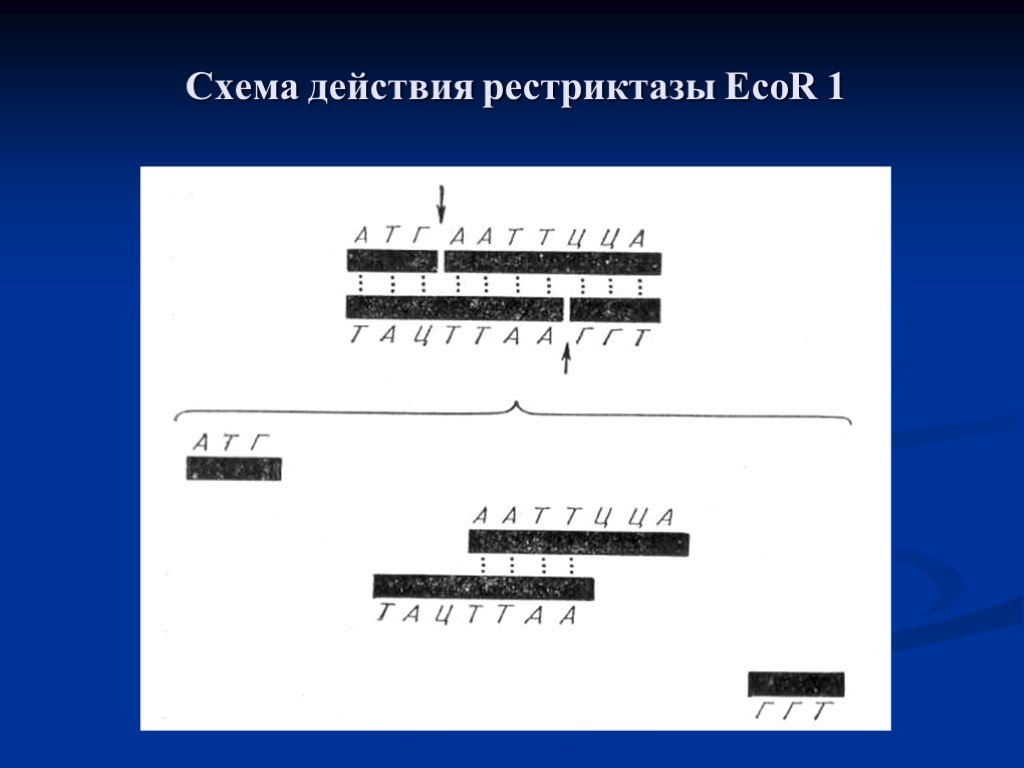
Слайд 9Схема действия рестриктазы EcoR 1
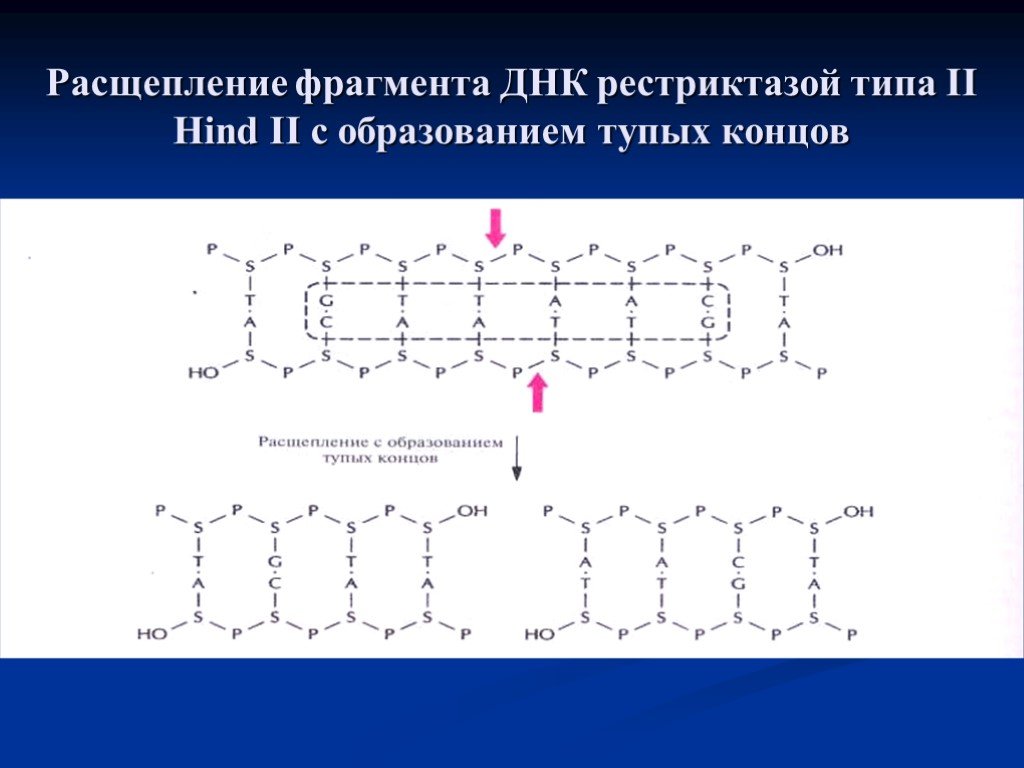
Слайд 10Расщепление фрагмента ДНК рестриктазой типа II Hind II с образованием тупых концов
Слайд 11Нуклеотидные последовательности, распознаваемые некоторыми ферментами рестрикции
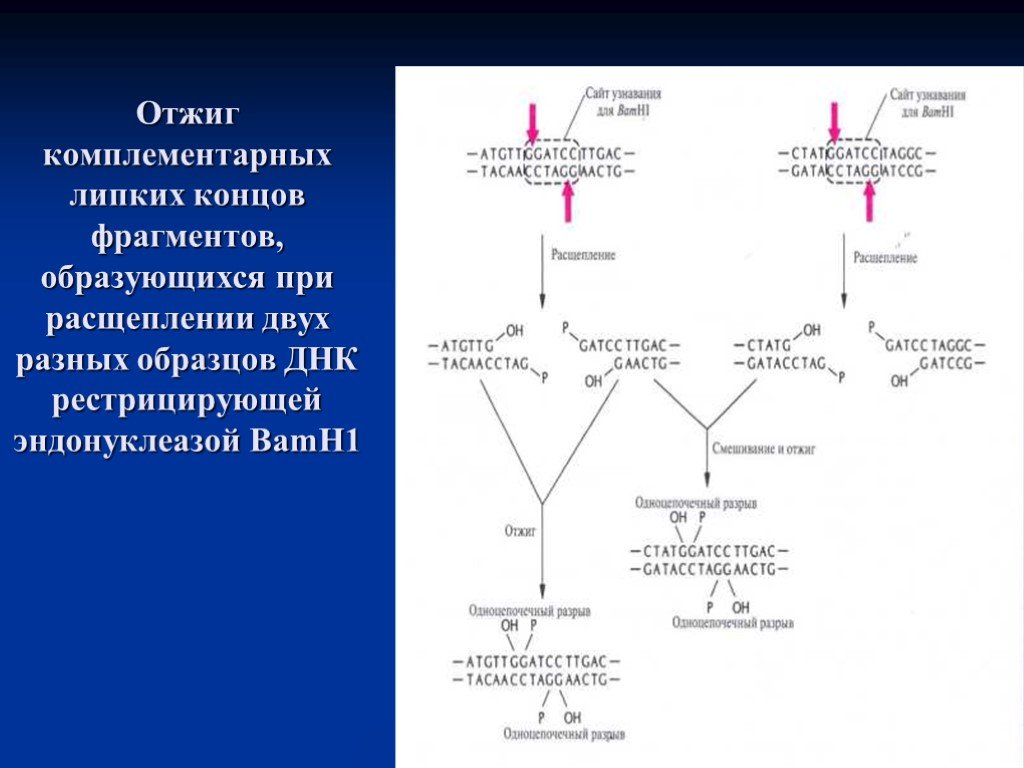
Слайд 12Отжиг комплементарных липких концов фрагментов, образующихся при расщеплении двух разных образцов ДНК рестрицирующей эндонуклеазой BamH1
Слайд 13Синтез и выделение фрагментов ДНК
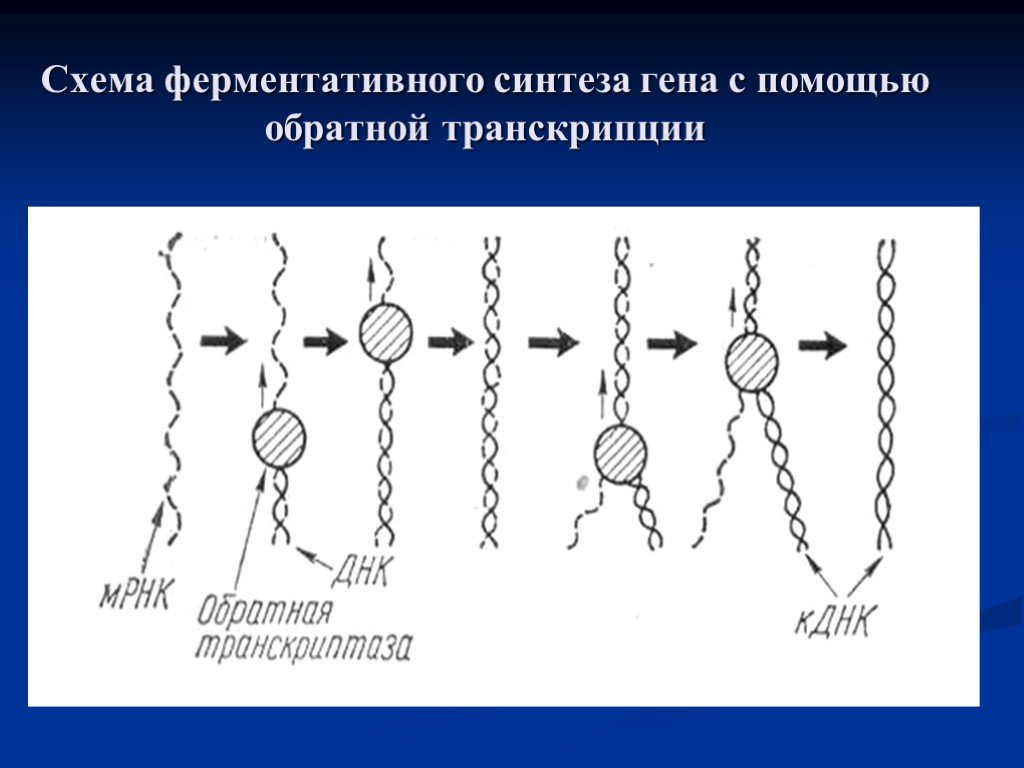
Слайд 14Схема ферментативного синтеза гена с помощью обратной транскрипции
Слайд 15Структура химически синтезированного Хораной функционально активного отрезка ДНК кишечной палочки
Цифры – нумерация нуклеотидов: промотор от -52 до -1 ген супрессорной тирозиновой тРНК от 1 до 125 терминатор от 127 до 146 на концах отрезка тетрануклеотиды ААТТ и ТТАА
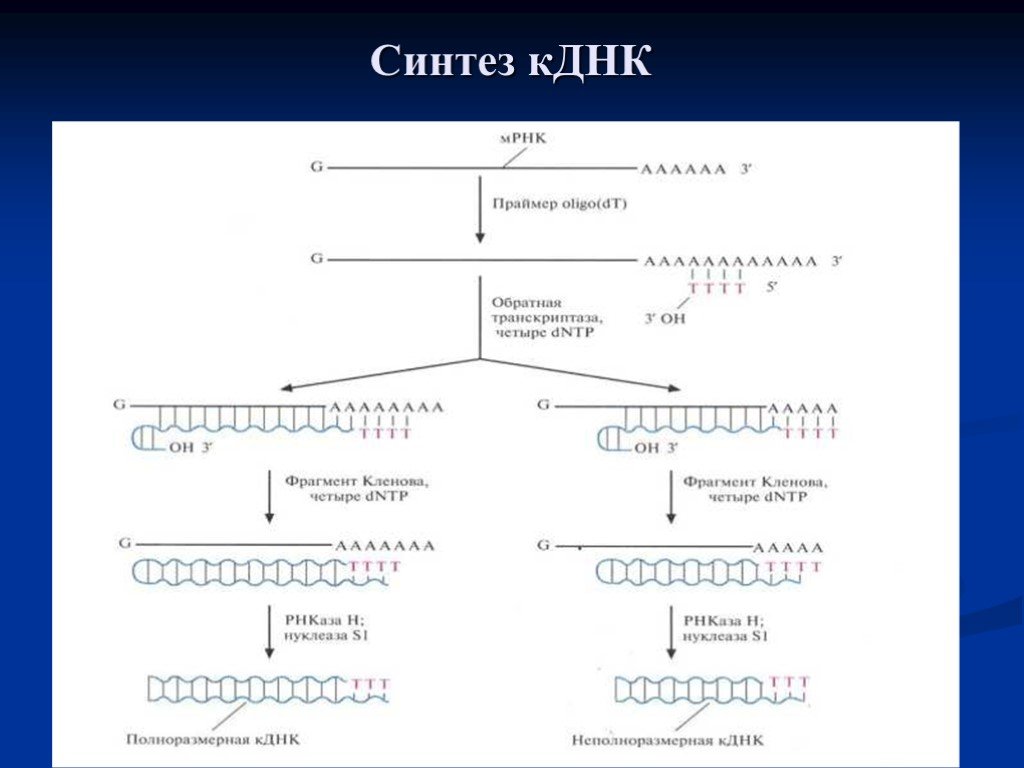
Слайд 16Синтез кДНК
Синтез кДНК. К препарату очищенной мРНК добавляют праймер oligo(dT). Для синтеза ДНК на РНК-матрице используют фермент обратную транскриптазу и четыре dNTP. In vitro обратная транскриптаза не обеспечивает синтез полноразмерных кДНК-копий на всех матрицах и образует на конце растущей цепи шпильку со свободной 3'-ОН-группой. Эта группа инициирует синтез второй цепи ДНК при участии фрагмента Клёнова. После завершения синтеза молекулы мРНК гидролизуют РНКазойН, а ДНК обрабатывают нуклеазой S1, в результате чего получаются линейные молекулы ДНК с тупыми концами без шпилек.
Слайд 17
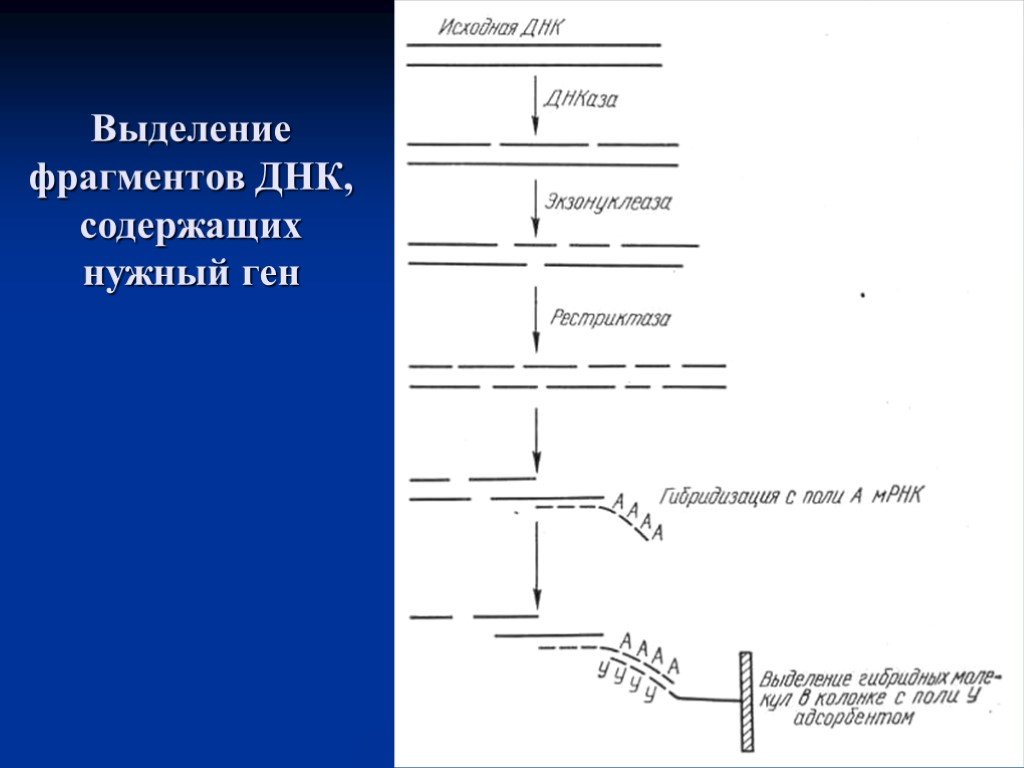
Слайд 18Выделение фрагментов ДНК, содержащих нужный ген
Слайд 19Векторы в генной инженерии.
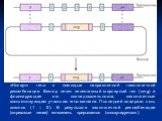
Для осуществления трансгеноза (введения чужеродных генов в клетку реципиента) используются вектоы (переносчики). Векторы – это своеобразные молекулярные такси способные самостоятельно проникать в клетку-мишень, встраиваться в ДНК и в ней реплицироваться. В качестве векторов используют ДНК фага или бактериальные плазмиды.
Слайд 20Генетическая карта плазмидного вектора pBR322
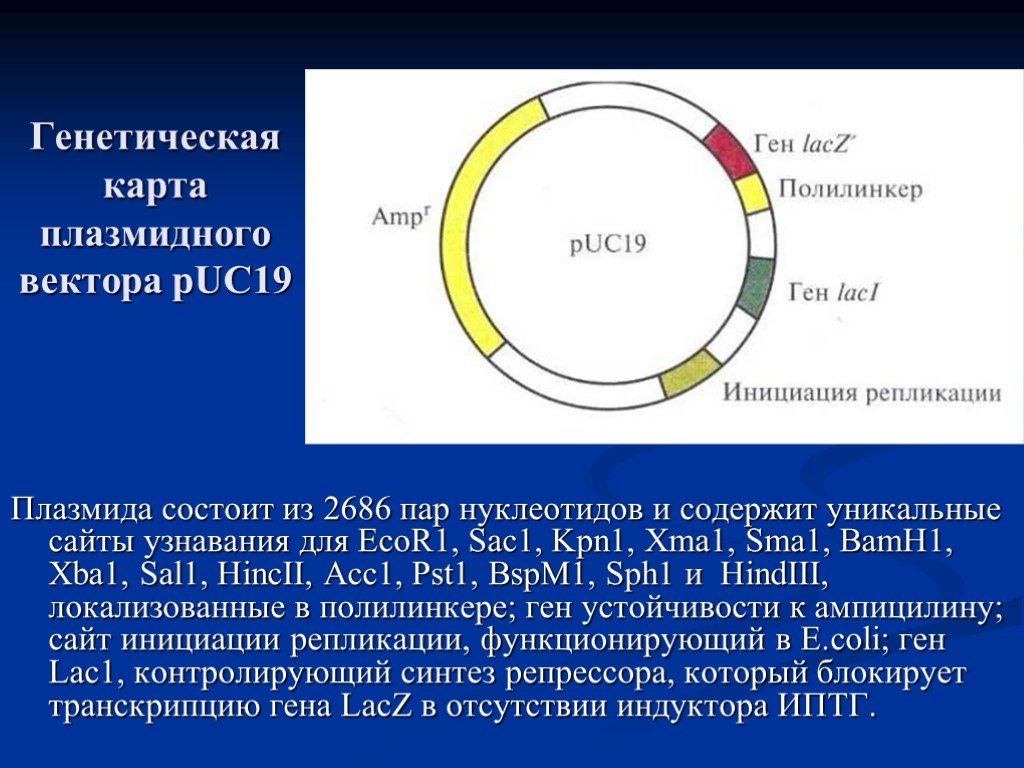
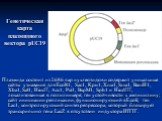
Слайд 21Генетическая карта плазмидного вектора pUC19
Плазмида состоит из 2686 пар нуклеотидов и содержит уникальные сайты узнавания для EcoR1, Sac1, Kpn1, Xma1, Sma1, BamH1, Xba1, Sal1, HincII, Acc1, Pst1, BspM1, Sph1 и HindIII, локализованные в полилинкере; ген устойчивости к ампицилину; сайт инициации репликации, функционирующий в E.coli; ген Lac1, контролирующий синтез репрессора, который блокирует транскрипцию гена LacZ в отсутствии индуктора ИПТГ.
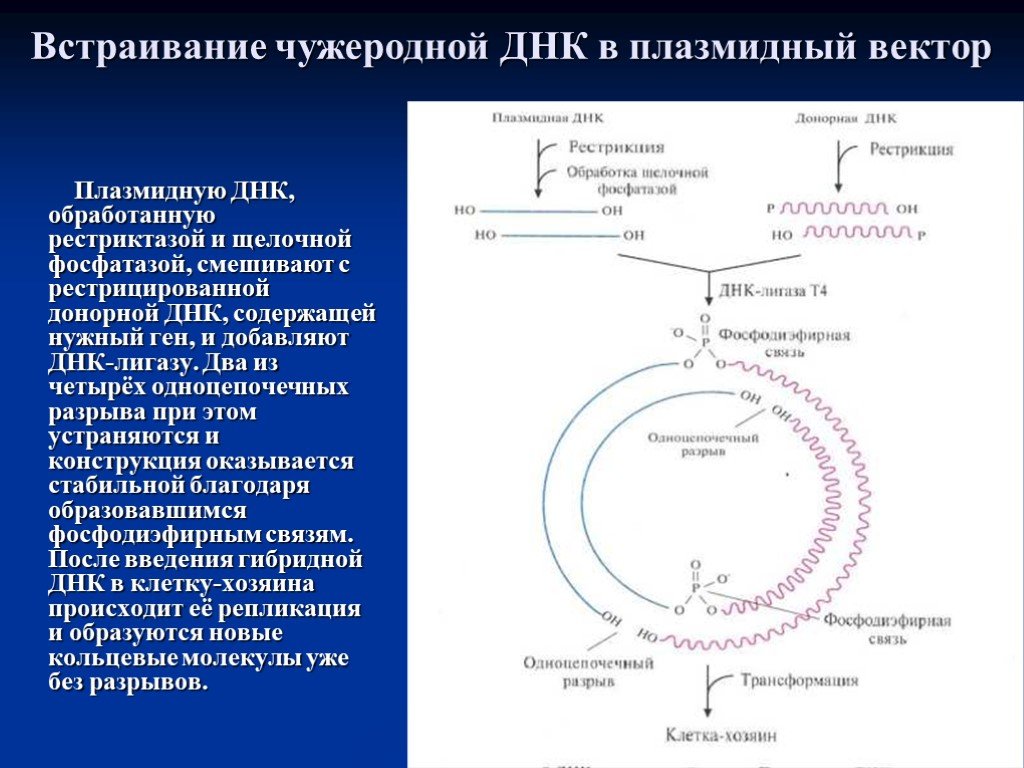
Слайд 22Встраивание чужеродной ДНК в плазмидный вектор
Плазмидную ДНК, обработанную рестриктазой и щелочной фосфатазой, смешивают с рестрицированной донорной ДНК, содержащей нужный ген, и добавляют ДНК-лигазу. Два из четырёх одноцепочечных разрыва при этом устраняются и конструкция оказывается стабильной благодаря образовавшимся фосфодиэфирным связям. После введения гибридной ДНК в клетку-хозяина происходит её репликация и образуются новые кольцевые молекулы уже без разрывов.
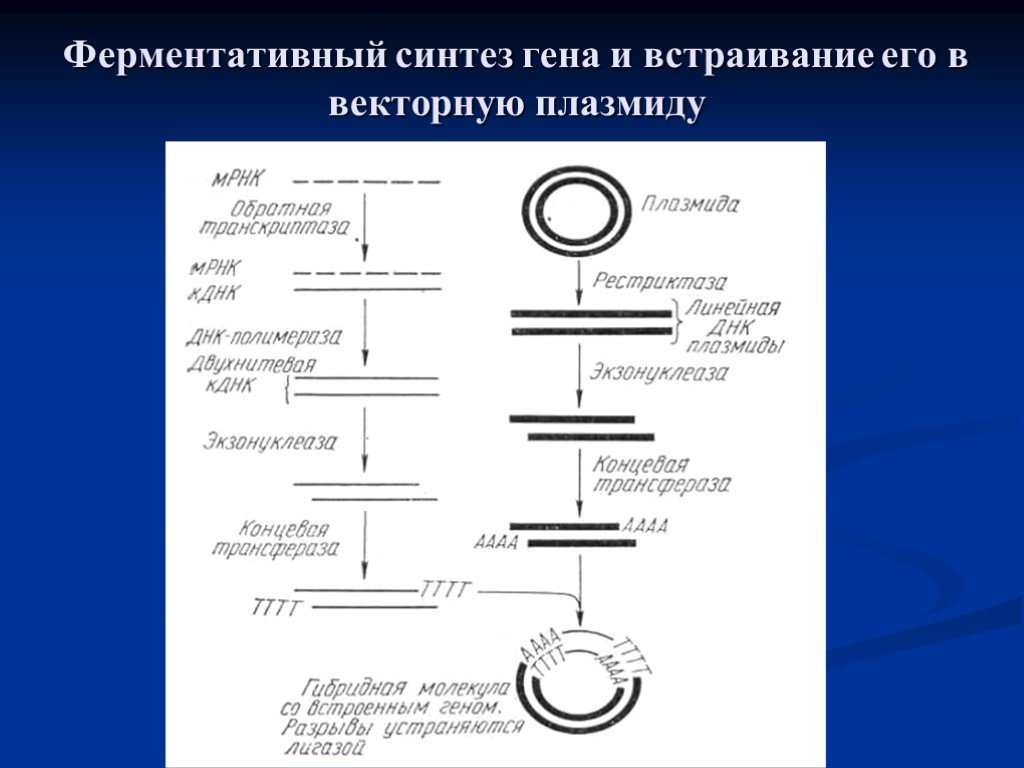
Слайд 23Ферментативный синтез гена и встраивание его в векторную плазмиду
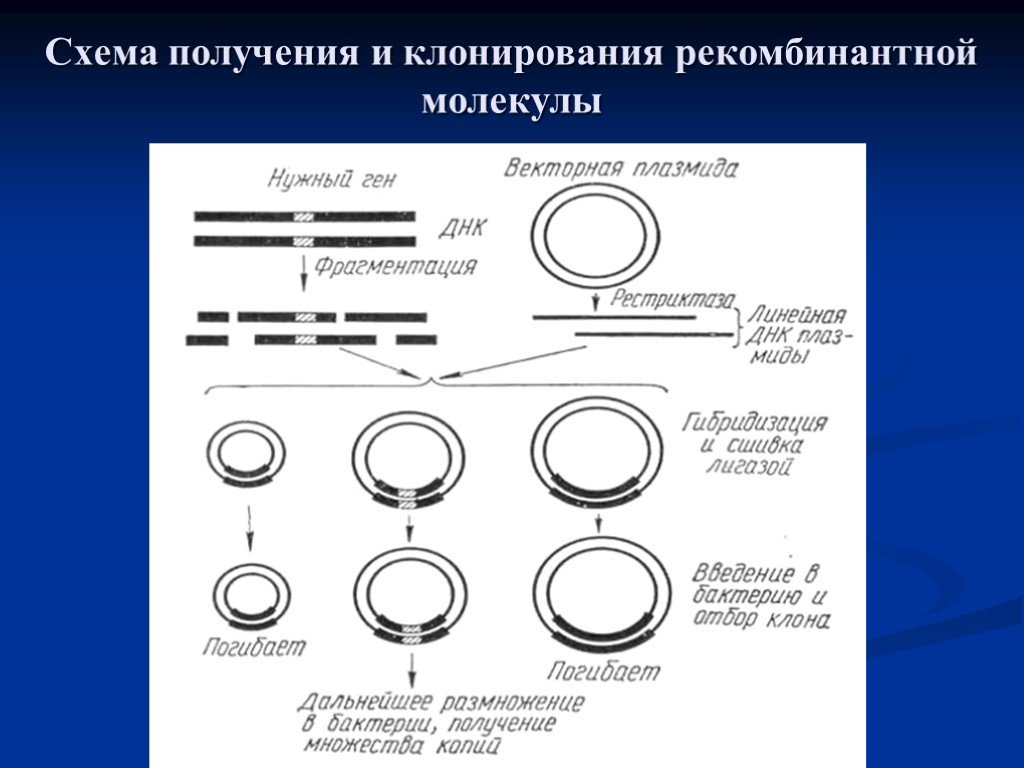
Слайд 24Схема получения и клонирования рекомбинантной молекулы
Слайд 25Интеграция чужеродной ДНК в хромосому хозяина
Процесс интеграции состоит в следущем: Идентификация подходящего сайта интеграции, т. е. сегмента хозяйской ДНК, последовательность которого может быть прервана без ущерба для функционирования клетки. Выделение и клонирование всего хромосомного сайта интеграции или его части. Встраивание нужного гена вместе с регулируемым промотором в клонированный сайт интеграции или вблизи него. Перенос полученной генетической конструкции «хромосомный сайт интеграции/клонированный ген» в хозяйскую клетку в составе плазмиды, не способной к автономной репликации в клетках этого хозяина. Отбор и сохранение тех хозяйских клеток, которые экспрессируют клонированный ген. Наследование клонированного гена возможно только в случае его интеграции в хромосому клеток хозяина.
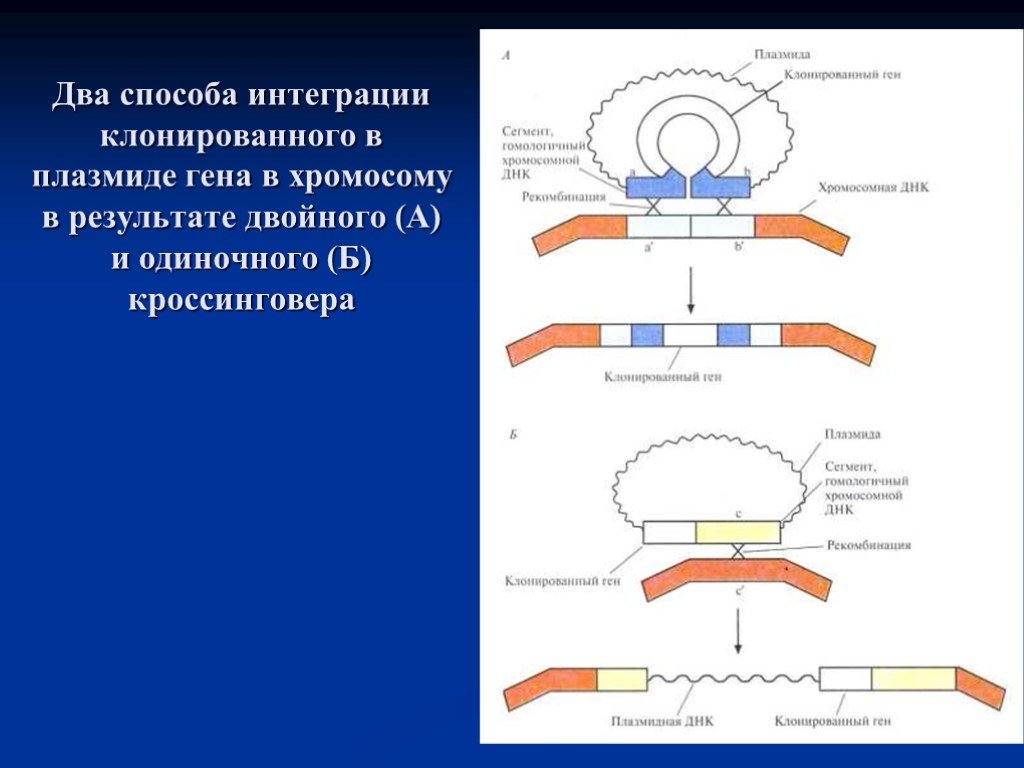
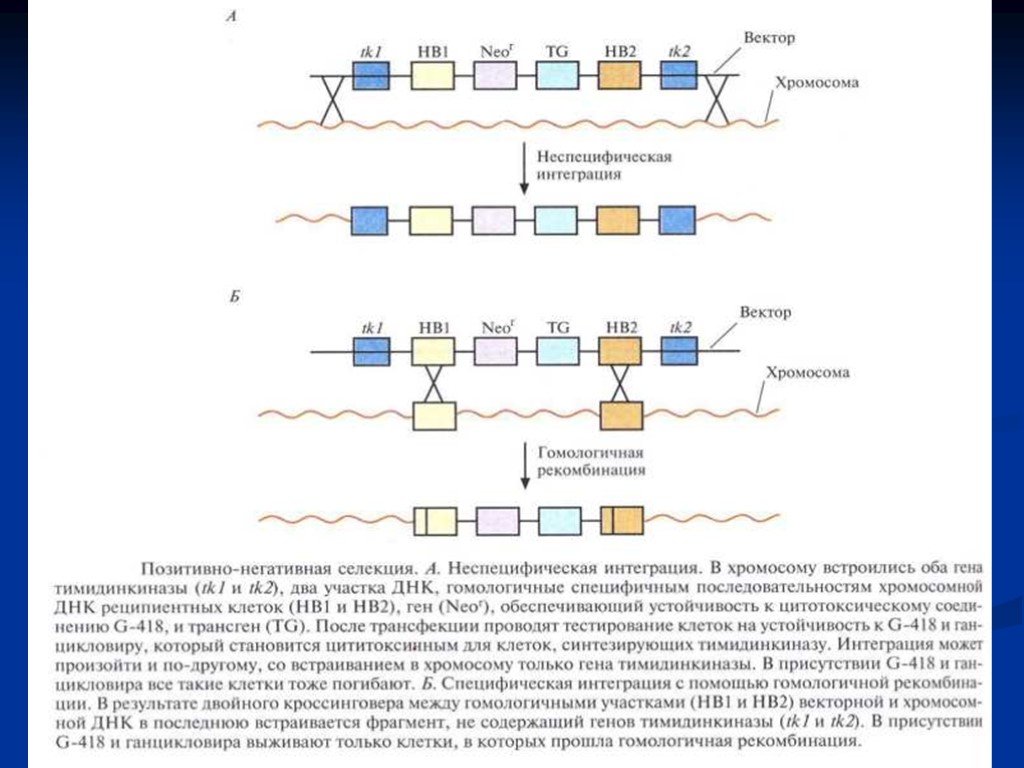
Слайд 26Два способа интеграции клонированного в плазмиде гена в хромосому в результате двойного (А) и одиночного (Б) кроссинговера
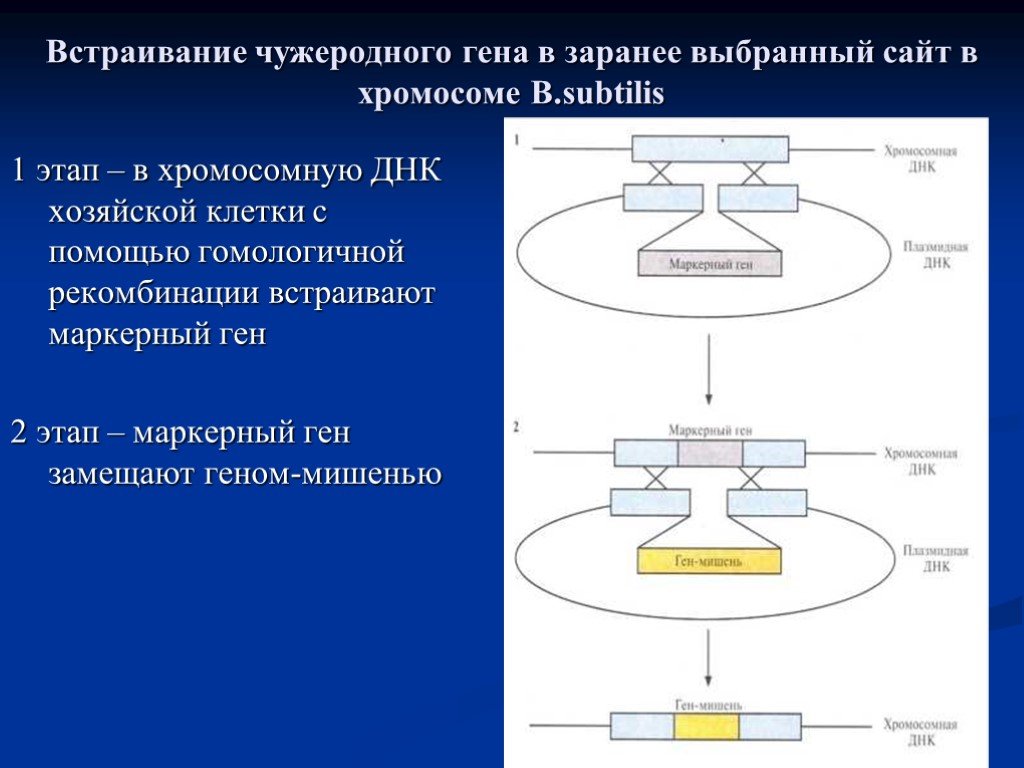
Слайд 27Встраивание чужеродного гена в заранее выбранный сайт в хромосоме B.subtilis
1 этап – в хромосомную ДНК хозяйской клетки с помощью гомологичной рекомбинации встраивают маркерный ген 2 этап – маркерный ген замещают геном-мишенью
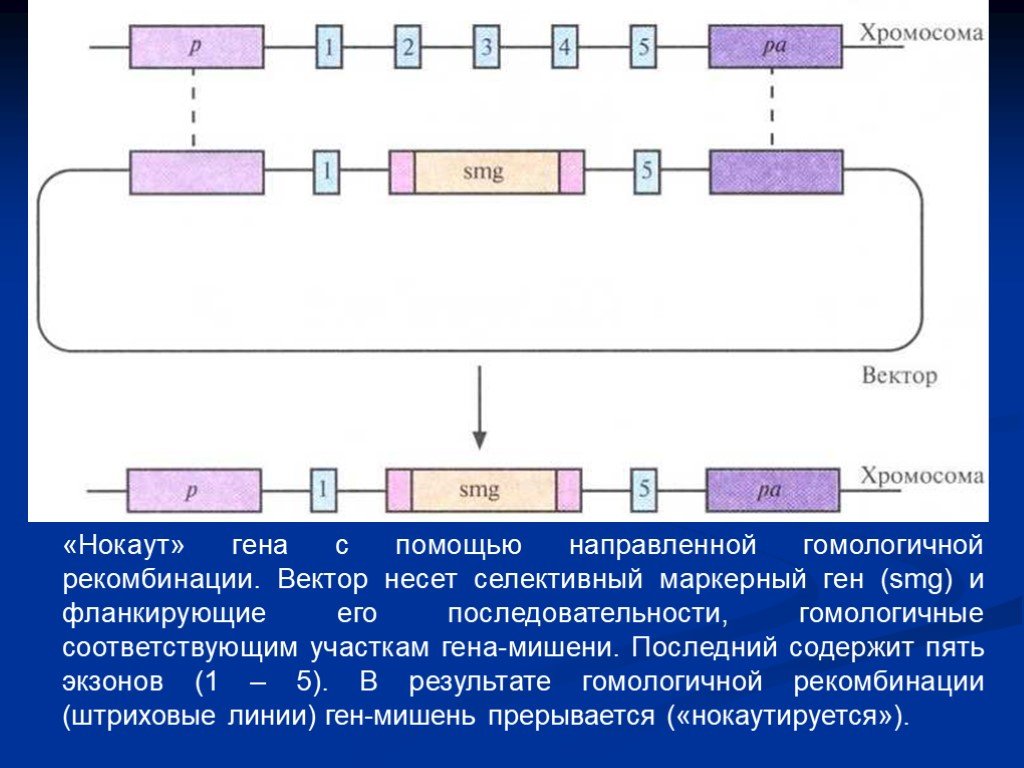
Слайд 28«Нокаут» гена с помощью направленной гомологичной рекомбинации. Вектор несет селективный маркерный ген (smg) и фланкирующие его последовательности, гомологичные соответствующим участкам гена-мишени. Последний содержит пять экзонов (1 – 5). В результате гомологичной рекомбинации (штриховые линии) ген-мишень прерывается («нокаутируется»).
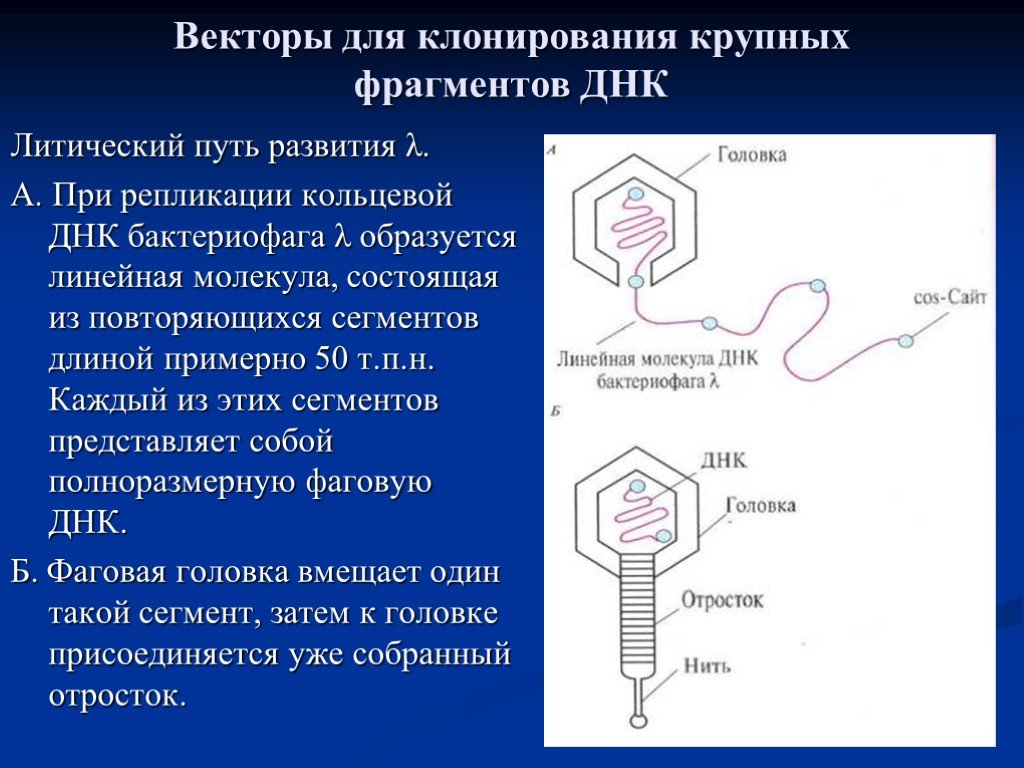
Слайд 29Векторы для клонирования крупных фрагментов ДНК
Литический путь развития λ. А. При репликации кольцевой ДНК бактериофага λ образуется линейная молекула, состоящая из повторяющихся сегментов длиной примерно 50 т.п.н. Каждый из этих сегментов представляет собой полноразмерную фаговую ДНК. Б. Фаговая головка вмещает один такой сегмент, затем к головке присоединяется уже собранный отросток.

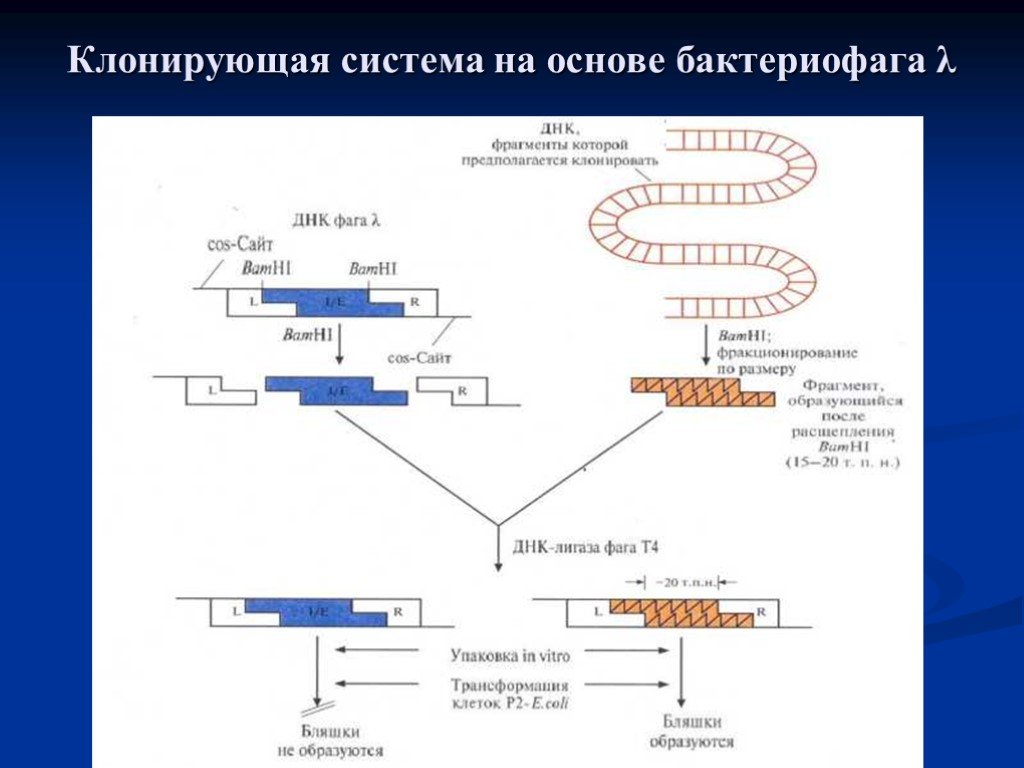
Слайд 30Клонирующая система на основе бактериофага λ. Фаговая ДНК имеет два BamH1-сайта, фланкирующих её I/E-сегмент. Клонируемую ДНК расщепляют с помощью BamH1, фракционируют полученные фрагменты по размеру и выделяют из них те, которые имеют размер от 15 до 20т.п.н. Фаговую ДНК обрабатывают этим же ферментом. Оба препарата ДНК смешивают и обрабатывают ДНК-лигазой фага Т4. Лигированная смесь содержит самые разные комбинации ДНК, в том числе (1) восстановленную ДНК фага λ и (2) рекомбинантные молекулы, содержащие R- и L-области фаговой ДНК и вставку клонируемой ДНК размером ≈ 20 т.п.н., занявшую место области I/E фагового генома. Рекомбинантные молекулы упаковывают в головки бактерифага λ in vitro, и после добавления отростков получают инфекционные фаговые частицы. В инфицированных рекомбинантным фагом клетках E.coli, в хромосому которых интегрирована ДНК бактериофага Р2, могут реплицироваться и образовывать инфекционные частицы только молекулы ДНК, составленные из R- и L-областей фаговой ДНК и клонированной вставки размером ≈ 20 т.п.н.

Слайд 31Клонирующая система на основе бактериофага λ
Слайд 32Лигирование липких и тупых концов в молекуле ДНК фагом Т4
ДНК фага Т4 образует фосфодиэфирные связи между 5‘-фосфатными и 3‘- гидроксильными группами в месте разрыва в остове двухцепочечной ДНК. А – лигирование липких концов В – лигирование тупых концов

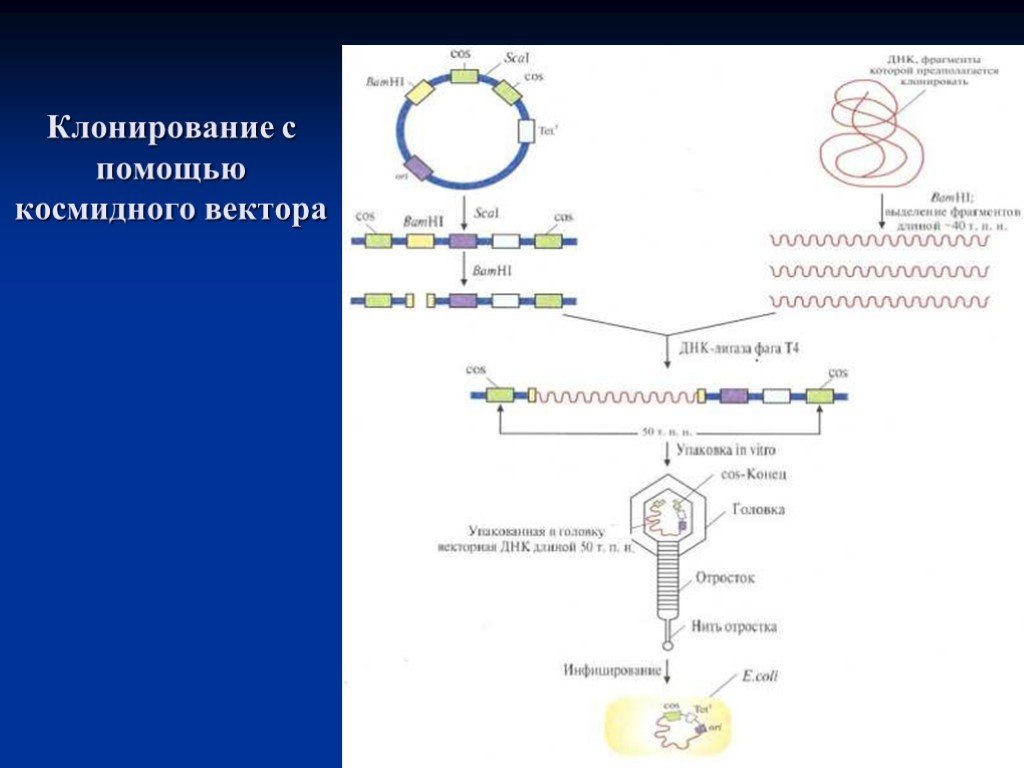
Слайд 33Клонирование с помощью космидного вектора
Космида имеет точку начала репликации (ori), обеспечивающую её существование в E.coli в виде плазмиды;два интактных соs-конца, разделённых уникальным сайтом для Sca1; BamH1-сайт вбдизи одного из соs-сайтов и ген устойчивости к тетрациклину (Теtr). ДНК, которую хотят клонировать, расщепляют рестриктазой BamH1 и фракционируют по размеру,чтобы выделить молекулы длиной примерно 40 т.п.н. Плазмидную ДНК расщепляют с помощью Sca1 и BamH1. Оба препарата ДНК смешивают и обрабатывают ДНК-лигазой фага Т-4. Некоторые из гибридных молекул, образовавшихся после лигирования, содержат вставку размером около 40 т.п.н., так что их суммарная длина составляет примерно 50 т.п.н. Эти молекулы упаковываются in vitro в головки бактериофага λ, затем к головкам прикрепляются отростки, и образуются инфекционные частицы. При инфицировании этим фагом E.coli в бактериальной клетке оказывается линейная молекула ДНК с cos-концами, которые спариваются друг с другом. ДНК-лигаза клетки-хозяина зашивает одноцепочечные разрывы, и образовавшаяся кольцевая молекула существует в клетке-хозяине как автономно реплицирующаяся единица. Трансформированные клетки можно идентифицировать по признаку устойчивости к тетрациклину.
Слайд 34
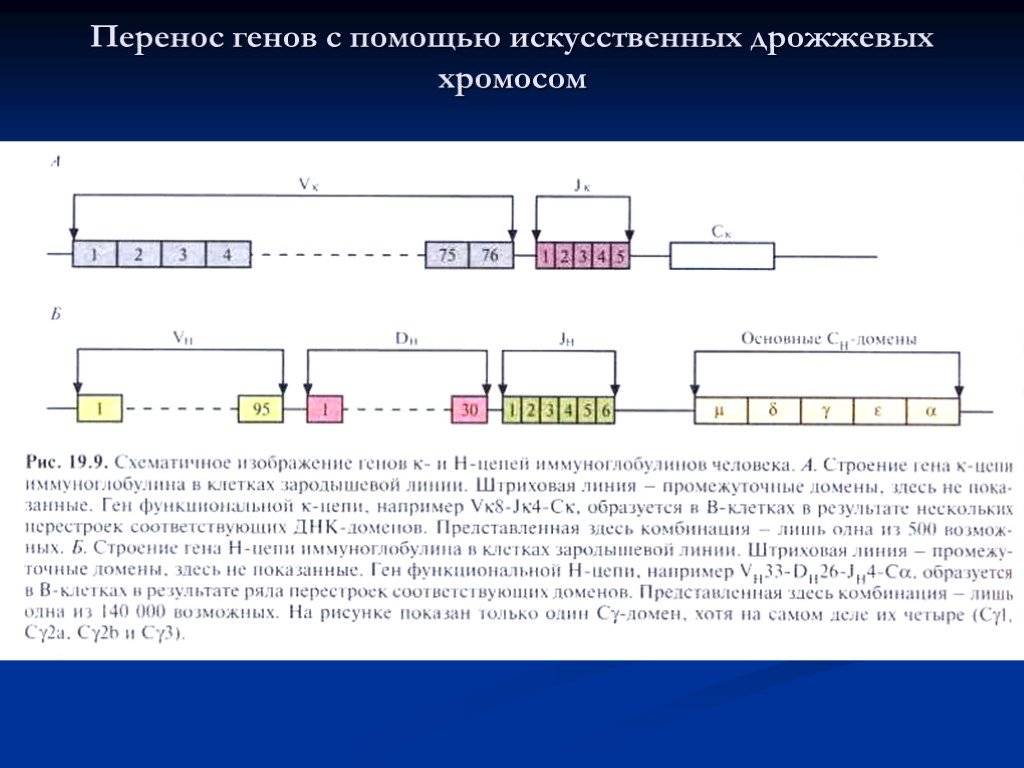
Слайд 35Перенос генов с помощью искусственных дрожжевых хромосом
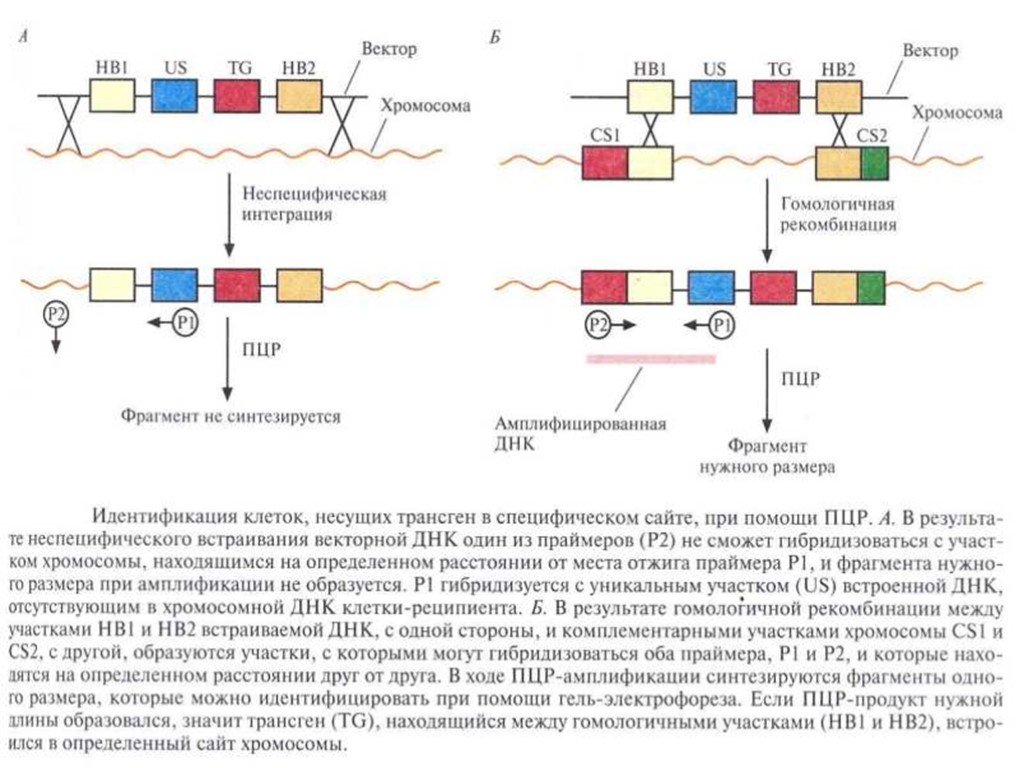
Слайд 36Идентификация клеток, несущих трансген
Слайд 39Методы получения трансгенных животных:
1. Метод микроиньекции 2. Вирусный метод 3. Эмбриональный метод
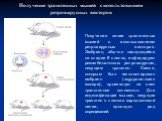
Слайд 40Метод микроиньекции
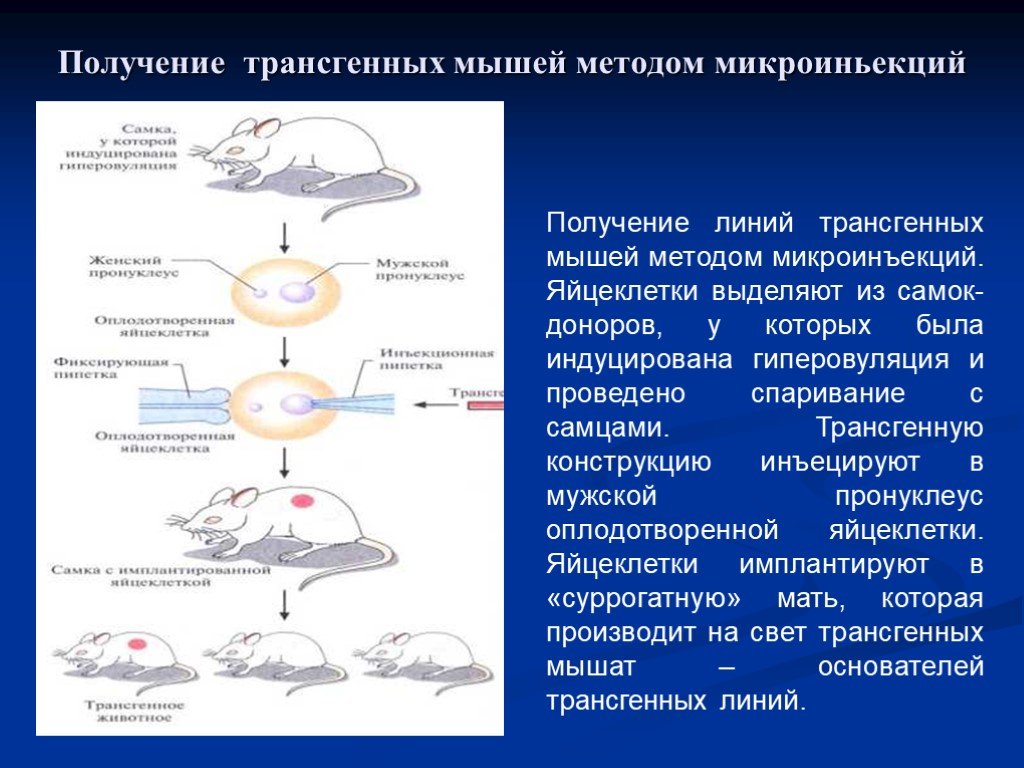
У самок вызывают гиперовуляцию после чего проводят спаривание с самцами. Из самок-доноров выделяют яйцеклетки.В мужской пронуклеус оплодотворённой яйцеклетки иньецируют трансгенную конструкцию. Яйцеклетки имплантируют «суррогатной» матери, которая производит на свет мышей – основателей трансгенной линии.
Слайд 41Получение линий трансгенных мышей методом микроинъекций. Яйцеклетки выделяют из самок-доноров, у которых была индуцирована гиперовуляция и проведено спаривание с самцами. Трансгенную конструкцию инъецируют в мужской пронуклеус оплодотворенной яйцеклетки. Яйцеклетки имплантируют в «суррогатную» мать, которая производит на свет трансгенных мышат – основателей трансгенных линий.
Получение трансгенных мышей методом микроиньекций

Слайд 42Метод микроинъекций ДНК
Увеличение числа яйцеклеток, в которых будет инъецирована чужеродная ДНК, путем стимуляции гиперовуляции у самок-доноров. Сначала самкам вводят сыворотку беременной кобылы, а спустя примерно 48 ч — хорионический гонадотропин человека. В результате гиперовуляции образуется примерно 35 яйцеклеток вместо обычных 5—10. Скрещивание с самцами самок с гиперовуляцией и их умерщвление. Вымывание из яйцеводов оплодотворенных яйцеклеток. Микроинъекция ДНК в оплодотворенные яйцеклетки - как правило, сразу после выделения. Часто вводимая трансгенная конструкция находится в линейной форме и не содержит прокариотических векторных последовательностей.
Слайд 43Вирусный метод
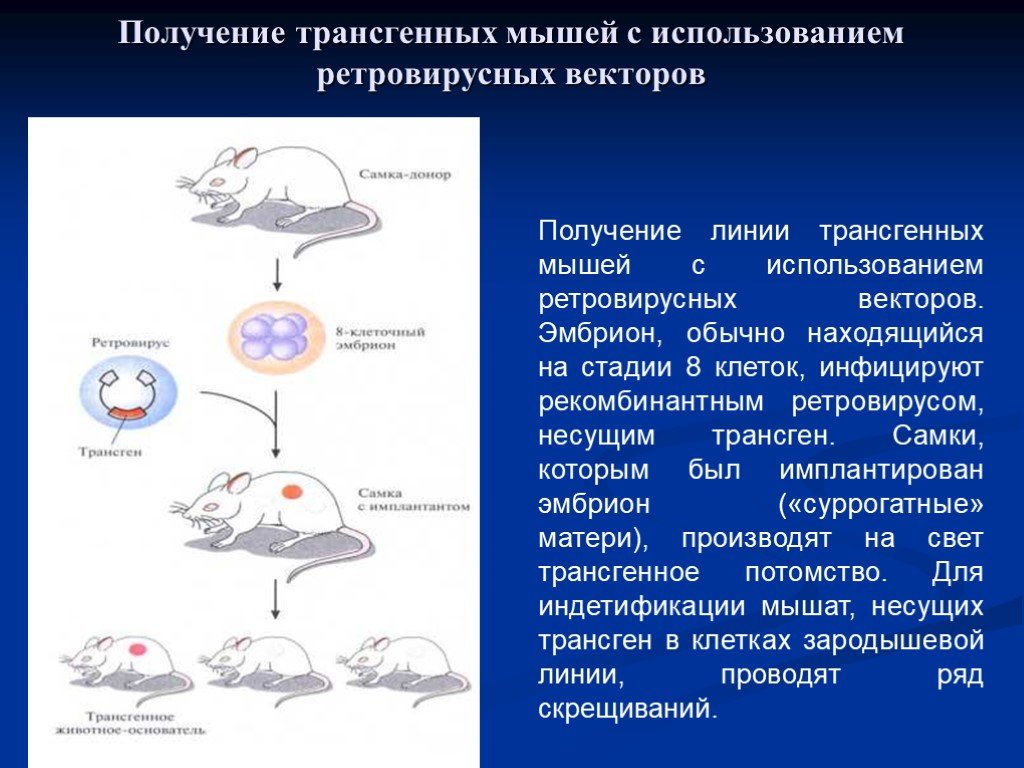
Эмбрион, находящийся на стадии 8 клеток, инфицируют рекомбинантным ретровирусом, несущим трансген. Самки, которым был имплантирован эмбрион, производят на свет трансгенное потомство. Для идентификации мышей, несущих трансген в клетках зародышевой линии, проводят ряд скрещиваний.
Слайд 44Получение трансгенных мышей с использованием ретровирусных векторов
Получение линии трансгенных мышей с использованием ретровирусных векторов. Эмбрион, обычно находящийся на стадии 8 клеток, инфицируют рекомбинантным ретровирусом, несущим трансген. Самки, которым был имплантирован эмбрион («суррогатные» матери), производят на свет трансгенное потомство. Для индетификации мышат, несущих трансген в клетках зародышевой линии, проводят ряд скрещиваний.
Слайд 45Эмбриональный метод
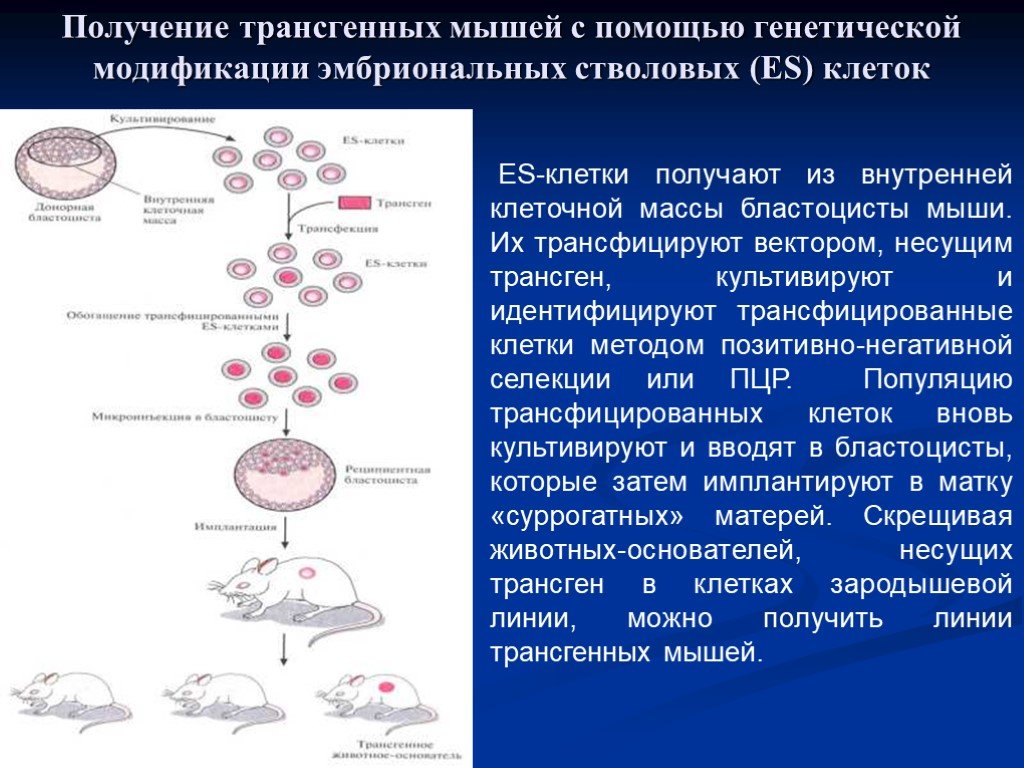
Эмбриональные стволовые клетки получают из внутренней клеточной массы бластоцисты мыши. Их трансфицируют вектором, несущим трансген, культивируют. Трансфицированные клетки идентифицируют методом позитивно-негативной селекции (ПЦР). Популяцию трансфицированных клеток вновь культивируют и вводят в бластоцисты, которые затем имплантируют в матку «суррогатной» матери. Скрещивая животных-основателей, несущих трансген в клетках зародышевой линии, можно получить трансгенных мышей.

Слайд 46ES-клетки получают из внутренней клеточной массы бластоцисты мыши. Их трансфицируют вектором, несущим трансген, культивируют и идентифицируют трансфицированные клетки методом позитивно-негативной селекции или ПЦР. Популяцию трансфицированных клеток вновь культивируют и вводят в бластоцисты, которые затем имплантируют в матку «суррогатных» матерей. Скрещивая животных-основателей, несущих трансген в клетках зародышевой линии, можно получить линии трансгенных мышей.
Получение трансгенных мышей с помощью генетической модификации эмбриональных стволовых (ES) клеток

Слайд 47Использование модифицированных эмбриональных стволовых клеток
Клетки, выделенные из мышиных эмбрионов на стадии бластоцисты, могут пролиферировать в культуре, сохраняя способность к дифференцировке в любые типы клеток, в том числе и в клетки зародышевой линии, при введении в другой эмбрион на стадии бластоцисты. Такие клетки называются плюрипотентными эмбриональными стволовыми клетками (ES). ES-клетки в культуре легко модифицировать методами генной инженерии без нарушения их плюрипотентности. Например, в определенный сайт несущественного гена в их геноме можно встроить функциональный трансген. Затем можно отобрать измененные клетки, культивировать их и использовать для получения трансгенных животных. Это позволяет избежать случайного встраивания, характерного для метода микроинъекций и ретровирусных векторных систем.
Слайд 48Трансгенные животные
Слайд 49Стратегия по введению чужеродных генов в клетки млекопитающих состоит в следующем: Клонированный ген вводят в ядро оплодотворенной яйцеклетки. Инокулированные оплодотворенные яйцеклетки имплантируют в реципиентную женскую особь (поскольку успешное завершение развития эмбриона млекопитающих в иных условиях невозможно). Отбирают потомков, развившихся из имплантированных яйцеклеток, которые содержат клонированный ген во всех клетках. Скрещивают животных, которые несут клонированный ген в клетках зародышевой линии, и получают новую генетическую линию.

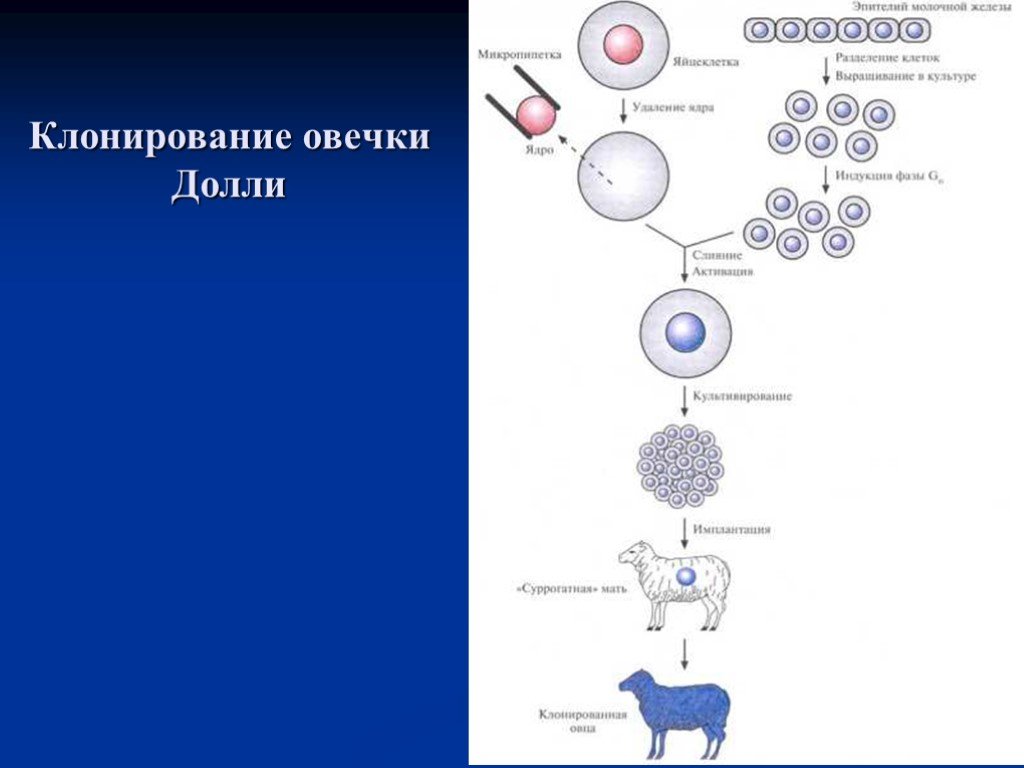
Слайд 50Клонирование овцы методом переноса ядра
Клонирование овцы методом переноса ядра. Ядро яйцеклетки удаляют с помощью микропипетки. Культивируют эпителиальные клетки молочной железы взрослой особи и индуцируют их переход в фазу G0. Осуществляют слияние клеток в G0-фазе и яйцеклеток, лишенных ядра, и выращивают восстановленные яйцеклетки в культуре или в яйцеводе с наложенной лигатурой до ранних стадий эмбриогенеза, а затем имплантируют их в матку «суррогатной» матери, где и происходит дальнейшее развитие. В эксперименте, описанном Уилмутом и др. (1997), было проведено слияние 277 яйцеклеток с удаленными ядрами с клетками молочной железы в фазе G0; из 29 эмбрионов только один развился до жизнеспособного плода.
Слайд 51Клонирование овечки Долли
Слайд 52Трансгенный крупный рогатый скот
Если предполагается использовать молочную железу в качестве «биореактора», то наиболее предпочтительным животным для трансгеноза является крупный рогатый скот, который ежегодно дает до 10 000 л молока, содержащего примерно 35 г белка на 1 л. Если в молоке будет содержаться такое количество рекомбинантного белка и эффективность его очистки составит 50%, то от 20 трансгенных коров можно будет получать примерно 100 кг такого белка в год. По случайному совпадению, именно столько белка С, использующегося для предотвращения тромбообразования, требуется ежегодно. С другой стороны, одной трансгенной коровы будет более чем достаточно для получения требуемого ежегодно количества фактора IX (фактора Кристмаса) каскадного механизма свертывания крови, который вводят больным гемофилией для повышения свертываемости крови.

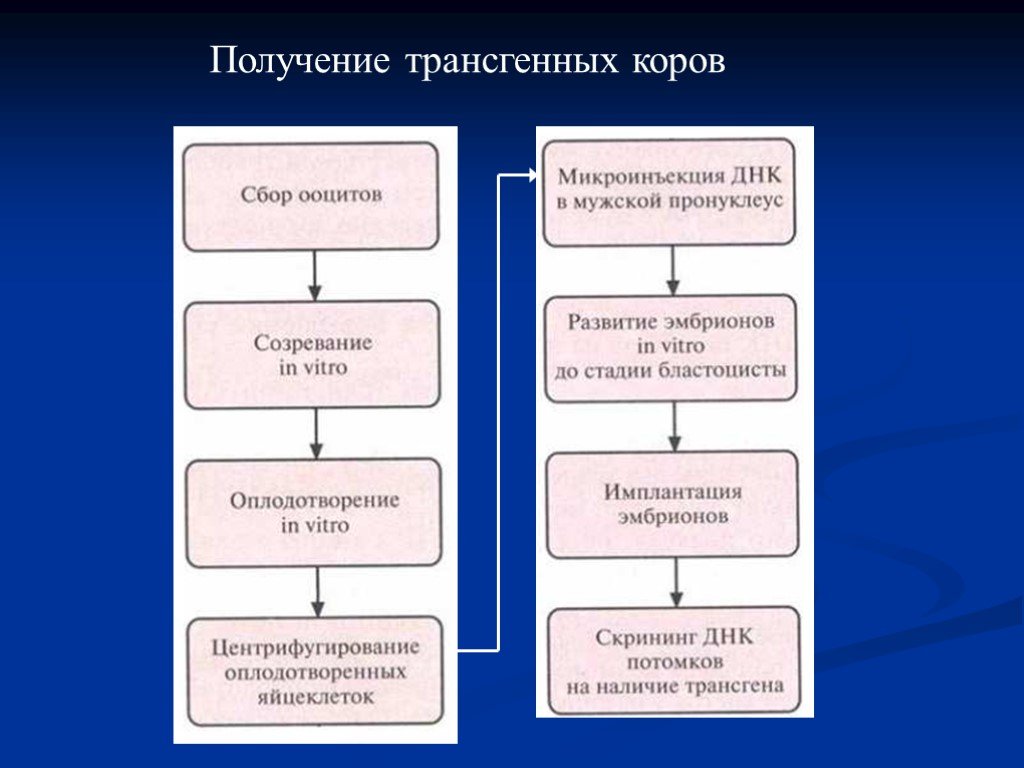
Слайд 53Для создания трансгенных коров использовали модифицированную схему трансгеноза мышей методом микроинъекций ДНК. Процедура включала следующие основные этапы: Сбор ооцитов коров, забитых на скотобойне. Созревание ооцитов in vitro. Оплодотворение бычьей спермой in vitro. Центрифугирование оплодотворенных яйцеклеток для концентрирования желтка, который в нормальных яйцеклетках мешает визуализации мужского пронуклеуса с помощью секционного микроскопа. Микроинъекция ДНК в мужской пронуклеус. Развитие эмбрионов in vitro. Нехирургическая имплантация одного эмбриона реципиентной самке во время течки. Скрининг ДНК потомков на наличие трансгена.
Слайд 54Получение трансгенных коров
Слайд 55Трансгенные овцы, козы и свиньи
Слайд 56Трансгенные птицы
Микроинъекция ДНК в оплодотворенные яйцеклетки птиц с целью получения трансгенных линий - непростая процедура. Это связано с некоторыми особенностями воспроизводства и развития птиц. Так, при оплодотворении у птиц в яйцеклетку могут проникнуть сразу несколько сперматозоидов, а не один, как это обычно бывает у млекопитающих, и идентифицировать тот мужской пронуклеус, который соединится с женским, становится невозможно. Метод микроинъекции ДНК в цитоплазму тоже не подходит, поскольку в этом случае ДНК не интегрируется в геном оплодотворенной яйцеклетки. Наконец, даже если удастся осуществить микроинъекцию ДНК в ядро, дальнейшие операции будет трудно осуществить, поскольку у птиц яйцеклетка после оплодотворения достаточно быстро обволакивается прочной мембраной, покрывается слоем альбумина и внутренней и наружной известковыми оболочками.
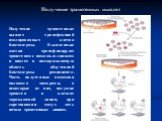
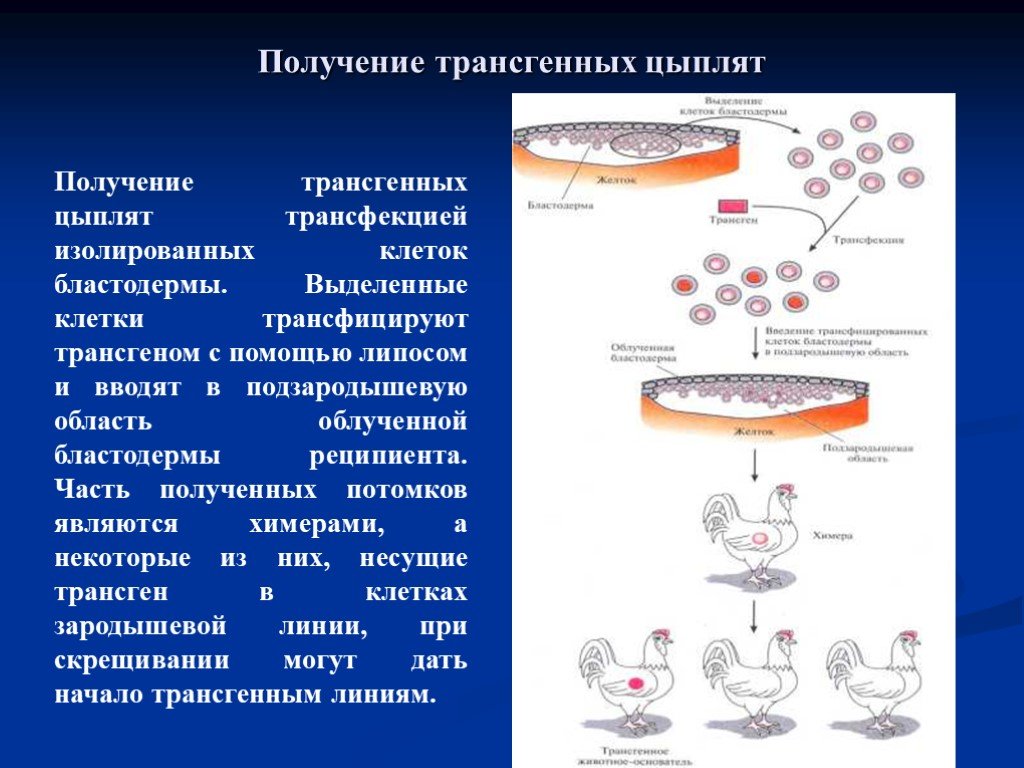
Слайд 57Получение трансгенных цыплят трансфекцией изолированных клеток бластодермы. Выделенные клетки трансфицируют трансгеном с помощью липосом и вводят в подзародышевую область облученной бластодермы реципиента. Часть полученных потомков являются химерами, а некоторые из них, несущие трансген в клетках зародышевой линии, при скрещивании могут дать начало трансгенным линиям.
Получение трансгенных цыплят

Слайд 58Трансгенные рыбы
По мере истощения природных рыбных запасов все большую роль будет приобретать разведение рыбы в искусственных условиях. Основная цель исследований в этой области — создание рекомбинантных рыб путем трансгеноза. До настоящего времени трансгены вводили микроинъекцией ДНК или электропорацией оплодотворенных яйцеклеток различных видов рыб - карпа, зубатки, форели, лосося и т. д. Поскольку у рыб пронуклеус в оплодотворенной яйцеклетке плохо различим в обычный микроскоп, линеаризованную трансгенную ДНК вводят в цитоплазму оплодотворенных яйцеклеток или клеток эмбрионов, достигших стадии четырех бластомеров. Эмбриогенез у рыб протекает в водной среде вне организма, поэтому в имплантации нет необходимости. Все дальнейшие процессы могут протекать в резервуарах с регулируемой температурой. Выживаемость эмбрионов рыб после микроинъекций довольно высока, от 35 до 80%, а доля трансгенных потомков колеблется от 10 до 70%. Трансген можно обнаружить с помощью ПЦР с использованием либо препаратов эритроцитов зародышей, либо суммарной ДНК. Скрещивая трансгенных рыб, можно вывести трансгенные линии.

Слайд 59Трансгенные мыши: методология
Введение чужеродной ДНК мышам можно осуществить разными методами: С помощью ретровирусных векторов, инфицирующих клетки эмбриона на ранних стадиях развития перед имплантацией эмбриона в самку-реципиента; Микроинъекцией в увеличенное ядро спермия (мужской пронуклеус) оплодотворенной яйцеклетки; Введением генетически модифицированных эмбриональных стволовых клеток в предимпланированный эмбрион на ранних стадиях развития.

Слайд 60Трансгенные мыши: применение как модельного обьекта изучения болезни Альцгеймера.
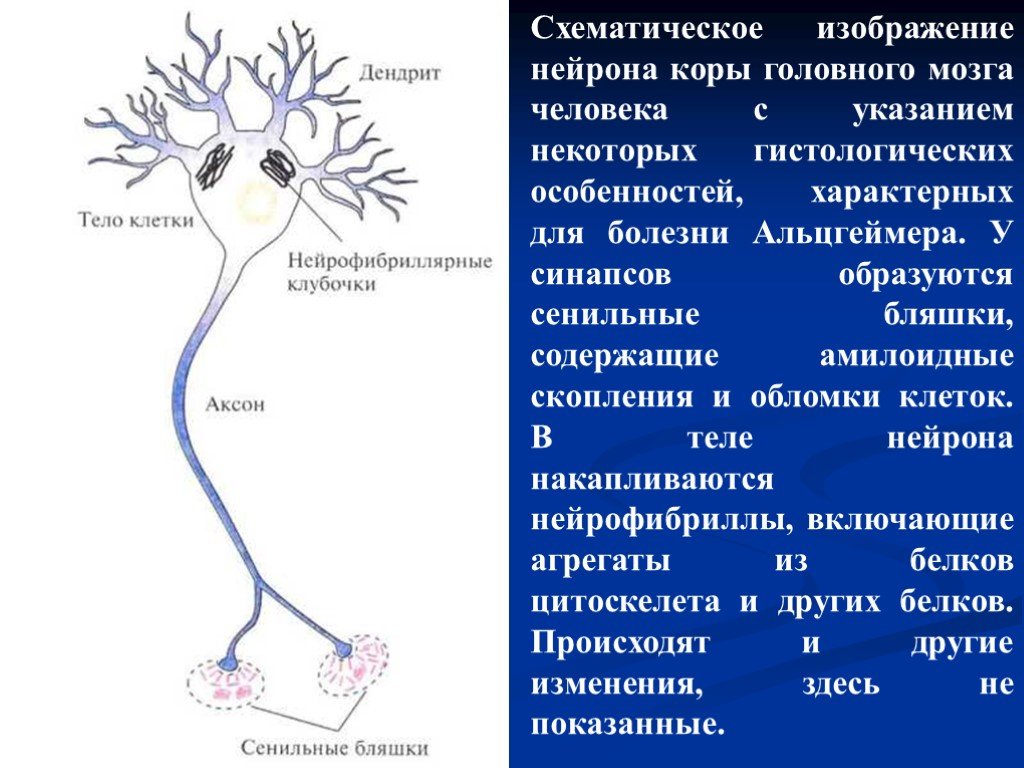
Болезнь Альцгеймера — это дегенеративный процесс, приводящий к утрате клеток различных отделов головного мозга. Наиболее ранним проявлением служит ухудшение памяти. Этот процесс прогрессирует, к нему присоединяются утрата способности к абстрактному мышлению, изменение личности, нарушения речи, снижение физического статуса. Патология наблюдается у 1% людей возрастной группы от 60 до 65 лет и у 30% людей старше 80 лет. При патоморфологическом исследовании в теле нейронов обнаруживаются нейрофибриллярные клубочки, а у синалтических окончаний - плотные агрегаты, называемые сенильными бляшками. Кроме того, в кровеносных сосудах мозга обнаруживаются конгломераты - амилоидные бляшки.
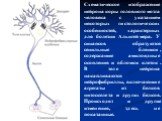
Слайд 61Схематическое изображение нейрона коры головного мозга человека с указанием некоторых гистологических особенностей, характерных для болезни Альцгеймера. У синапсов образуются сенильные бляшки, содержащие амилоидные скопления и обломки клеток. В теле нейрона накапливаются нейрофибриллы, включающие агрегаты из белков цитоскелета и других белков. Происходят и другие изменения, здесь не показанные.

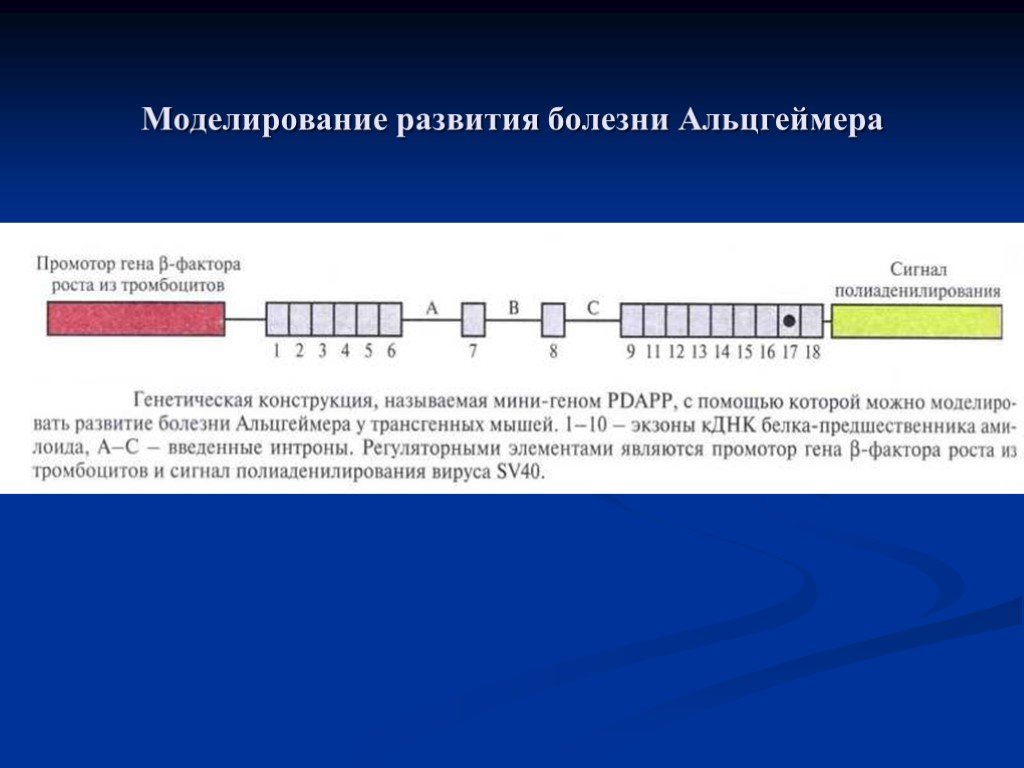
Слайд 62Основным компонентом сенильных и амилоидных бляшек является белок Ар (амилоид р\ р-белок, р-амилоидный белок, (3/А4) мол. массой 4 кДа. Существуют Ар-белки с разным числом аминокислотных остатков, например Ар40 и Ар42. Все они образуются в результате протеолитического расщепления белка-предшественника (АРР). Причины аккумуляции Ар-белка не установлены. Члены некоторых семей, в которых с высокой частотой встречается болезнь Альцгеймера, несут мутации в гене АРР, что наводит на мысль об участии этого гена в возникновении данной патологии. К сожалению, проследить в деталях за возникновением и развитием болезни Альцгеймера на человеке не удается. Неоценимую помощь в этом могла бы оказать какая-нибудь «животная» модель.
Слайд 63Моделирование развития болезни Альцгеймера
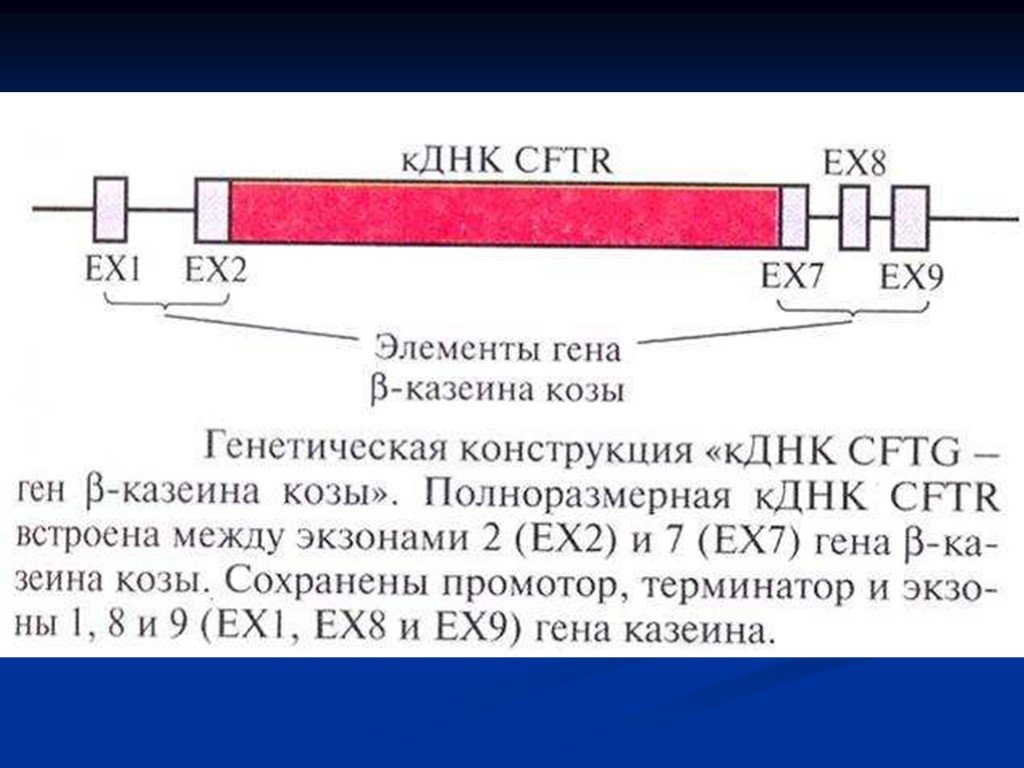
Слайд 64Муковисцидоз — распространенная генетическая болезнь, поражающая в странах Европы одного из 2500 новорожденных. Первичный эффект дефектного CF-гена — это изменение функции CFTR, который в норме служит каналом для ионов хлора. В результате блокирования потока этих ионов в клетку и из клетки в протоках некоторых органов, особенно в легких и поджелудочной железе, скапливается слизь. Она становится источником бактериальной инфекции, которая с трудом поддается лечению антибиотиками. ДНК, высвобождающаяся из лизировавших бактерий, делает слизь очень густой. Загустевшая слизь забивает протоки, нарушается нормальная работа органа и симптомы муковисцидоза еще более усиливаются. Продолжительность жизни больных муковисцидозом составляет в настоящее время 25—30 лет.
Слайд 66Гибридизация соматических клеток
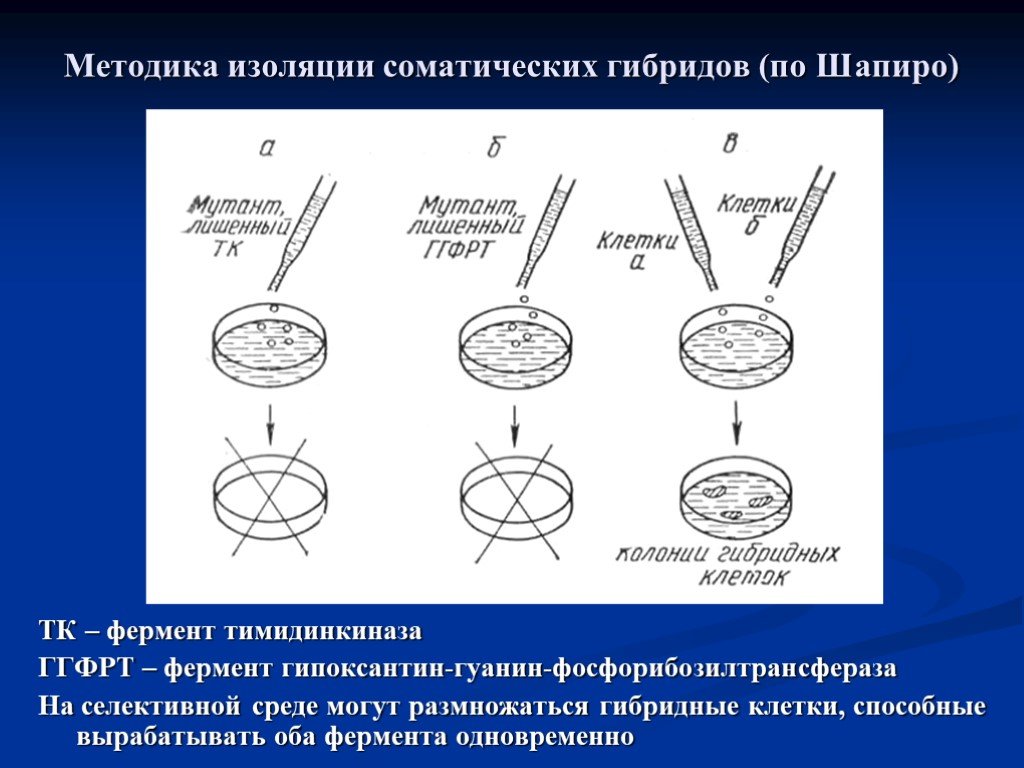
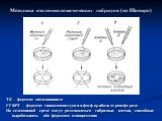
Слайд 67Методика изоляции соматических гибридов (по Шапиро)
ТК – фермент тимидинкиназа ГГФРТ – фермент гипоксантин-гуанин-фосфорибозилтрансфераза На селективной среде могут размножаться гибридные клетки, способные вырабатывать оба фермента одновременно
Слайд 68Некоторые сочетания геномов, полученные слиянием соматических клеток
Слайд 69Благодарю за внимание!