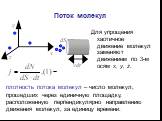
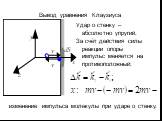
Презентация "Термодинамический и статистический методы" по физике – проект, доклад
Презентацию на тему "Термодинамический и статистический методы" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 34 слайд(ов).
Слайды презентации
Список похожих презентаций
Формы и методы обучения физике
Приемы повышения интереса к изучению предмета:. Создание на уроках такой атмосферы, при которой они чувствуют необходимость учебных занятий, с интересом ...Термодинамический анализ процессов в компрессорах
Рис. 7.1. Компрессор называется идеальным если: сжатый в цилиндре газ полностью без остатка выталкивается поршнем; отсутствуют потери энергии в клапанах; ...Физика и методы научного познания
Элементы содержания, проверяемые на ЕГЭ 2010: Наблюдение и описание физических явлений Физический эксперимент Измерение физических величин. Международная ...Теорема об изменении кинетической энергии и уравнения Лагранжа II рода как методы изучения движения механической системы
ОБ АВТОРЕ:. Родилась я 21 мая 1989 года, в городе Ангарске. По знаку зодиака я близнецы. С самого рождения люблю животных. В нашей школе учусь с первого ...Теория вероятностей. Комбинаторика. Комбинаторные методы решения задач
Цель урока: Выработать умение решать задачи на определение классической вероятности с использованием основных формул комбинаторики. Оборудование: ...Различные методы исследования законов постоянного тока
Психологический настрой. Я чувствую себя уверенным. Я способен добиться всего, чего захочу. Я достигну успеха. У меня все получится! Обобщающая таблица. ...Радиоактивные отходы и методы их захоронения
План. Понятие о радиационном загрязнении Воздействие атомных станций на окружающую среду Уничтожение опасных отходов Радиационная обстановка в Краснодарском ...Приборы и методы для управления процессом графитации
Основные показатели графитации. Основным показателем, определяющим ход процесса графитации, является температура. От скорости подъема температуры ...Экспериментальные методы исследования частиц. Счетчик Гейгера
Широкое применение счетчика Гейгера — Мюллера объясняется высокой чувствительностью, возможностью регистрировать разного рода излучения, сравнительной ...Мостовые методы измерения
История создания. В середине ХIХ века началось бурное развитие техники: прокладывались проводные телеграфные и телефонные линии связи. Постоянные ...Математические методы в физике
ВСТУПЛЕНИЕ. 1) Для работы нужна тетрадь 80 – 96 л. 2) За невыполненное д/з оценка снижается на один балл 3) В случае пропуска урока – ответ по предыдущей ...«Механические волны» физика
Цель исследования: установить с научной точки зрения, что такое звук. Задачи исследования: 1. Изучить физическую теорию звука. 2. Исследовать историю ...Молекулярная физика и термодинамика
Содержание:. Структура и содержание МКТ. Основные положения МКТ. Опытные обоснования МКТ. Роль диффузии и броуновского движения в природе и технике. ...Сила трения физика
Определение. Сила трения - это сила, возникающая в плоскости касания тел при их относительном перемещении. Направление. Сила трения направлена противоположно ...Тепловые двигатели физика
СОДЕРЖАНИЕ. Содержание Тепловой двигатель Тепловые машины и развитие техники Кто создал тепловые двигатели Виды тепловых двигателей Принцип работы ...Простая и интересная физика у Вас дома
Содержание. Эксперименты на тепловые явления. Эксперимент на плотность. Научные забавы и прочие опыты. Как будут отпадать гвозди??? Вы ответили неверно!!! ...Рентгеновские лучи физика
Презентацию подготовила: Григорьвева Наталья. Руководитель: Баева Валентина Михайловна. Цель работы: узнать о жизни и изобретении великого ученого ...Атомная физика
Факты, свидетельствующие о сложном строении атома. Периодическая система Д.И. Менделеева Электролиз Открытие электрона Катодные лучи Радиоактивность. ...Оптика и атомная физика
В основу настоящего конспекта лекций положен курс лекций по оптике, разработанный профессором кафедры оптики Н.К. Сидоровым и заведующим кафедры оптики ...«Сообщающиеся сосуды» физика
Цель: изучить особенности сообщающихся сосудов и сформулировать основной закон сообщающихся сосудов. Опыт с двумя трубками. Опыт с сосудами разной ...Конспекты
Экспериментальные методы ядерной физики
Тема: «. Экспериментальные методы ядерной физики. ». Цель урока. : рассмотреть экспериментальные методы ядерной физики. Задачи:. - образовательная. ...Экспериментальные методы исследования частиц
Тема урока :. Экспериментальные методы исследования частиц. Цели урока :. Рассмотреть ионизирующее и фотохимическое действие частиц как основы ...Радиоактивность. Строение атомного ядра. Радиоактивные превращения. Альфа-, бета-, гамма-распад: правило смещения. Закон радиоактивного распада и его статистический характер
Урок № 60-169 Урок № 60-169 Радиоактивность. Строение атомного ядра. . Радиоактивные превращения. Альфа-, бета-, гамма-распад: п. равило смещения. ...Строение атома: планетарная модель и модель Бора. Квантовые постулаты Бора. Принцип действия и использование лазера. Экспериментальные методы регистрации заряженных частиц
Урок № 59-169 Строение атома: планетарная модель и модель Бора. Квантовые постулаты Бора. Принцип действия и использование лазера. Экспериментальные ...Научные методы изучения природы.Физический эксперимент. Физическая теория
Предмет: Физика. . Класс: 7 рус. План занятия №. _. 5. __. Дата. 17. 09. 2013 год. Тема:. Научные методы изучения природы.Физический эксперимент. ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:7 февраля 2019
Категория:Физика
Содержит:34 слайд(ов)
Поделись с друзьями:
Скачать презентацию