Слайд 1Лекция 2 Жгутиконосцы
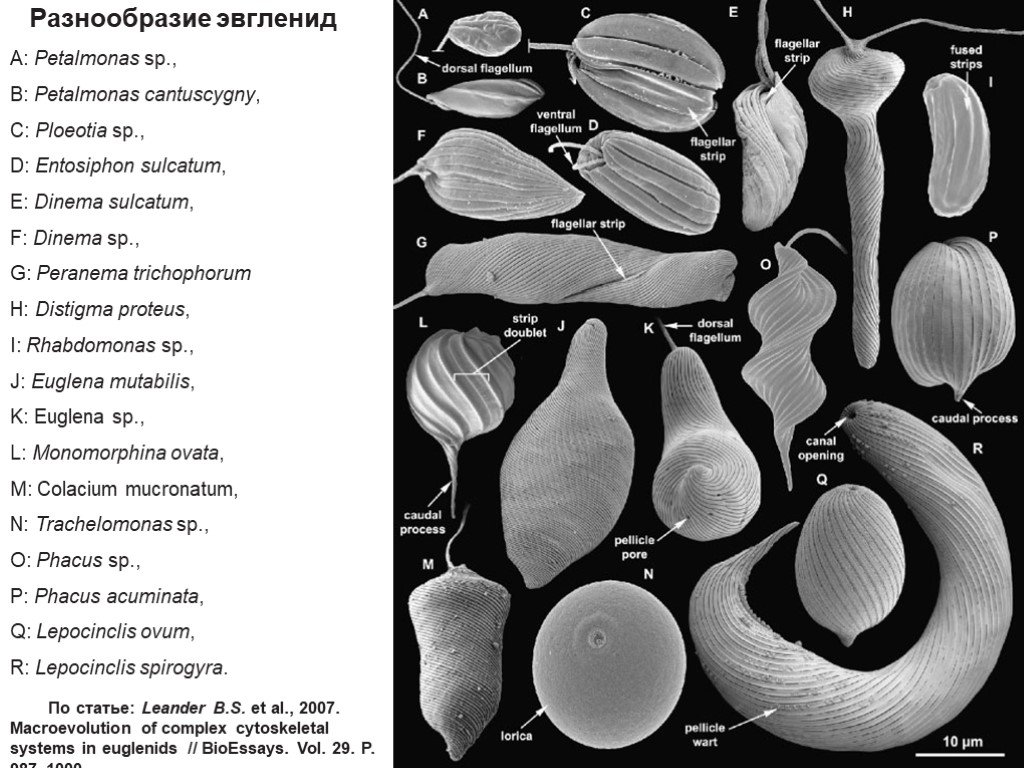
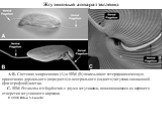
Слайд 2Разнообразие эвгленид
A: Petalmonas sp., B: Petalmonas cantuscygny, C: Ploeotia sp., D: Entosiphon sulcatum, E: Dinema sulcatum, F: Dinema sp., G: Peranema trichophorum H: Distigma proteus, I: Rhabdomonas sp., J: Euglena mutabilis, K: Euglena sp., L: Monomorphina ovata, M: Colacium mucronatum, N: Trachelomonas sp., O: Phacus sp., P: Phacus acuminata, Q: Lepocinclis ovum, R: Lepocinclis spirogyra.
По статье: Leander B.S. et al., 2007. Macroevolution of complex cytoskeletal systems in euglenids // BioEssays. Vol. 29. P. 987–1000
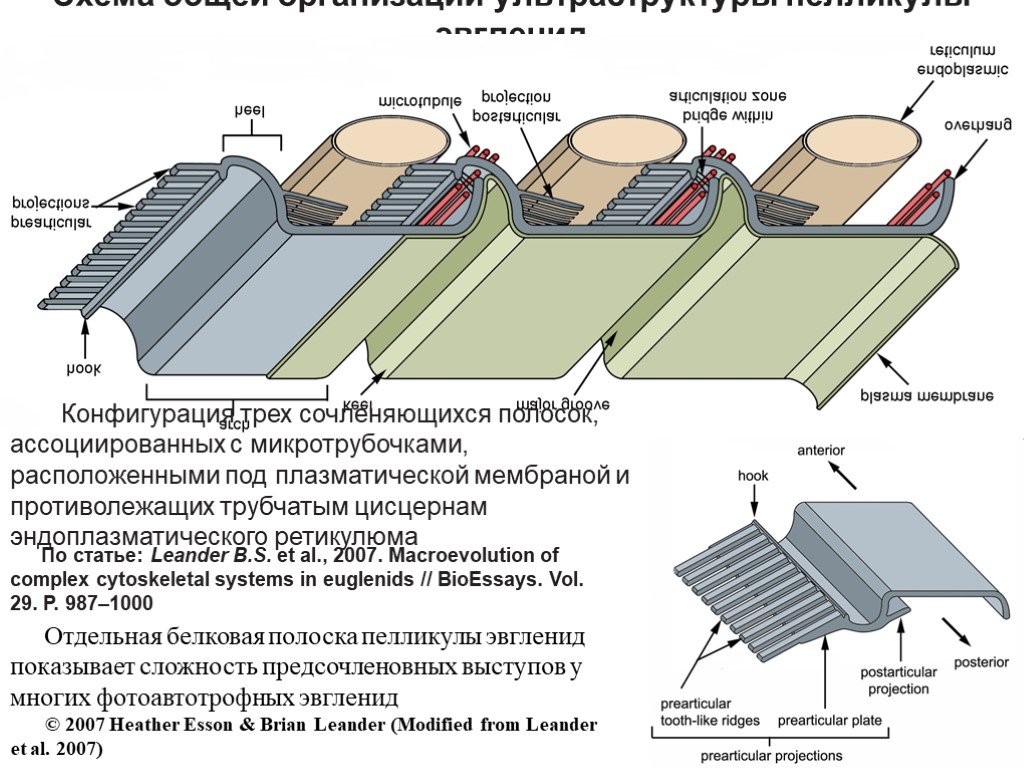
Слайд 3Строение пелликулы эвгленид
SEM показывает относительное число полосок пелликулы и различия размеров между питающейся бактериями (слева, 4 полоски пелликулы) и крупной эвгленой (справа, с 48 полосками пелликулы)
SEM фотоавтотрофных и первично осмотрофных эвгленид, которые независимо теряли способность к метаболии. A. Monomorphina; B-C. Phacus; D-E. Lepocinclis; F. Rhabdomonas. © Brian S. Leander
Слайд 4Схема общей организации ультраструктуры пелликулы эвгленид
Конфигурация трех сочленяющихся полосок, ассоциированных с микротрубочками, расположенными под плазматической мембраной и противолежащих трубчатым цисцернам эндоплазматического ретикулюма
Отдельная белковая полоска пелликулы эвгленид показывает сложность предсочленовных выступов у многих фотоавтотрофных эвгленид © 2007 Heather Esson & Brian Leander (Modified from Leander et al. 2007)
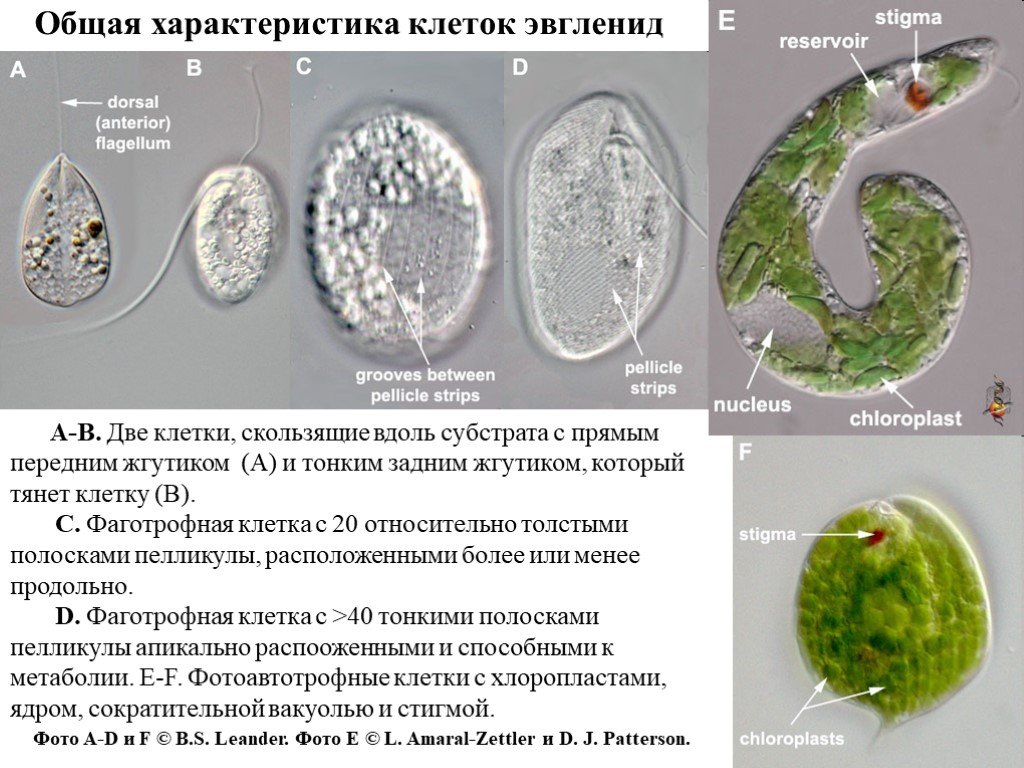
Слайд 5Общая характеристика клеток эвгленид
A-B. Две клетки, скользящие вдоль субстрата с прямым передним жгутиком (A) и тонким задним жгутиком, который тянет клетку (B). C. Фаготрофная клетка с 20 относительно толстыми полосками пелликулы, расположенными более или менее продольно. D. Фаготрофная клетка с >40 тонкими полосками пелликулы апикально распооженными и способными к метаболии. E-F. Фотоавтотрофные клетки с хлоропластами, ядром, сократительной вакуолью и стигмой. Фото A-D и F © B.S. Leander. Фото E © L. Amaral-Zettler и D. J. Patterson.
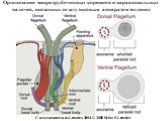
Слайд 6Жгутиковый аппарат эвгленид
A-B. Световая микроскопия (A) и SEM (B) показывают гетеродинамическую ориентацию дорзального (переднего) и вентрального (заднего) жгутика скользящей (фаготрофной) клетки. C. SEM Peranema trichophorum с двумя жгутиками, появляющимися из верхнего отверстия жгутикового кармана. © 2008 Brian S. Leander
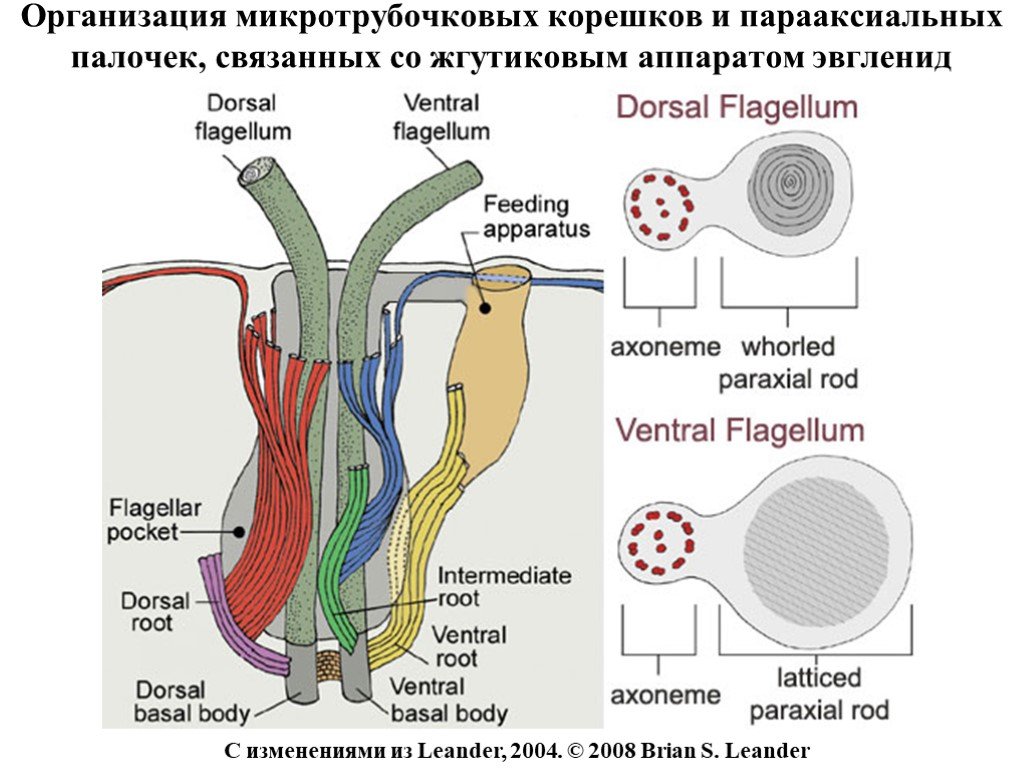
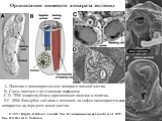
Слайд 7Организация микротрубочковых корешков и парааксиальных палочек, связанных со жгутиковым аппаратом эвгленид
С изменениями из Leander, 2004. © 2008 Brian S. Leander
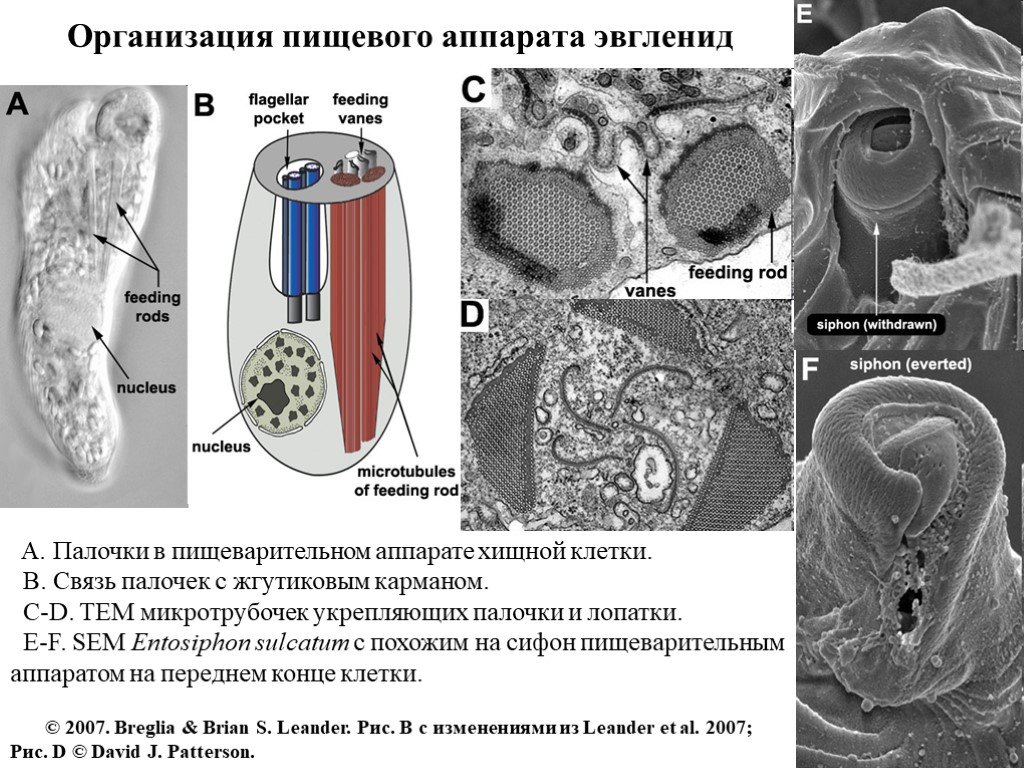
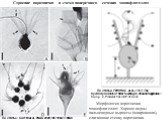
Слайд 8Организация пищевого аппарата эвгленид
A. Палочки в пищеварительном аппарате хищной клетки. B. Связь палочек с жгутиковым карманом. C-D. ТЕМ микротрубочек укрепляющих палочки и лопатки. E-F. SEM Entosiphon sulcatum с похожим на сифон пищеварительным аппаратом на переднем конце клетки. © 2007. Breglia & Brian S. Leander. Рис. B с изменениями из Leander et al. 2007; Рис. D © David J. Patterson.
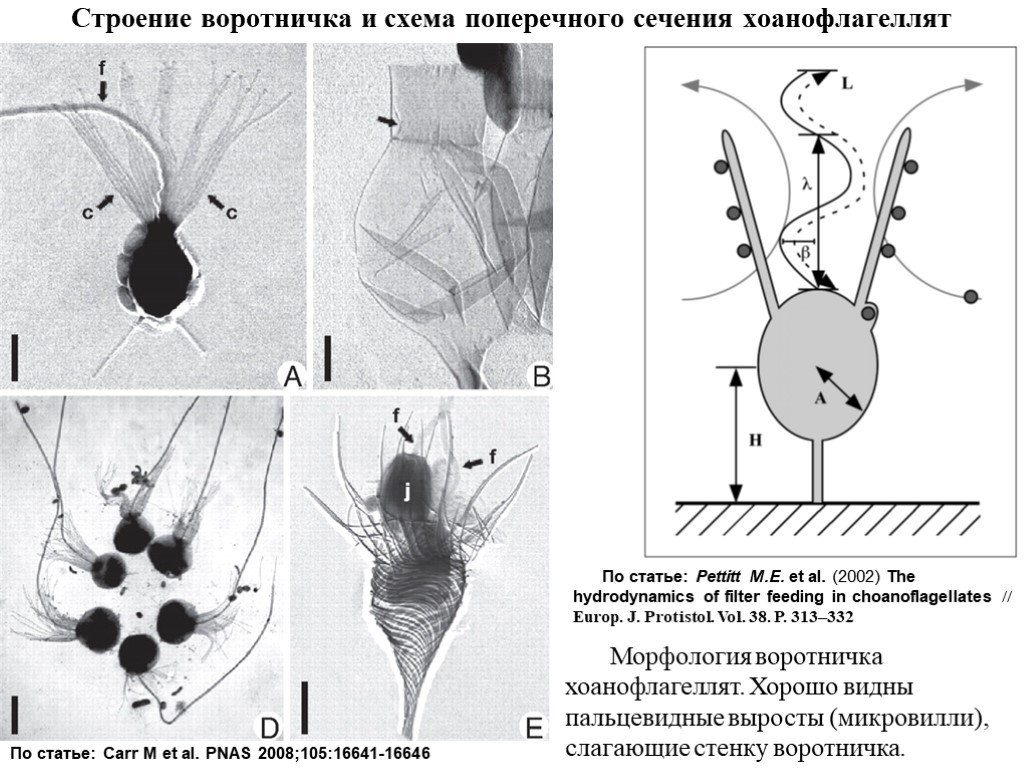
Слайд 9Строение воротничка и схема поперечного сечения хоанофлагеллят
По статье: Pettitt M.E. et al. (2002) The hydrodynamics of filter feeding in choanoflagellates // Europ. J. Protistol. Vol. 38. P. 313–332
По статье: Carr M et al. PNAS 2008;105:16641-16646
Морфология воротничка хоанофлагеллят. Хорошо видны пальцевидные выросты (микровилли), слагающие стенку воротничка.
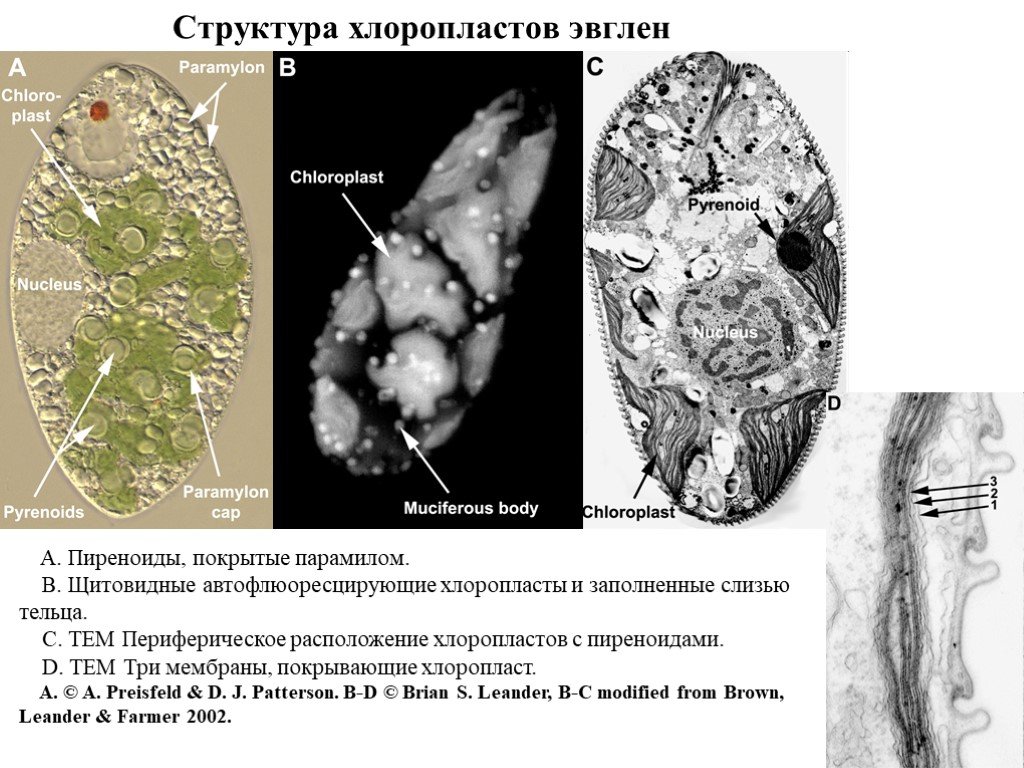
Слайд 10Структура хлоропластов эвглен
A. Пиреноиды, покрытые парамилом. B. Щитовидные автофлюоресцирующие хлоропласты и заполненные слизью тельца. C. ТЕМ Периферическое расположение хлоропластов с пиреноидами. D. ТЕМ Три мембраны, покрывающие хлоропласт. А. © A. Preisfeld & D. J. Patterson. B-D © Brian S. Leander, B-C modified from Brown, Leander & Farmer 2002.
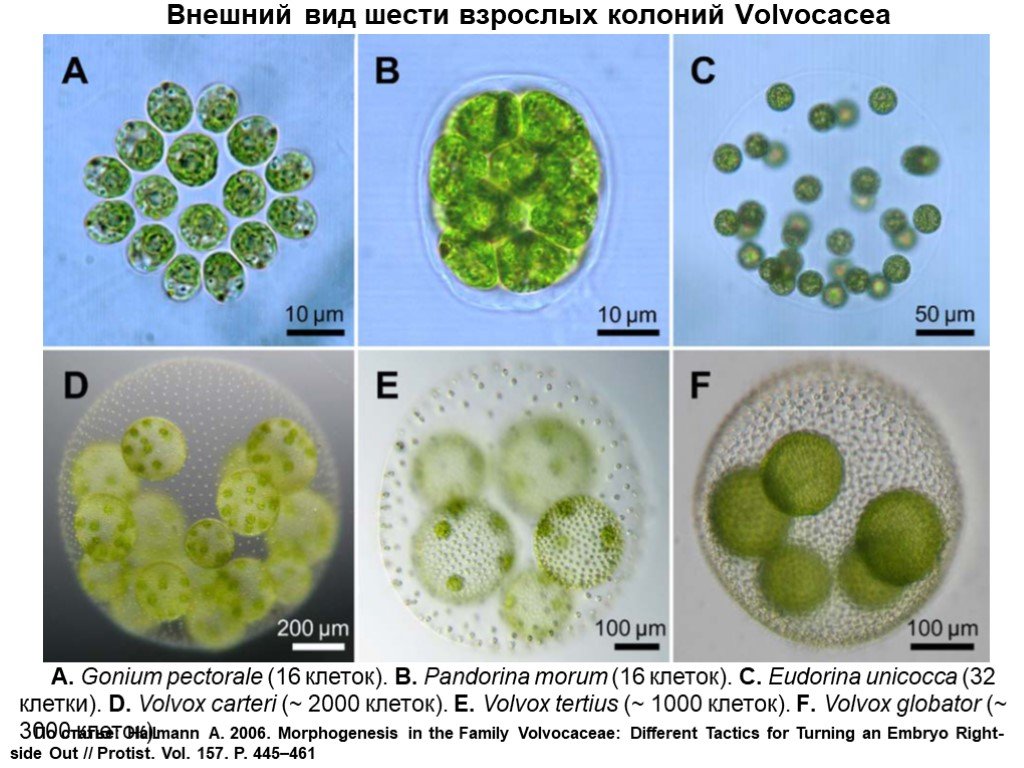
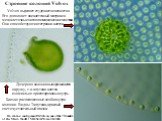
Слайд 11Внешний вид шести взрослых колоний Volvocacea
A. Gonium pectorale (16 клеток). B. Pandorina morum (16 клеток). C. Eudorina unicocca (32 клетки). D. Volvox carteri (~ 2000 клеток). E. Volvox tertius (~ 1000 клеток). F. Volvox globator (~ 3000 клеток).
По статье: Hallmann A. 2006. Morphogenesis in the Family Volvocaceae: Different Tactics for Turning an Embryo Right-side Out // Protist. Vol. 157. P. 445–461
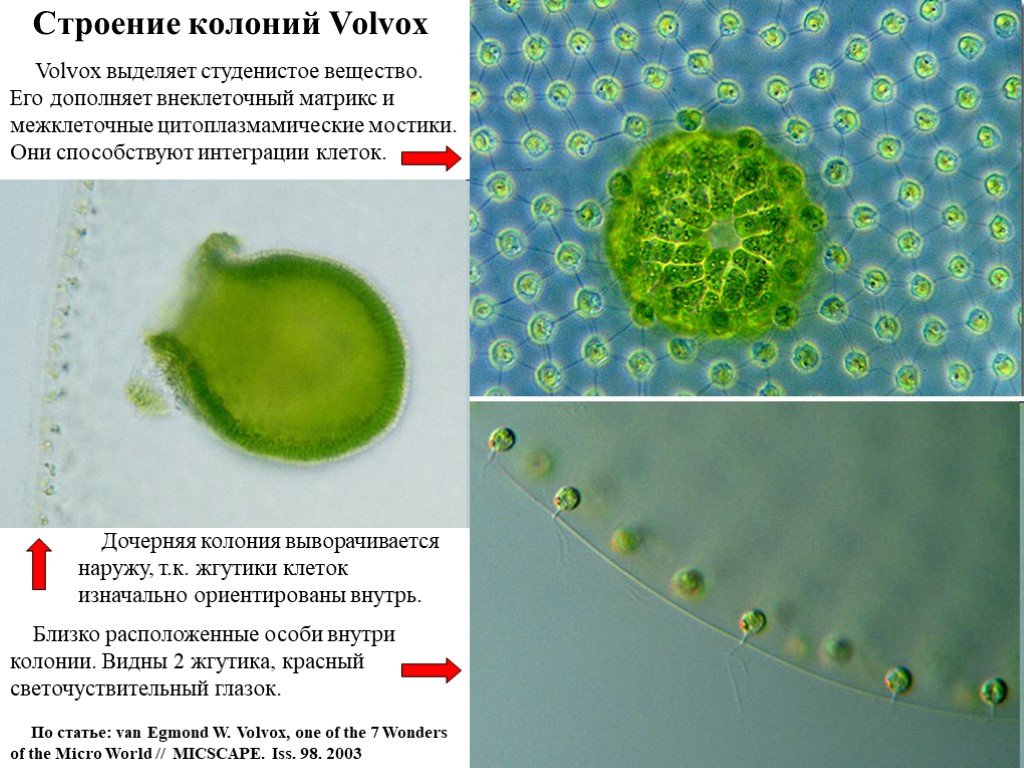
Слайд 12Строение колоний Volvox
Volvox выделяет студенистое вещество. Его дополняет внеклеточный матрикс и межклеточные цитоплазмамические мостики. Они способствуют интеграции клеток.
Близко расположенные особи внутри колонии. Видны 2 жгутика, красный светочуствительный глазок.
Дочерняя колония выворачивается наружу, т.к. жгутики клеток изначально ориентированы внутрь.
По статье: van Egmond W. Volvox, one of the 7 Wonders of the Micro World // MICSCAPE. Iss. 98. 2003

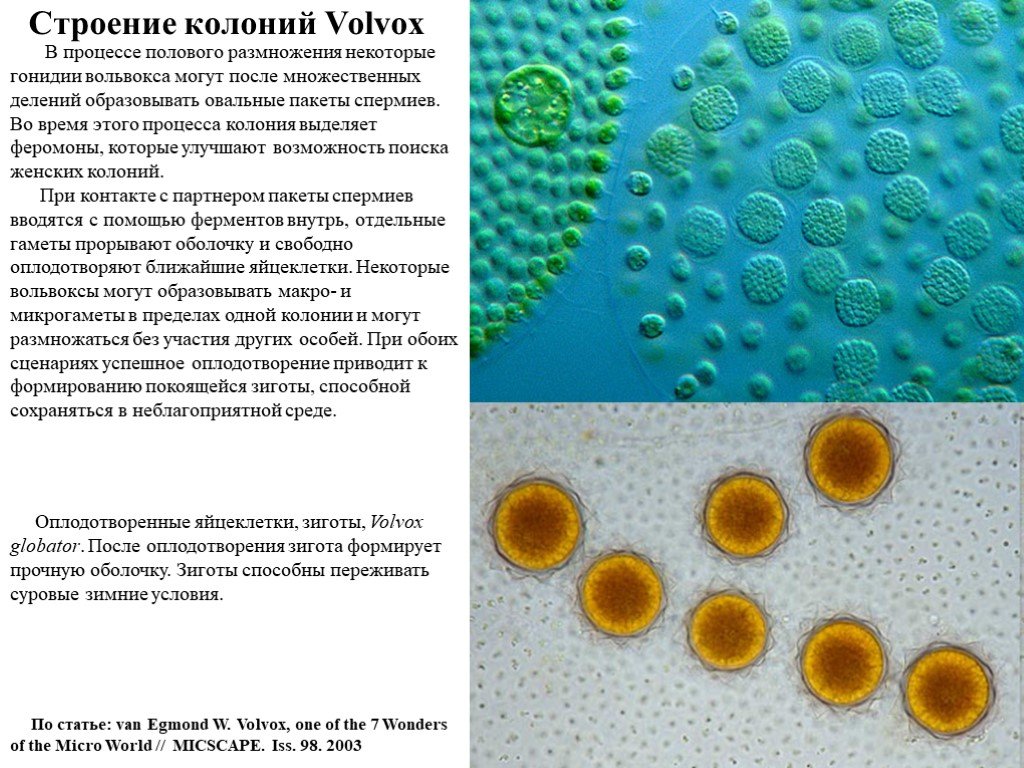
Слайд 13В процессе полового размножения некоторые гонидии вольвокса могут после множественных делений образовывать овальные пакеты спермиев. Во время этого процесса колония выделяет феромоны, которые улучшают возможность поиска женских колоний. При контакте с партнером пакеты спермиев вводятся с помощью ферментов внутрь, отдельные гаметы прорывают оболочку и свободно оплодотворяют ближайшие яйцеклетки. Некоторые вольвоксы могут образовывать макро- и микрогаметы в пределах одной колонии и могут размножаться без участия других особей. При обоих сценариях успешное оплодотворение приводит к формированию покоящейся зиготы, способной сохраняться в неблагоприятной среде.
Оплодотворенные яйцеклетки, зиготы, Volvox globator. После оплодотворения зигота формирует прочную оболочку. Зиготы способны переживать суровые зимние условия.
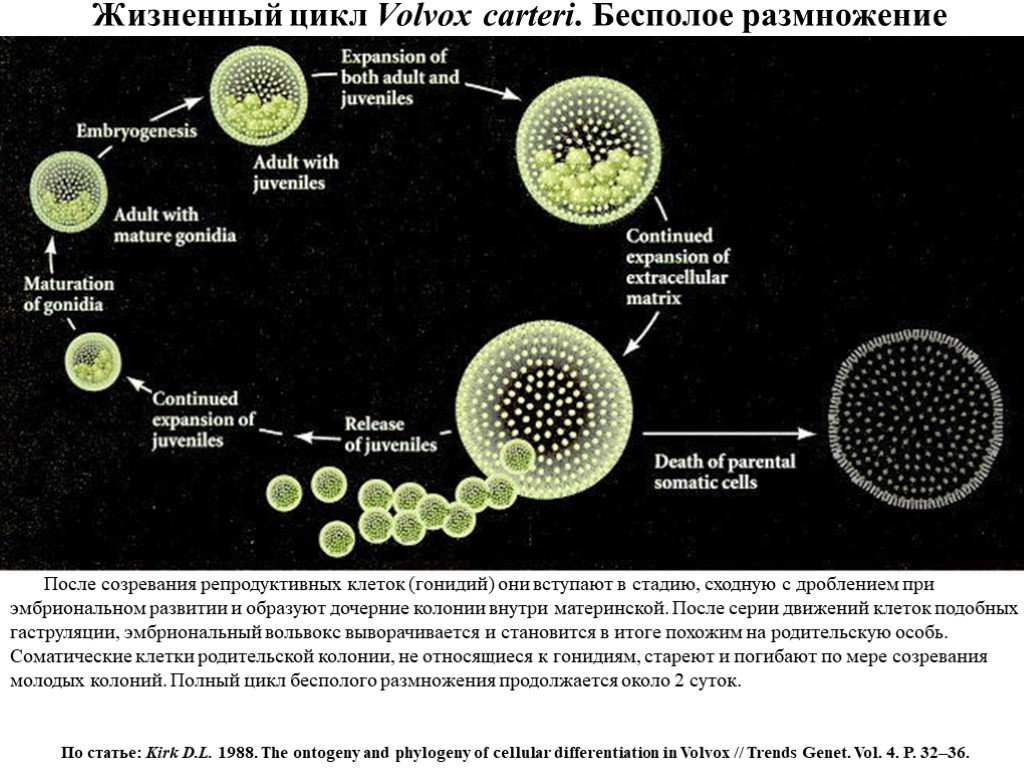
Слайд 14Жизненный цикл Volvox carteri. Бесполое размножение
После созревания репродуктивных клеток (гонидий) они вступают в стадию, сходную с дроблением при эмбриональном развитии и образуют дочерние колонии внутри материнской. После серии движений клеток подобных гаструляции, эмбриональный вольвокс выворачивается и становится в итоге похожим на родительскую особь. Соматические клетки родительской колонии, не относящиеся к гонидиям, стареют и погибают по мере созревания молодых колоний. Полный цикл бесполого размножения продолжается около 2 суток.
По статье: Kirk D.L. 1988. The ontogeny and phylogeny of cellular differentiation in Volvox // Trends Genet. Vol. 4. P. 32–36.

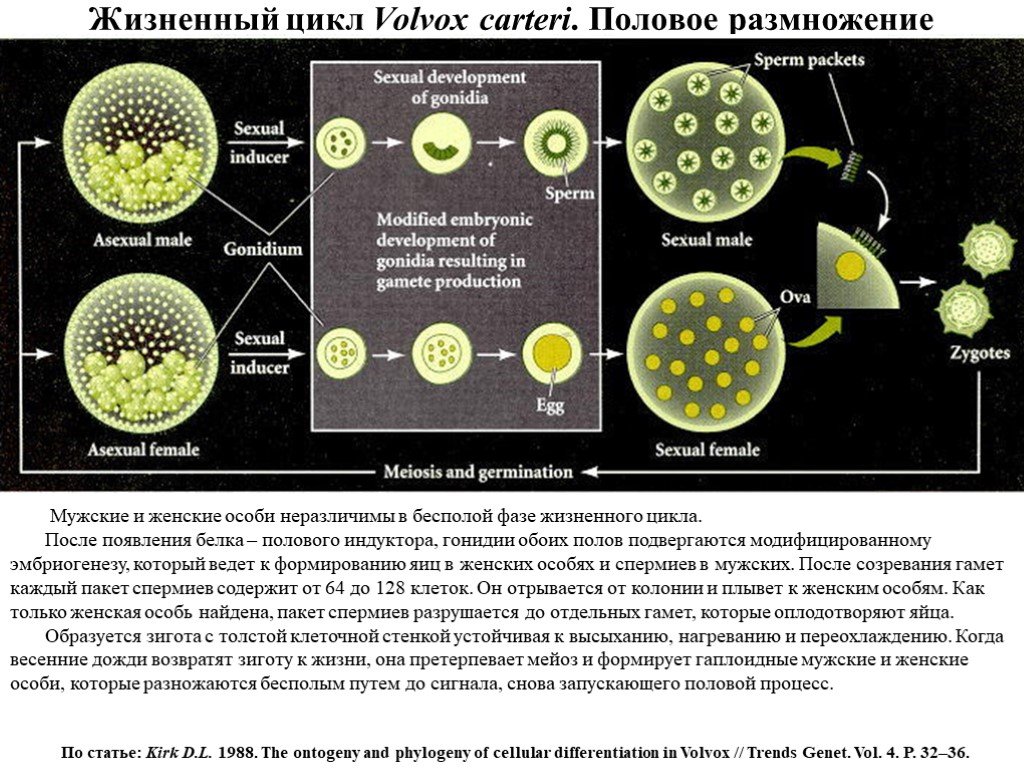
Слайд 15Жизненный цикл Volvox carteri. Половое размножение
Мужские и женские особи неразличимы в бесполой фазе жизненного цикла. После появления белка – полового индуктора, гонидии обоих полов подвергаются модифицированному эмбриогенезу, который ведет к формированию яиц в женских особях и спермиев в мужских. После созревания гамет каждый пакет спермиев содержит от 64 до 128 клеток. Он отрывается от колонии и плывет к женским особям. Как только женская особь найдена, пакет спермиев разрушается до отдельных гамет, которые оплодотворяют яйца. Образуется зигота с толстой клеточной стенкой устойчивая к высыханию, нагреванию и переохлаждению. Когда весенние дожди возвратят зиготу к жизни, она претерпевает мейоз и формирует гаплоидные мужские и женские особи, которые разножаются бесполым путем до сигнала, снова запускающего половой процесс.

Слайд 16Стадии дробления в эбриогенезе Volvocacea
Первые пять стадий дробления в развитии из одиночной клетки до 32-ти клеточного эмбриона. (включая Gonium pectorale и Pandorina morum 4 стадии дробления до 16 клеток). A. Gonium pectorale. B. Pandorina morum. C. Eudorina unicocca. D. Volvox carteri. E. Volvox tertius. F. Volvox globator. a: Клетка до начала дробления; b-e: 4 дробления до формирования 16-ти клеточной плакеи; f: Вид сбоку на 16-32 клеточную плакею, которая сильно искривлена.
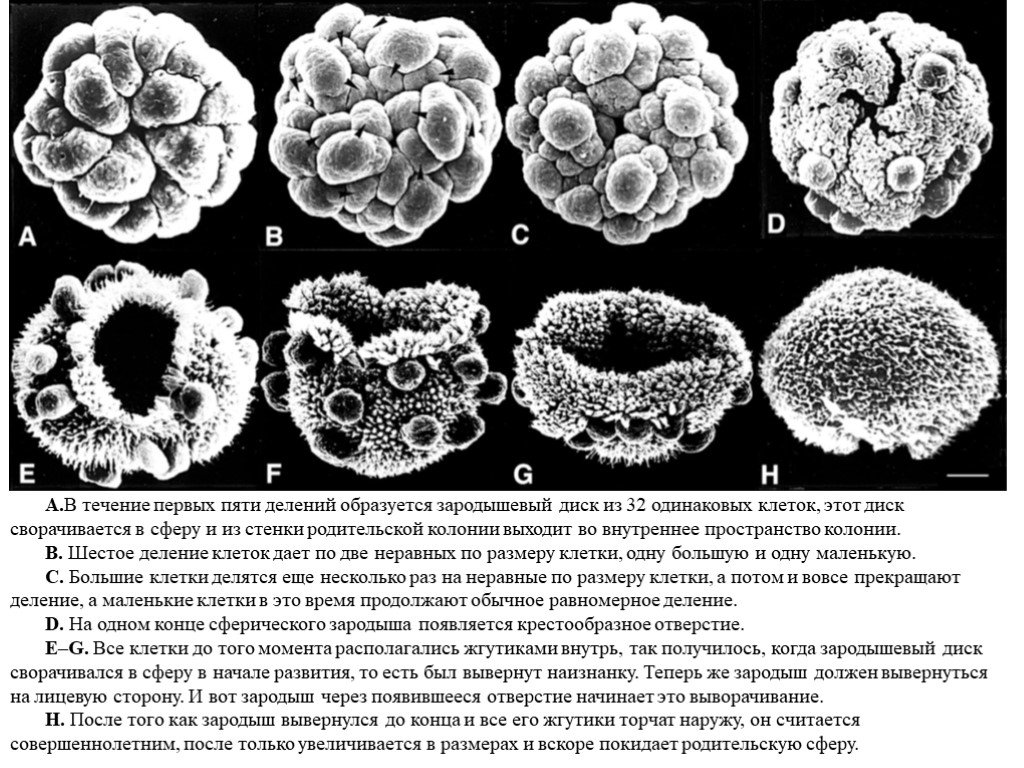
Слайд 17Развитие вольвокса
А.В течение первых пяти делений образуется зародышевый диск из 32 одинаковых клеток, этот диск сворачивается в сферу и из стенки родительской колонии выходит во внутреннее пространство колонии. B. Шестое деление клеток дает по две неравных по размеру клетки, одну большую и одну маленькую. C. Большие клетки делятся еще несколько раз на неравные по размеру клетки, а потом и вовсе прекращают деление, а маленькие клетки в это время продолжают обычное равномерное деление. D. На одном конце сферического зародыша появляется крестообразное отверстие. E–G. Все клетки до того момента располагались жгутиками внутрь, так получилось, когда зародышевый диск сворачивался в сферу в начале развития, то есть был вывернут наизнанку. Теперь же зародыш должен вывернуться на лицевую сторону. И вот зародыш через появившееся отверстие начинает это выворачивание. H. После того как зародыш вывернулся до конца и все его жгутики торчат наружу, он считается совершеннолетним, после только увеличивается в размерах и вскоре покидает родительскую сферу.
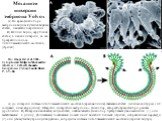
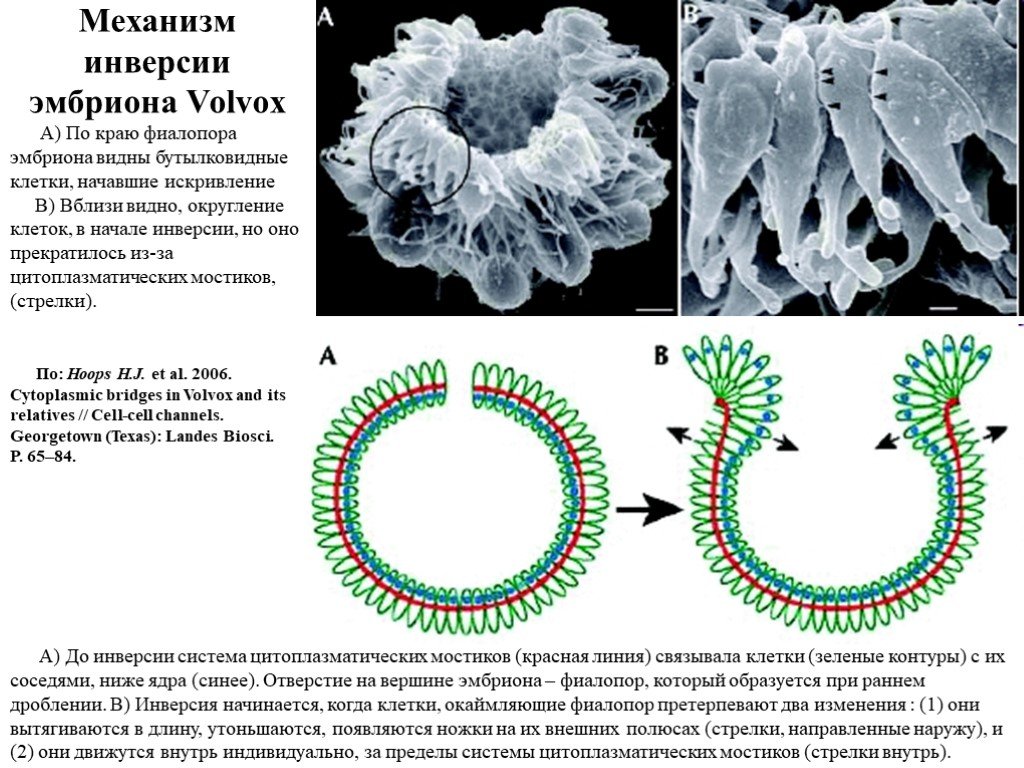
Слайд 18Механизм инверсии эмбриона Volvox
А) По краю фиалопора эмбриона видны бутылковидные клетки, начавшие искривление B) Вблизи видно, округление клеток, в начале инверсии, но оно прекратилось из-за цитоплазматических мостиков, (стрелки).
A) До инверсии система цитоплазматических мостиков (красная линия) связывала клетки (зеленые контуры) с их соседями, ниже ядра (синее). Отверстие на вершине эмбриона – фиалопор, который образуется при раннем дроблении. B) Инверсия начинается, когда клетки, окаймляющие фиалопор претерпевают два изменения : (1) они вытягиваются в длину, утоньшаются, появляются ножки на их внешних полюсах (стрелки, направленные наружу), и (2) они движутся внутрь индивидуально, за пределы системы цитоплазматических мостиков (стрелки внутрь).
По: Hoops H.J. et al. 2006. Cytoplasmic bridges in Volvox and its relatives // Cell-cell channels. Georgetown (Texas): Landes Biosci. P. 65–84.
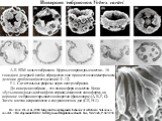
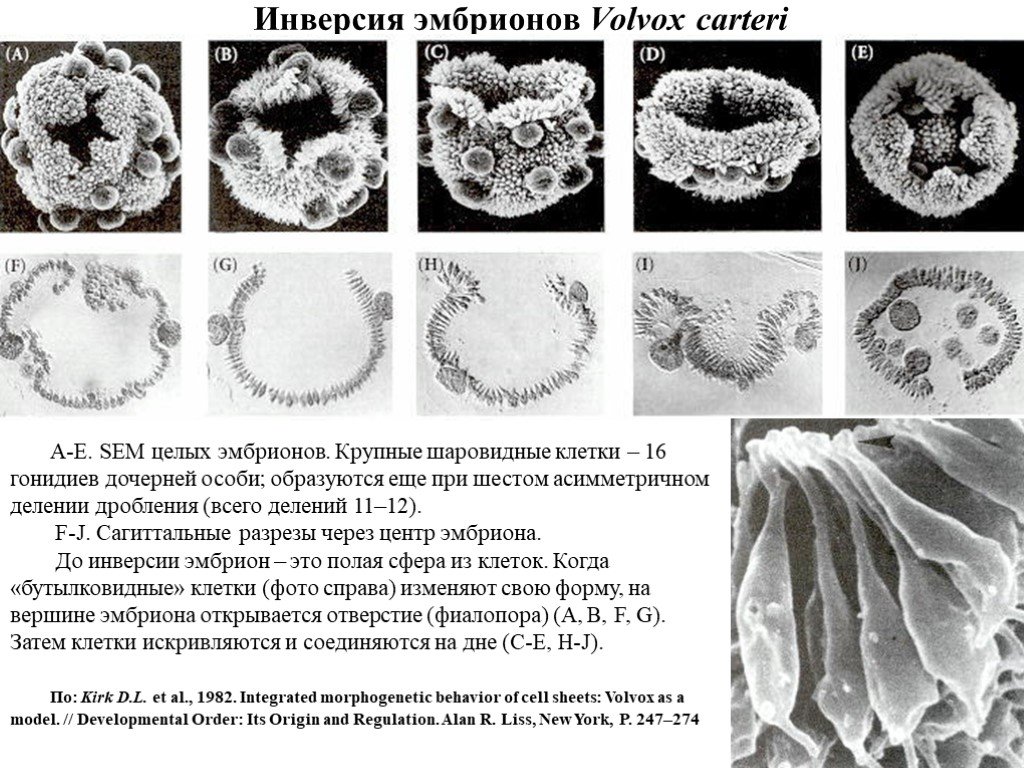
Слайд 19Инверсия эмбрионов Volvox carteri
A-E. SEM целых эмбрионов. Крупные шаровидные клетки – 16 гонидиев дочерней особи; образуются еще при шестом асимметричном делении дробления (всего делений 11–12). F-J. Сагиттальные разрезы через центр эмбриона. До инверсии эмбрион – это полая сфера из клеток. Когда «бутылковидные» клетки (фото справа) изменяют свою форму, на вершине эмбриона открывается отверстие (фиалопора) (A, B, F, G). Затем клетки искривляются и соединяются на дне (C-E, H-J). По: Kirk D.L. et al., 1982. Integrated morphogenetic behavior of cell sheets: Volvox as a model. // Developmental Order: Its Origin and Regulation. Alan R. Liss, New York, P. 247–274

Слайд 20Последовательность различных инверсионных процессов Volvocaceae
Схематически представлены стадии инверсии P. morum, V. tertius и V. globator. Показано поперечное сечение. Инверсия происходит вдоль передне-задней оси. В начале инверсии все передние полюса сверху, после инверсии эти полюса снизу. После конверсии они стали задними полюсами инвертированного эмбриона. Сторона клеток со жгутиками, которая лежит снаружи во взрослой конфигурации, показана черным. Области и направления движения слоев показаны малыми черными стрелками.
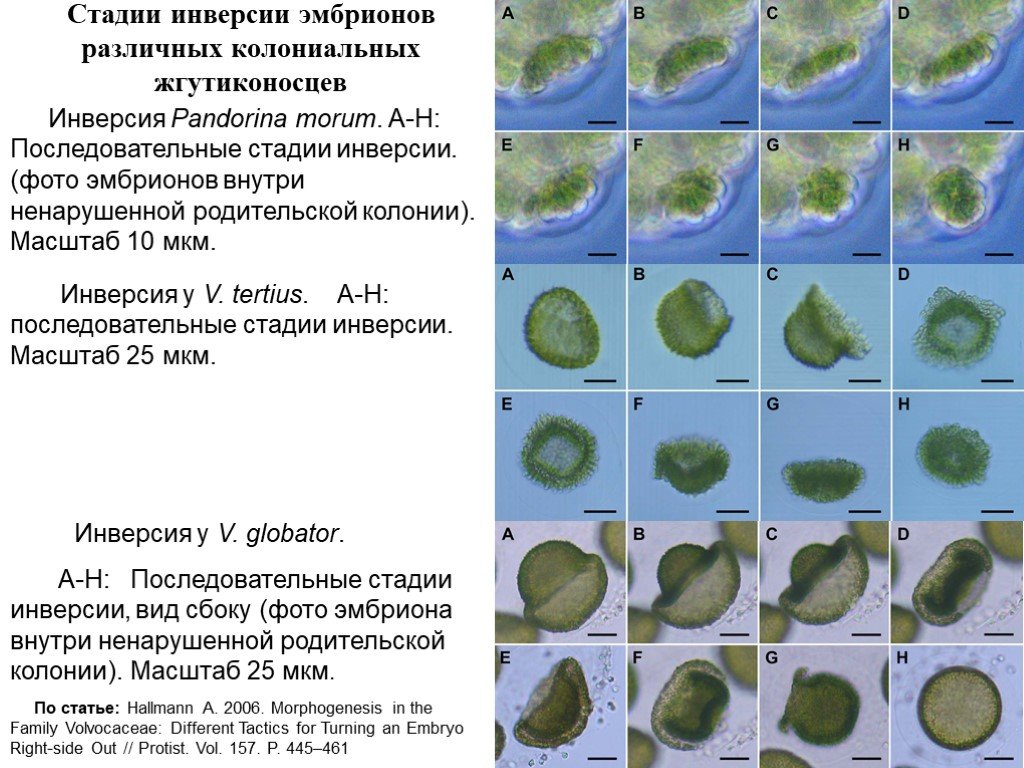
Слайд 21Стадии инверсии эмбрионов различных колониальных жгутиконосцев
Инверсия у V. globator. A-H: Последовательные стадии инверсии, вид сбоку (фото эмбриона внутри ненарушенной родительской колонии). Масштаб 25 мкм.
Инверсия у V. tertius. A-H: последовательные стадии инверсии. Масштаб 25 мкм.
Инверсия Pandorina morum. A-H: Последовательные стадии инверсии. (фото эмбрионов внутри ненарушенной родительской колонии). Масштаб 10 мкм.

Слайд 22Паразитизм и типы хозяев паразитов
Паразити́зм (от др.-греч. παράσιτος — «нахлебник») — один из видов сосуществования организмов. Это явление, при котором два и более организма, не связанные между собой филогенетически, генетически разнородны, сосуществуют в течение продолжительного периода времени, при этом они находятся в антагонистических отношениях. Паразит использует хозяина как источник питания, среды обитания.
Валентин Иванович Догель (1882 – 1955)
Окончательный хозяин – хозяин, в котором обитает половозрелая стадия паразита или происходит его размножение половым путем. Промежуточный хозяин – организм, в котором паразит проходит промежуточную стадию своего развития, часто связанную с бесполым размножением (но не окончательную стадию полового размножения). Дополнительный хозяин – организм, становящийся объектом нападения лишь при массовом размножении паразитов или при случайном заражении.

Слайд 23Учение о природной очаговости трансмиссивных заболеваний
Природная очаговость — учение, предложенное и обоснованное академиком Е. Н. Павловским для некоторых инфекционных болезней человека (так называемых трансмиссивных болезней). Характерной чертой этой группы болезней является то, что они имеют природные резервуары возбудителей среди диких животных (преимущественно грызунов) и птиц, среди которых постоянно существуют эпизоотии. Распространение же болезни происходит при посредстве кровососущих членистоногих. Так, клещи, зараженные от больных животных, нападая на здоровых, передают им инфекцию. Таким образом, возбудитель заболевания циркулирует в природе по цепи: животное — переносчик — животное. Характерной эпидемиологической особенностью болезней с природной очаговостью является строго выраженная сезонность заболеваний, что обусловлено биологией животных — хранителей инфекции в природе или переносчиков.
Евгений Никанорович Павловский (1884 – 1965)
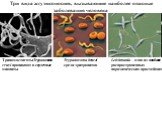
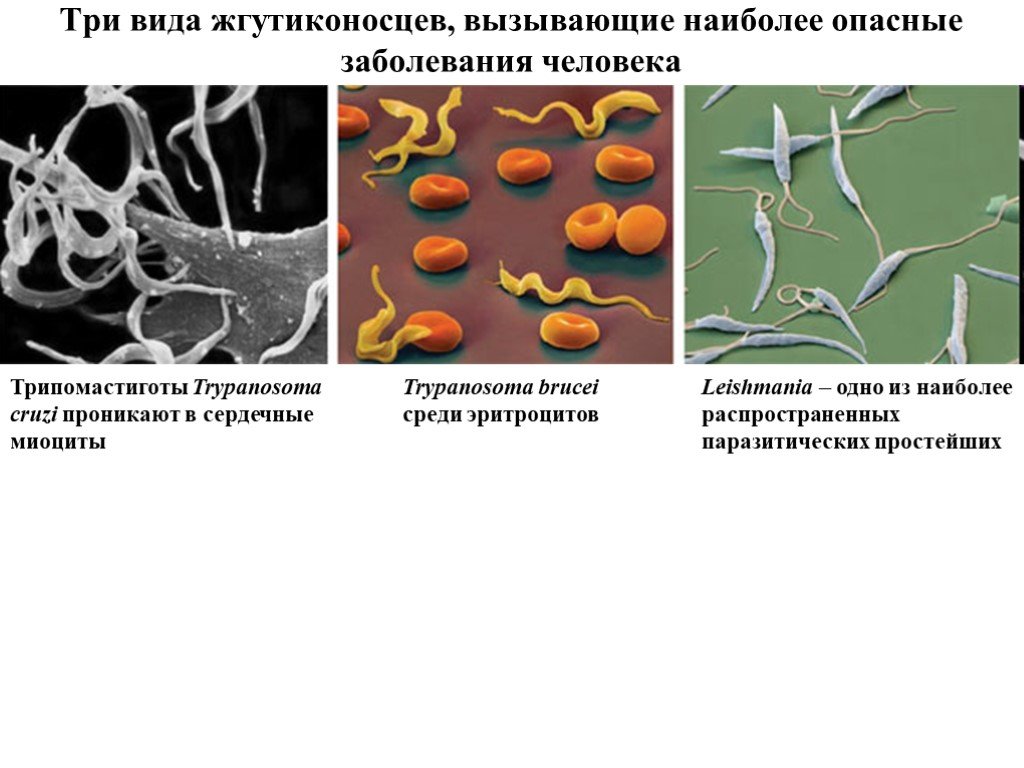
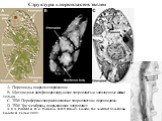
Слайд 24Три вида жгутиконосцев, вызывающие наиболее опасные заболевания человека
Trypanosoma brucei среди эритроцитов
Трипомастиготы Trypanosoma cruzi проникают в сердечные миоциты
Leishmania – одно из наиболее распространенных паразитических простейших
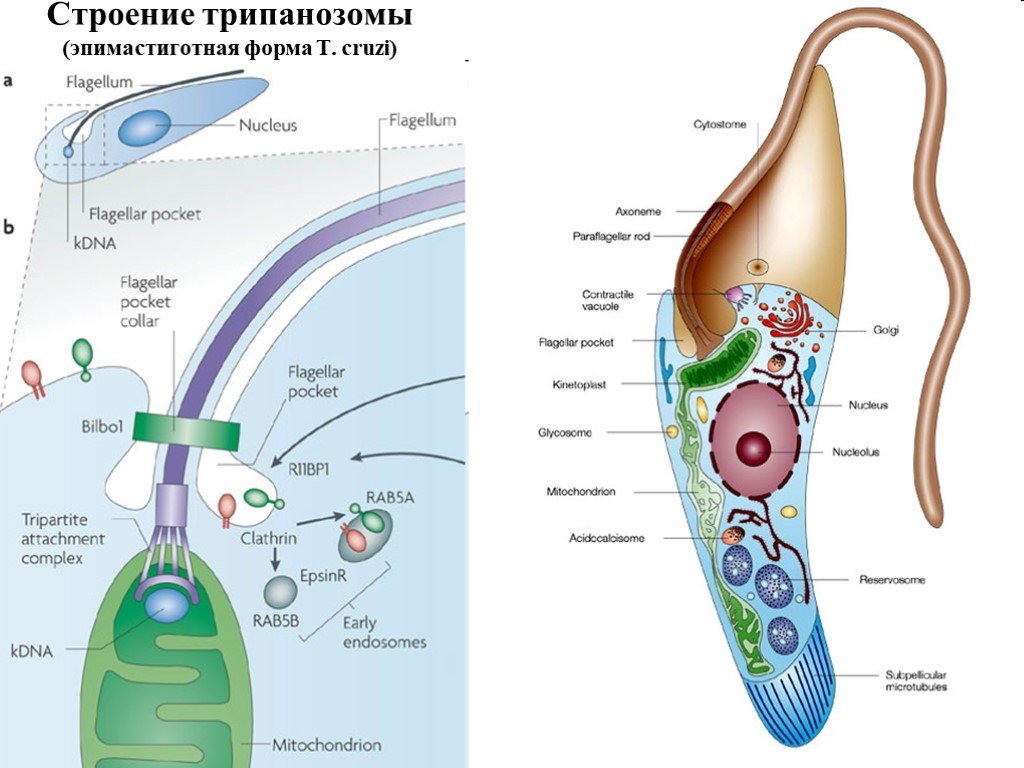
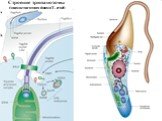
Слайд 25Строение трипанозомы (эпимастиготная форма T. cruzi)
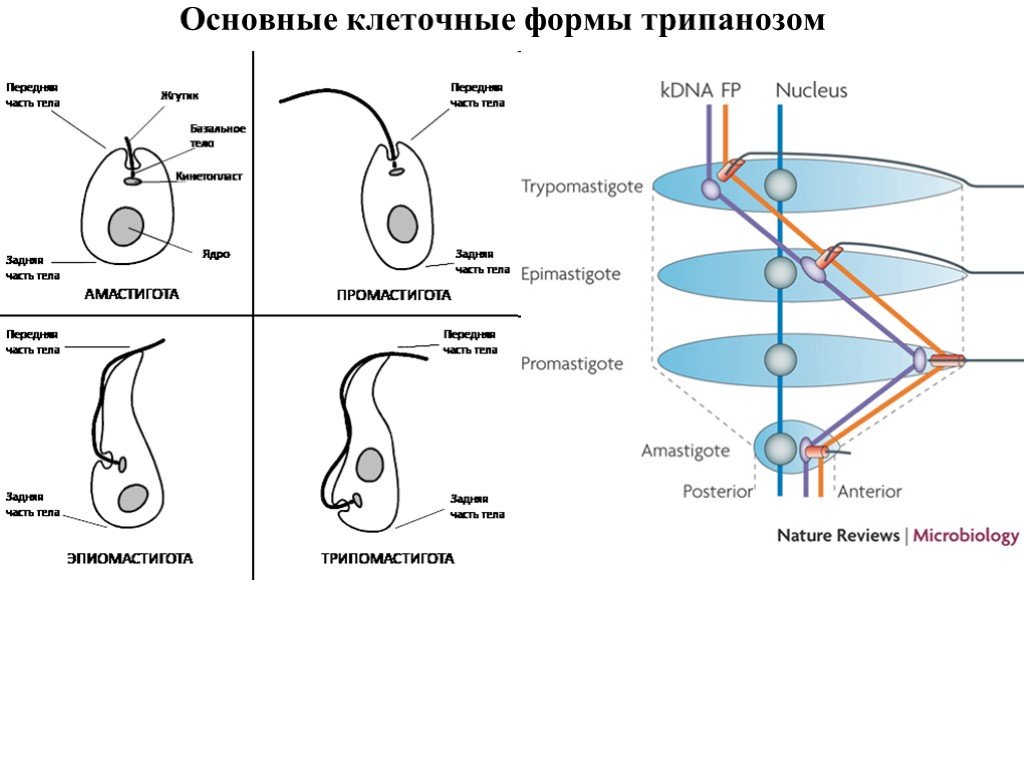
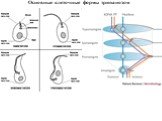
Слайд 26Основные клеточные формы трипанозом
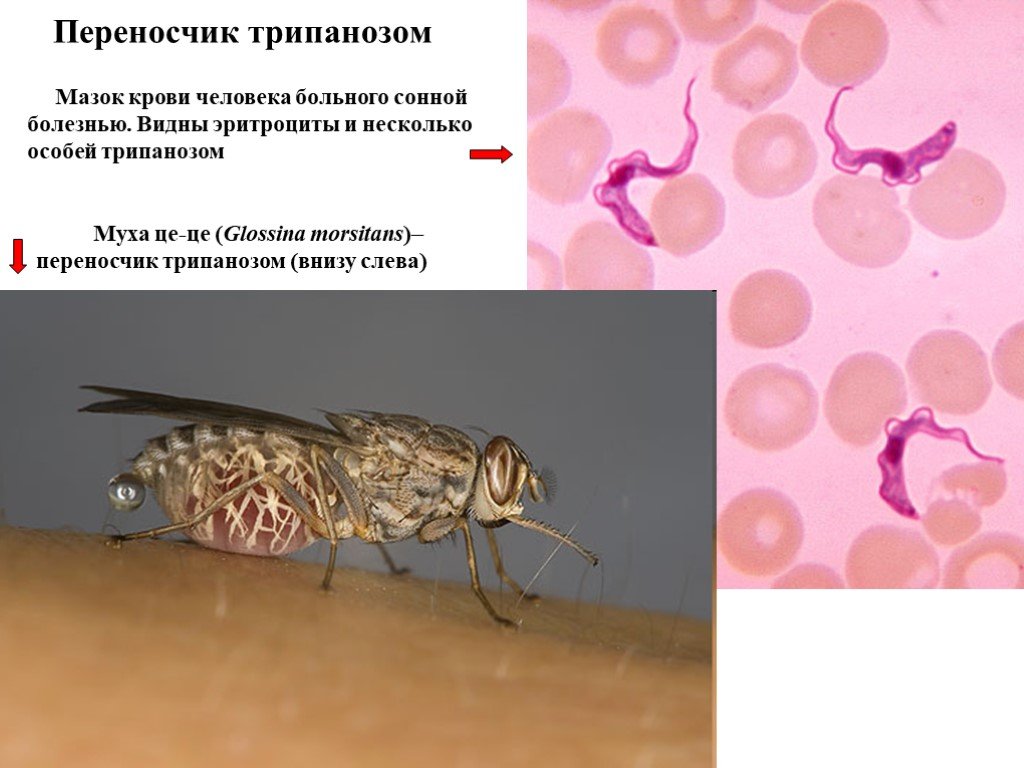
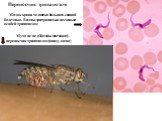
Слайд 27Переносчик трипанозом
Муха це-це (Glossina morsitans)– переносчик трипанозом (внизу слева)
Мазок крови человека больного сонной болезнью. Видны эритроциты и несколько особей трипанозом
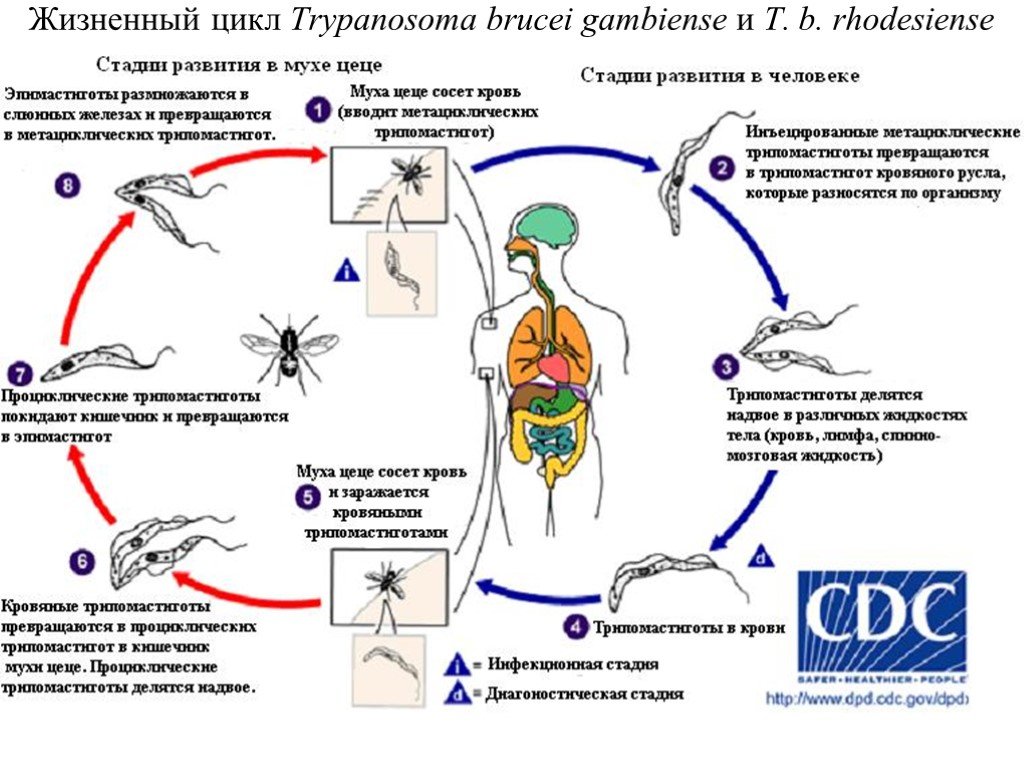
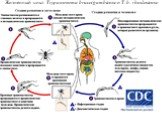
Слайд 28Жизненный цикл Trypanosoma brucei gambiense и T. b. rhodesiense
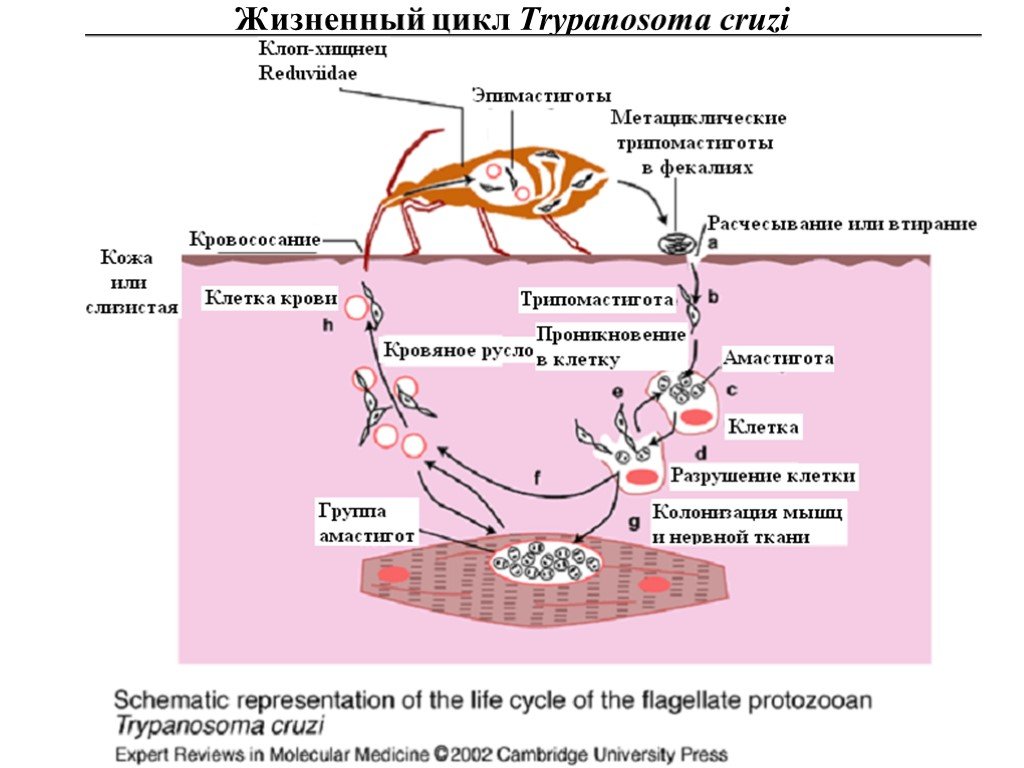
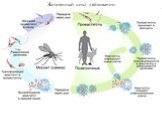
Слайд 29Жизненный цикл Trypanosoma cruzi
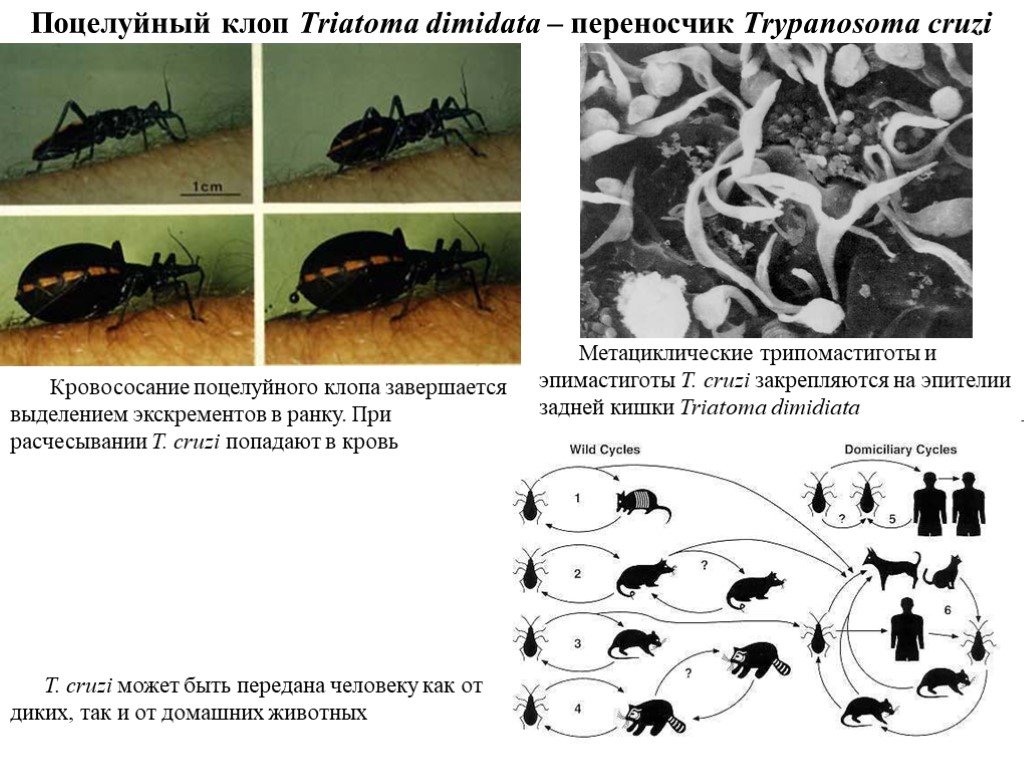
Слайд 30Поцелуйный клоп Triatoma dimidata – переносчик Trypanosoma cruzi
Метациклические трипомастиготы и эпимастиготы T. cruzi закрепляются на эпителии задней кишки Triatoma dimidiata
Кровососание поцелуйного клопа завершается выделением экскрементов в ранку. При расчесывании T. cruzi попадают в кровь
T. cruzi может быть передана человеку как от диких, так и от домашних животных
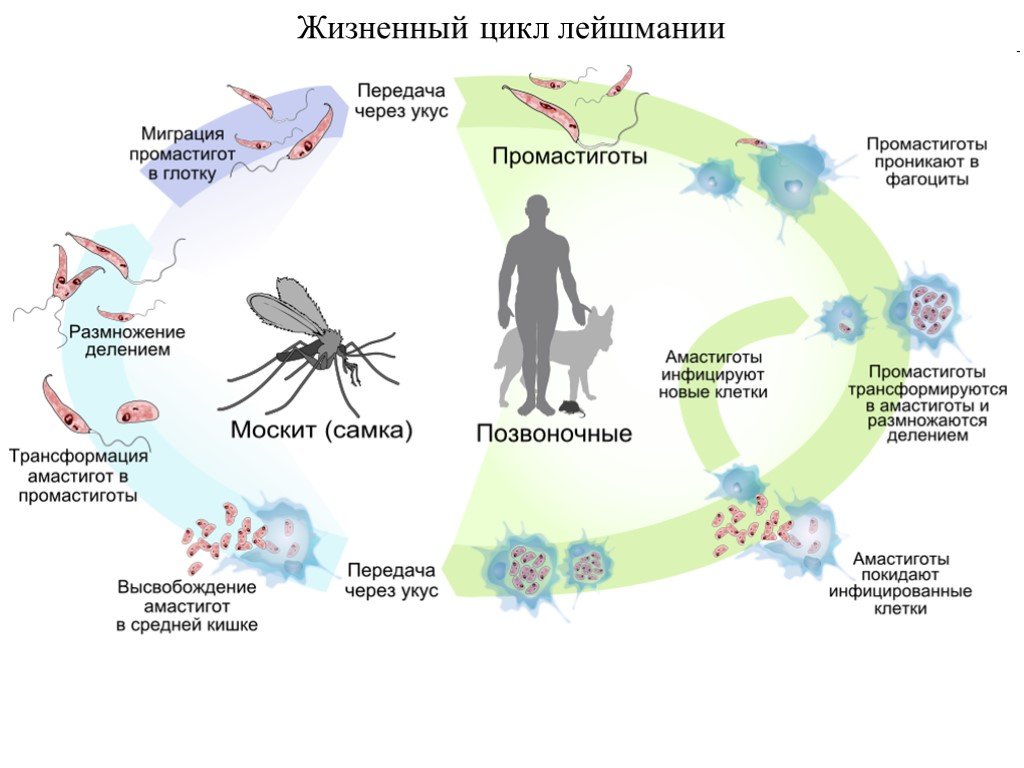
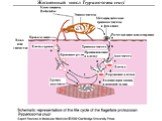
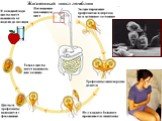
Слайд 31Жизненный цикл лейшмании
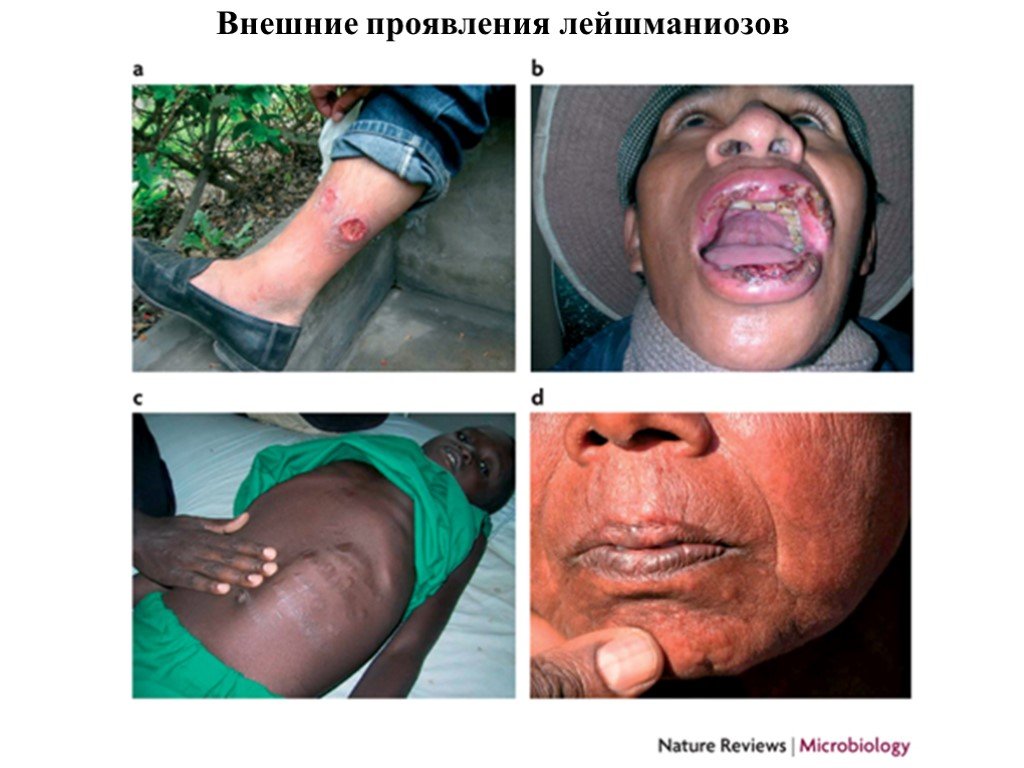
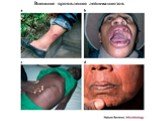
Слайд 32Внешние проявления лейшманиозов
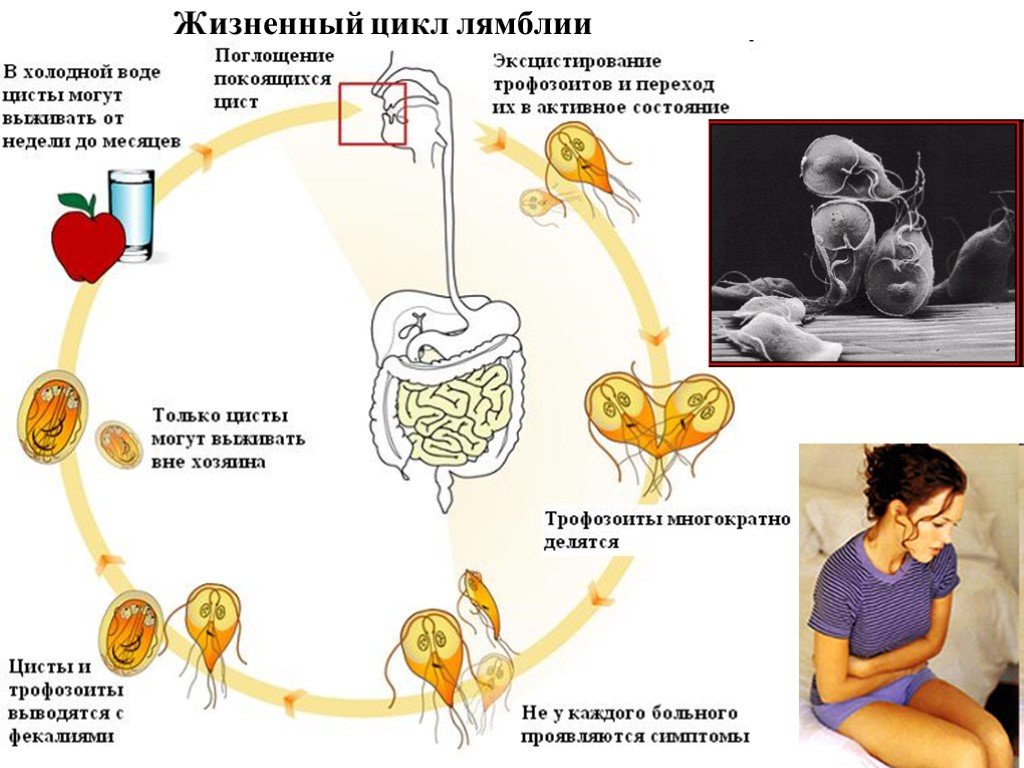
Слайд 33Жизненный цикл лямблии
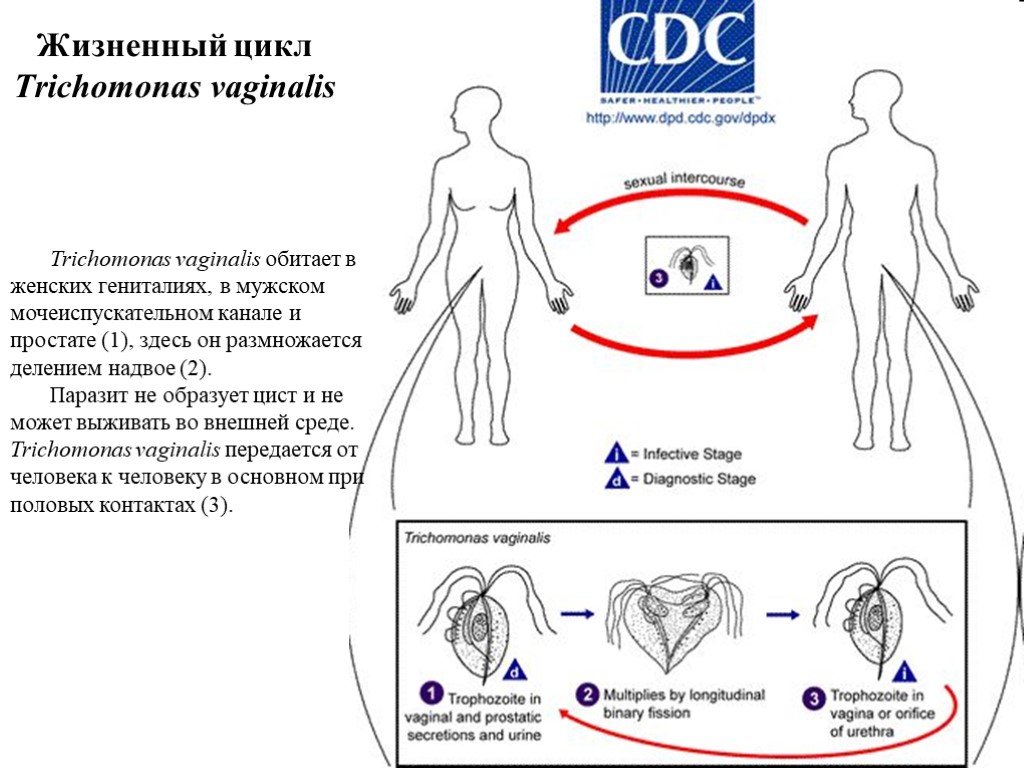
Слайд 34Жизненный цикл Trichomonas vaginalis
Trichomonas vaginalis обитает в женских гениталиях, в мужском мочеиспускательном канале и простате (1), здесь он размножается делением надвое (2). Паразит не образует цист и не может выживать во внешней среде. Trichomonas vaginalis передается от человека к человеку в основном при половых контактах (3).
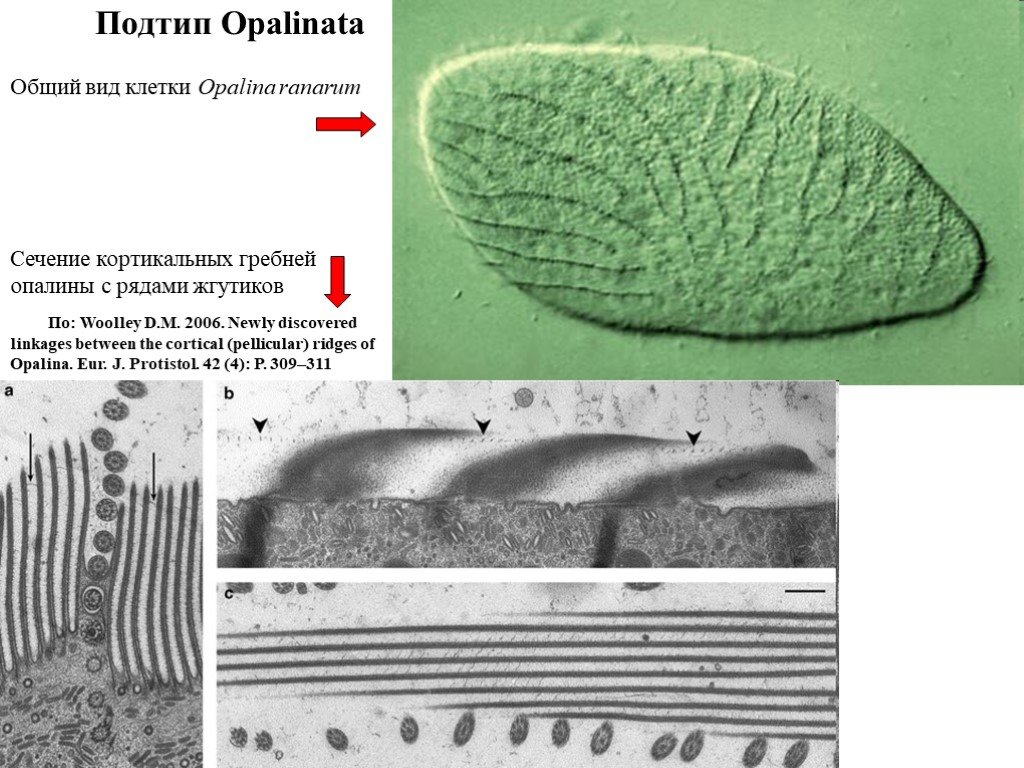
Слайд 35Подтип Opalinata
Сечение кортикальных гребней опалины с рядами жгутиков
Общий вид клетки Opalina ranarum
По: Woolley D.M. 2006. Newly discovered linkages between the cortical (pellicular) ridges of Opalina. Eur. J. Protistol. 42 (4): P. 309–311
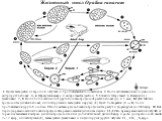
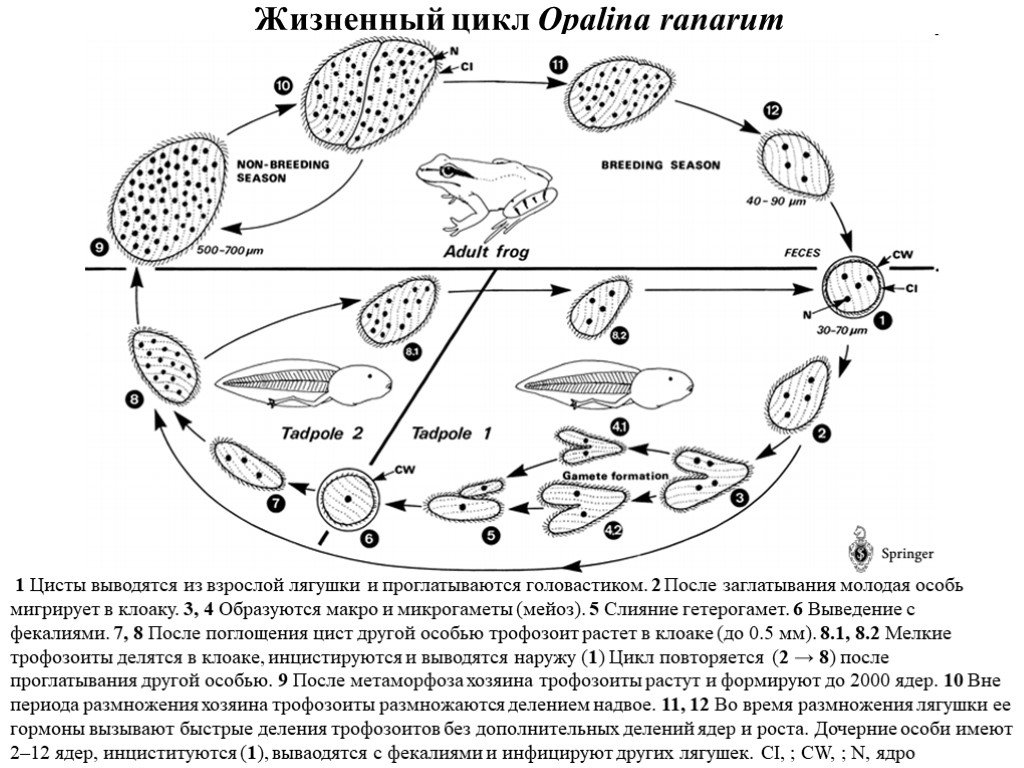
Слайд 36Жизненный цикл Opalina ranarum
1 Цисты выводятся из взрослой лягушки и проглатываются головастиком. 2 После заглатывания молодая особь мигрирует в клоаку. 3, 4 Образуются макро и микрогаметы (мейоз). 5 Слияние гетерогамет. 6 Выведение с фекалиями. 7, 8 После поглощения цист другой особью трофозоит растет в клоаке (до 0.5 мм). 8.1, 8.2 Мелкие трофозоиты делятся в клоаке, инцистируются и выводятся наружу (1) Цикл повторяется (2 → 8) после проглатывания другой особью. 9 После метаморфоза хозяина трофозоиты растут и формируют до 2000 ядер. 10 Вне периода размножения хозяина трофозоиты размножаются делением надвое. 11, 12 Во время размножения лягушки ее гормоны вызывают быстрые деления трофозоитов без дополнительных делений ядер и роста. Дочерние особи имеют 2–12 ядер, инциституются (1), вываодятся с фекалиями и инфицируют других лягушек. CI, ; CW, ; N, ядро
Слайд 37Noctiluca
Несколько особей ночесветок
Участки морской поверхности с высокой численностью ночесветок и молекула люцеферина