Конспект урока «НЕМЕТАЛЛЫ» по химии для 9 класса
Обобщение по теме: «НЕМЕТАЛЛЫ»
| Класс:9 |
| Программа: «Неорганическая химия - 9», авторы И.И.Новошинский, Н.С.Новошинская. |
| Учебник: И.И.Новошинский, Н.С.Новошинская. Химия 9 класс |
Цели урока:
Общеобразовательные:
- через систему познавательных задач систематизировать и обобщить знания учащихся о неметаллах;
- Знать общие физические и химические свойства неметаллов и их специфику;
- уметь записывать уравнения химических реакций, характеризующих химические свойства неметаллов и их соединений в ионном и окислительно-восстановительном виде.
Развивающие:
-развивать умение работать в атмосфере поиска, творчества, дать каждому учащемуся возможность достичь успеха;
-умение давать самооценку деятельности на уроке;
-ставить цели самообразовательной деятельности;
-создать условия для развития у учащихся умения анализировать результаты лабораторных исследований, практических умений работы с реактивами, оборудованием в соответствии с правилами Т.Б.;
-умение пользоваться справочной литературой.
Воспитательные:
-создать условия для формирования культуры умственного и практического труда, интереса к знаниям;
-воспитание воли и настойчивости для достижения конкретных результатов.
Задачи:
- через систему познавательных задач обобщить и систематизировать знания учащихся по теме: неметаллы
- формирование ключевых компетенций ( обобщать, систематизировать, думать, анализировать результаты лабораторных исследований критически оценивать информацию, адаптироваться).
- развитие коммуникативных качеств личности, дисциплины учебного труда, ответственность за результаты своего труда.
Ожидаемый результат:
Каждый ученик должен знать как общие физические и химические свойства свойства неметаллов, так и их специфику, уметь писать уравнения химических реакций, находить причинно-следственные связи, формулировать выводы на основании знаний, экспериментальных данных и жизненного опыта, доказывать их правильность, рефлексировать свою деятельность.
ХОД УРОКА
I. ОРГАНИЗАЦИОННЫЙ ЭТАП
II. ОБОБЩЕНИЕ И СИСТЕМАТИЗАЦИЯ ТЕМЫ
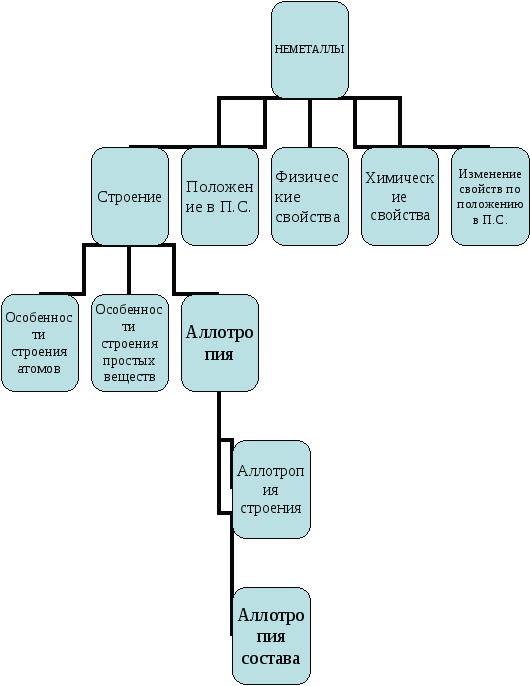
1. ОБОБЩЕНИЕ ЗНАНИЙ ПО ОБЩЕЙ ХАРАКТЕРИСТИКЕ НЕМЕТАЛЛОВ.
( анализ схемы, используя устные ответы учащихся, использование приложения №1).
Расшифровка таблицы:
1. Положение в П.С
-
в правом верхнем углу относительно диагонали B-At в главных подгруппах.
2. Строение:
-
Особенности строения атомов
– на внешнем энергетическом уровне 4-8 электронов (больше, чем у металлов)
- маленький радиус атомов
- относятся к S - и P – элементам
-
Особенности строения простых веществ
- имеют ковалентную неполярную связь
- атомную (алмаз, Si) или молекулярную (O2, I2)кристаллическую решетку.
-
Аллотропия
- аллотропия строения ( разное строение кристаллических решеток: алмаз, графит)
- аллотропия состава (разный состав молекул: O2, O3)
3. Изменение свойств по Периодической системе:
-
В периоде Ra уменьшается, неметаллические свойства усиливаются
-
В подгруппе Ra увеличивается, неметаллические свойства уменьшаются.
4. Физические свойства:
Атомные кристаллические решетки - прочные, молекулярные – непрочные, поэтому вещества: (реактивы: сера, уголь, иод )
| С молекулярной кристаллической решеткой | |
| твердое агрегатное состояние; очень высокая температура плавления; нерастворимы в воде | твердые, жидкие, газообразные; низкие температура плавления и кипения; нерастворимы или мало растворимы в воде |
В отличие от металлов неметаллы хрупкие, как правило не проводят тепло и электричество, из-за отсутствия свободных электронов в кристаллических решетках.
5. Химические свойства:
Так как в простых веществах – неметаллах степень окисления 0 (промежуточная), то в ОВР они проявляют окислительно-восстановительную двойственность (кроме F2 –окислитель)
| Восстановитель | |
| N2 + 3H2 = 2NH3 S + Fe = FeS H2 + 2Na = 2NaH 3C + 4AI = AI4C3 | N2 + O2 = 2NO S + O2 = SO2 H2 + CuO = Cu + H2O C + ZnO = Zn + CO |
2. СИСТЕМАТИЗАЦИЯ ЗНАНИЙ
«НЕМЕТАЛЛЫ И ИХ СОЕДИНЕНИЙ»
(класс делится на группы, каждая группа получает карточку с заданиями)
S----SO2------SO3------H2SO4------BaSO4 ----- X1+X2+X3 6. Провести качественную реакцию на сульфат ион (правила ТБ) 7. Задача Какой объем сернистого газа (н. у.) образуется при обжиге 485 кг цинковой обманки, содержащей в качестве примеси 20% оксида кремния (IV)? |
|
|
С----СO2------CaCO3-----Ca(HCO3)2-----CaCI2 Si-----Na2SiO3 6. Провести качественную реакцию на карбонат ион (правила ТБ) 7. Задача Сколько литров углекислого газа выделится из 120 г мрамора, содержащего 18% примесей, при действии на него избытка соляной кислоты. |
|
|
N2----NH3-----NO------NO2------HNO3 (к)------ X1+X2+X3 6. Провести качественную реакцию на нитрат ион (правила ТБ) 7. Задача При прокаливании 30г известняка получены 16г оксида кальция. Рассчитайте массу и массовую долю (%) карбоната кальция в известняке. |
|
|
| 1. Положение О в Периодической системе, строение атома и простого вещества.
O2-----O3-----O2------Х------СО ZnO 6. Получить и распознать кислород используя перманганат калия (KMnO4) (правила ТБ) 7. Задача В 735 мл 20% раствора серной кислоты растворили 30 мл аммиака. Рассчитайте массу образовавшейся соли. |
|
|
ZnCI2-----HCI------KCI-----CI2----I2------HI 6. Провести качественную реакцию на хлорид ион (CI ) (правила ТБ) 7. Задача В 400г 25% раствора едкого калия растворили 45 л углекислого газа. Рассчитайте массу образовавшейся соли. |
3. ОТЧЕТ КАЖДОЙ ГРУППЫ ПЕРЕД КЛАССОМ.
III. ЗАКЛЮЧЕНИЕ
1. ДОМАШНЕЕ ЗАДАНИЕ на основе материала учебника.
2. Оценочный этап:
(Оценивается деятельность каждого учащегося.)
3. РЕФЛЕКСИЯ
Достигли ли мы поставленной цели урока? Чему вы научились? Был ли результативным наш урок?
Приложение №1
Здесь представлен конспект к уроку на тему «НЕМЕТАЛЛЫ», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия (9 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.
