Слайд 1Методы очистки питьевой воды
Выполнил: Сабадашов К.С. ученик 11 «Б» гимназии №25 Руководитель: Безик Ю.Б. г. Краснодар
Слайд 2Цели и задачи исследования:
– знакомство с теорией по данной проблеме; – проведение экологического мониторинга состояния питьевой воды в выбранных районах; – выявление основных загрязнителей воды; – установление соответствия качества питьевой воды санитарным нормам; – сопоставление качества исследуемой воды; – определение химических показателей дополнительно очищенной воды; – составление таблиц и графиков по данному материалу
Слайд 3Что такое питьевая вода?
Питьевой считается вода, пригодная к употреблению внутрь и отвечающая критериям качества - то есть вода безопасная и приятная на вкус. В мире эти критерии были утверждены Европейским Сообществом, а затем приняты с некоторой адаптацией каждой из стран. В нашей стране c 1 января 2002 года действует документ с названием "Санитарные правила и нормативы СанПиН 2.1.4.1074-01".

Слайд 4Без воды наше существование невозможно. А без хорошей воды невозможно хорошее существование.
Вода доставляет в клетки организма питательные вещества и уносит отходы жизнедеятельности, участвует в процессе терморегуляции и дыхания. Для нормальной работы всех систем человеку необходимо как минимум 1,5 литра воды в день. Парадоксальный факт: вода необходима для жизни, но она же является и одной из главных причин заболеваемости в мире. Опасность употребления некачественной воды может быть микробиологической: вода в природе содержит множество микроорганизмов, некоторые из которых вызывают у человека такие заболевания, как холера, тиф, гепатит или гастроэнтерит. Загрязнение воды может быть и химическим. При этом последствия употребления грязной воды могут наступить как немедленно, так и через несколько лет.

Слайд 5Основные методы очистки воды для хозяйственно-питьевого водоснабжения
Проблема очистки воды охватывает вопросы физических, химических и биологических ее изменений в процессе обработки с целью сделать ее пригодной для питья, т.е. очистки и улучшения ее природных свойств. Основными методами очистки воды для хозяйственно-питьевого водоснабжения являются осветление, обесцвечивание и обеззараживание.

Слайд 6Осветление воды путем осаждения взвешенных веществ
Эту функцию выполняют осветлители, отстойники и фильтры. В осветлителях и отстойниках вода движется с замедленной скоростью, происходит выпадение в осадок взвешенных частиц. В целях осаждения мельчайших коллоидных частиц, к воде прибавляют раствор коагулянта (сернокислый алюминий, железный купорос или хлорное железо). В результате образуются хлопья, увлекающие при осаждении взвеси и коллоидные вещества.
Коагуляцией примесей воды называют процесс укрупнения мельчайших коллоидных и взвешенных частиц, происходящий вследствие их взаимного слипания под действием сил молекулярного притяжения.
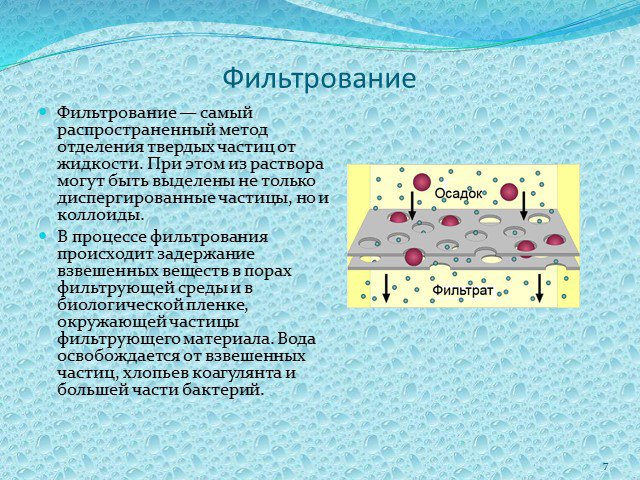
Слайд 7Фильтрование
Фильтрование — самый распространенный метод отделения твердых частиц от жидкости. При этом из раствора могут быть выделены не только диспергированные частицы, но и коллоиды. В процессе фильтрования происходит задержание взвешенных веществ в порах фильтрующей среды и в биологической пленке, окружающей частицы фильтрующего материала. Вода освобождается от взвешенных частиц, хлопьев коагулянта и большей части бактерий.
Слайд 8Обесцвечивание
Обесцвечивание воды, т. е. устранение или обесцвечивание различных окрашенных коллоидов или полностью растворенных веществ может быть достигнуто коагулированием, применением различных окислителей (хлор и его производные, озон, перманганат калия) и сорбентов (активный уголь, искусственные смолы).

Слайд 9Обеззараживание воды (дезинфекция)
Так как полного освобождения воды от болезнетворных бактерий ни отстаивание, ни фильтрование не дают, с целью дезинфекции применяют следующие способы: введение в воду сильных окислителей (хлор, йод, марганцево-кислый калий, перекись водорода, гипохлорит натрия и кальция, жидкий хлор и хлорную известь), способных убивать ферменты бактериальных клеток; нагревание воды до температуры 80 °С (пастеризация) — 100 °С (стерилизация); облучением воды ультрафиолетовыми лучами; озонированием; воздействием ультразвуком; введением в воду серебра или других металлов, обладающих олигодинамическим действием на микроорганизмы. Практическое применение нашли 1, 3 и 4-й методы.

Слайд 10Для устранения запаха хлора к обрабатываемой воде прибавляют одновременно с хлором в небольших количествах аммиак (аммонизация воды). Хлор, введенный в воду, образует хлорноватистую кислоту и соляную кислоту по уравнению Сl2 + Н2О = = НОСl + НСl. Хлорноватистая кислота НОСl — соединение нестойкое, диссоциирующее с образованием гипохлоритного иона ОСl. При этом окислительное действие на органические вещества, в том числе и бактерии, проявляют как хлорноватистая кислота, так и гипохлоритный ион. Соляная кислота соединяется с карбонатами, находящимися в воде.
Слайд 11Дезодорация воды
Для удаления из воды веществ, вызывающих нежелательные привкусы и запахи, применяют следующие методы ее обработки: аэрацию (основана на летучести большинства веществ, обуславливающих привкусы и запахи); окисление хлором, озоном, перманганатом калия и другими окислителями (для удаления из воды запахов, обусловленных жизнедеятельностью микроорганизмов и водорослей); сорбцию активным углем.
Слайд 12Ступени водоочистки
Учитывая состав водопроводной воды, которая зачастую содержит хлориды, фториды, сульфиды, сульфаты, металлы, хлор и хлорорганические соединения, а также промышленные загрязнения в виде хрома, никеля, ртути, свинца, мышьяка, меди, радионуклидов, большинство производителей предлагают фильтры многоступенчатой водоочистки. В процессе прохождения через такой фильтр на каждой ступени очистки вода теряет те или иные примеси.
Слайд 131-ая ступень - это механическая очистка воды, в процессе которой удаляются такие инородные частицы, как песок, ил, ржавчина. Осуществляется она с помощью полипропиленовой сетки, в зависимости от размеров отверстий в которой удерживаются только примеси (микрофильтрация) или примеси и бактерии (ультрафильтрация).

Слайд 142-ая ступень - удаление хлора, пестицидов, запахов. Происходит адсорбция, то есть поглощение частиц в порах какого-либо материала. Самым распространенным адсорбентом является природный фильтрант уголь, также используются синтетические волокна. Уголь очищает, поглощая остаточный хлор, органические соединения и споры бактерий, и улучшает - вкус, запах, цвет питьевой воды . Многие производители применяют активированный уголь из скорлупы кокоса, адсорбционная способность которого в 4 раза выше. Чтобы предотвратить размножение бактерий внутри фильтра активированный уголь покрывают слоем серебра. В некоторых фильтрах используется полимерное углеродное волокно аквален - смесь угля и синтетических материалов.
Слайд 153-я ступень - умягчение воды и ее освобождение от тяжелых металлов - ионный обмен. Помимо всего вышесказанного, мягкая вода в несколько раз улучшает вкус чая, кофе и других напитков, а также более пригодна для умывания и применения в быту.
Слайд 16Методы очистки воды
Существует несколько методов очистки воды, но все они входят в три группы методов: - механические методы; - физико-химические методы; - биологические методы.
Слайд 17Наиболее дешевая - механическая очистка - применяется для выделения взвесей. Основные методы: процеживание, отстаивание и фильтрование. Применяются, как предварительные этапы. Химическая очистка применяется для выделения из сточных вод растворимых неорганических примесей. При обработке сточных вод реагентами происходит их нейтрализация, выделение растворенных соединений, обесцвечивание и обеззараживание стоков. Физико-химическая очистка применяется для очистки сточных вод от грубо- и мелкодисперсионных частиц, коллоидных примесей, растворенных соединений. Высокопроизводительный и в то же время дорогой способ очистки. Биологические методы применяются для очистки от растворенных органических соединений. Метод основан на способности микроорганизмов разлагать растворенные органические соединения.

Слайд 18В настоящее время из общего количества сточных вод механической очистки подвергается 68% всех стоков, физико-химической- 3%, биологической - 29%. В перспективе предполагается повысить долю очистки биологическим методом до 80%, что улучшит качество очищаемой воды. Основным методом повышения качества очистки вредных выбросов предприятиям при рыночной экономике является система штрафов, а также система плат за пользование очистными сооружениями.

Слайд 19Исследование качества питьевой воды в г. Краснодаре
Объектом исследования выбрана вода микрорайон Комсомольский, Юбилейный, Черёмушки. Задачи исследования: – знакомство с теорией по данной проблеме; – проведение экологического мониторинга состояния питьевой воды в выбранных районах; – выявление основных загрязнителей воды; – установление соответствия качества питьевой воды санитарным нормам; – сопоставление качества исследуемой воды; – определение химических показателей дополнительно очищенной воды; – составление таблиц и графиков по данному материалу

Слайд 20Органолептические показатели воды. Содержание взвешенных частиц.
Этот показатель качества воды определяется фильтрованием воды через бумажный фильтр и последующим высушиванием осадка на фильтре в сушильном шкафу до постоянной массы. Для анализа берется 500 мл. воды. Фильтр перед работой взвешивается. После фильтрования осадок с фильтром высушивается до постоянной массы при 105ْС, охлаждается в эксикаторе и взвешивается. Весы должны обладать высокой чувствительностью, лучше использовать аналитические весы. Содержание взвешенных веществ в мг/л в испытуемой воде определяется по формуле: (m1 – m2) • 1000/V, где m1 – масса бумажного фильтра с осадком взвешенных частиц, г; m2 – масса бумажного фильтра до опыта, г; V – объем воды для анализа, л. ПДК = 10мг/г.

Слайд 21Цвет (окраска)
При загрязнении водоема стоками промышленных предприятий вода может иметь окраску, не свойственную цветности природных вод. Для источников хозяйственно-питьевого водоснабжения окраска не должна обнаруживаться в столбике высотой 20 см, для водоемов культурно-бытового назначения – 10 см. Диагностика цвета – один из показателей состояния водоема. Для определения цветности воды используется стеклянный сосуд и лист белой бумаги. В сосуд набирается вода и на белом фоне бумаги определяется ее цвет (голубой, зеленый, серый, желтый, коричневый) – показатель определенного вида загрязнения.

Слайд 22Прозрачность
Прозрачность воды зависит от нескольких факторов: количества взвешенных частиц ила, глины, песка, микроорганизмов, содержания химических соединений. Для определения прозрачности воды используется прозрачный мерный цилиндр с плоским дном, в который наливается вода, подкладывается под цилиндр на расстоянии 4 см от его дна шрифт, высота букв которого 2 мм, а толщина линий букв – 0,5 мм, и сливается вода до тех пор, пока сверху через слой воды не будет виден этот шрифт. Измеряется высота столба оставшейся воды линейкой и выражается степень прозрачности в сантиметрах. При прозрачности воды менее 3 см водопотребление ограничивается. Уменьшение прозрачности природных вод свидетельствует об их загрязнении.

Слайд 23Запах
Запах воды обусловлен наличием в ней пахнущих веществ, которые попадают естественным путем и со сточными водами. Запах воды водоемов, обнаруживаемый непосредственно в воде или (водоемов хозяйственно-питьевого назначения) после ее хлорирования, не должен превышать 2 баллов. Определение основано на органолептическом исследовании характера и интенсивности запахов воды при 20 ˚ и 60˚С.
Слайд 24Характер и род запаха воды естественного происхождения
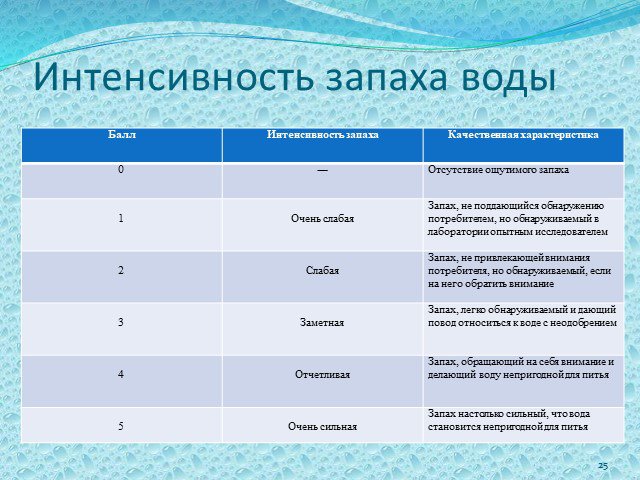
Слайд 25Интенсивность запаха воды
Слайд 26
Слайд 27Определение качества воды методами химического анализа. Водородный показатель (pH).
Питьевая вода должна иметь нейтральную реакцию (pH около 7). Значение pH воды водоемов хозяйственного, питьевого, культурно-бытового назначения регламентируется в пределах 6,5 – 8,5. Оценивать значение pH можно разными способами. 1. Приближенное значение pH определяют следующим образом. В пробирку наливают 5 мл исследуемой воды, 0,1 мл универсального индикатора, перемешивают и по окраске раствора определяют pH: розово-оранжевая – pH около 5; светло-желтая – 6; зеленовато-голубая – 8. 2. Можно определить pH с помощью универсальной индикаторной бумаги, сравнивая ее окраску со шкалой.

Слайд 28Жесткость воды
Различают общую, временную и постоянную жесткость воды. Общая жесткость обусловлена главным образом присутствием растворимых соединения кальция и магния в воде. Временная жесткость иначе называется устранимой или карбонатной. Она обусловлена наличием гидрокарбонатов кальция и магния. Постоянная (некарбонатная) жесткость вызвана присутствием других растворимых солей кальция и магния. Общая жесткость варьирует в широких пределах в зависимости от типа пород и почв, слагающих бассейн водосбора, а также от сезона года. Значение общей жесткости в источниках централизованного водоснабжения допускается до 7 ммоль • экв./л, в отдельных случаях по согласованию с органами санитарно – эпидемиологической службы – до 10 ммоль • экв./л. При жесткости до 4 ммоль • экв./л вода считается мягкой, 4 – 8 ммоль • экв./л – средней жесткости, 8 – 12 ммоль • экв./л – жесткой, более 12 ммоль • экв./л – очень жесткой. Методами химического анализа обычно определяют жесткость общую (Жо) и карбонатную (Жк), а некарбонатную (Жн) рассчитывают как разность Жо – Жк.

Слайд 29Обнаружение катионов свинца.
Реагент: хромат калия (10 г K2CrO4 растворить в 90 мл H2O). Условия проведения реакции 1. pH = 7,0. 2. Температура комнатная. 3. Осадок нерастворим в воде, уксусной кислоте и аммиаке. Выполнение анализа В пробирку помещают 10 мл пробы воды, прибавляют 1 мл раствора реагента. Если выпадает желтый осадок, то содержание катионов свинца более 100 мг/л: Pb2+ + CrO2- = PbCrO4 жёлтый

Слайд 30Обнаружение катионов железа.
Реагенты: тиоцианат аммония (20 г NH4CNS растворить в дистиллированной воде и довести до 100 мл); азотная кислота (конц.); перекись водорода (ω (%) = 5 %). Условия проведения реакции 1. pH 3,0 2. Температура комнатная. 3. Действием пероксида водорода ионы Fe (II) окисляют до Fe (III). Выполнение анализа К 10 мл пробы воды добавляют 1 каплю азотной кислоты, затем 2 – 3 капли пероксида водорода и вводят 0,5 мл тиацианата аммония. При концентрации ионов железа более 2,0 мг/л появляется розовое окрашивание, при концентрации более 10 мг/л окрашивание становится красным: Fe3+ + 3CNS– = Fe(CNS)3 красный

Слайд 31Обнаружение хлорид – ионов.
Реагенты: нитрат серебра (5 г AgNO3 растворить в 95 мл воды); азотная кислота (1:4). Условия проведения реакции 1. pH 7,0 2. Температура комнатная. Выполнение анализа К 10 мл пробы воды прибавляют 3 – 4 капли азотной кислоты и приливают 0,5 мл раствора нитрата серебра. Белый осадок выпадает при концентрации хлорид – ионов более 100 мг/л: Cl– + Ag+ = AgCl белый
Слайд 32Обнаружение сульфат – ионов.
Реагент: хлорид бария (10 г BaCl2 x 2H2O растворить в 90 г H2O); соляная кислота (16 мл HCl (p = 1,19) растворить в воде и довести объем до 100мл). Условия проведения реакции 1. pH 7,0. 2. Температура комнатная. 3. Осадок нерастворим в азотной и соляной кислотах. Выполнение анализа. К 10 мл пробы воды прибавляют 2 – 3 капли соляной кислоты и приливают 0,5 мл раствора хлорида бария. При концентрации сульфат – ионов более 10 мг/л выпадает садок: Ba2+ + SO42- = BaSO4 белый
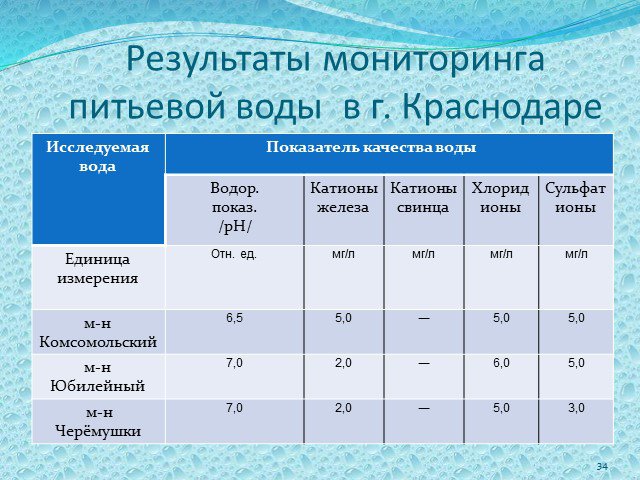
Слайд 33Проведено исследование питьевой воды в следующих точках города: – М.-Н. Юбилейный – М.-Н Комсомольский – М.-Н. Черёмушки
Слайд 34Результаты мониторинга питьевой воды в г. Краснодаре
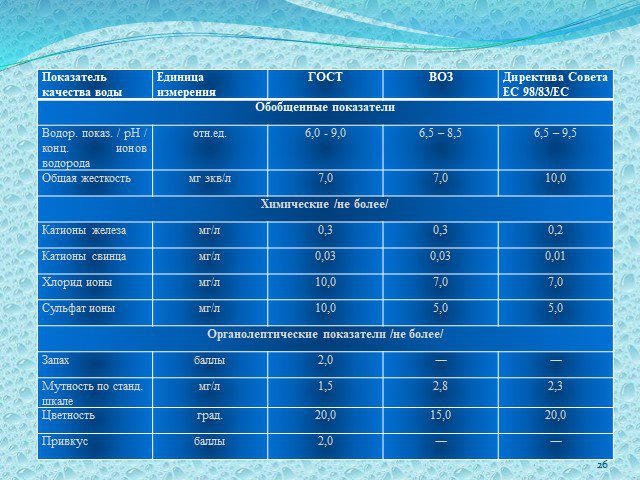
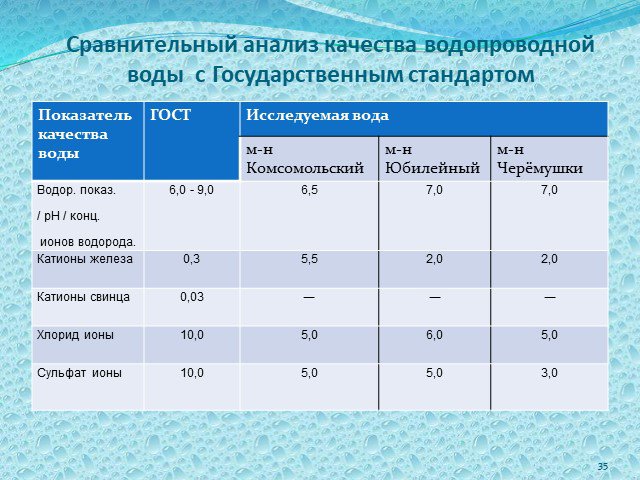
Слайд 35Сравнительный анализ качества водопроводной воды с Государственным стандартом
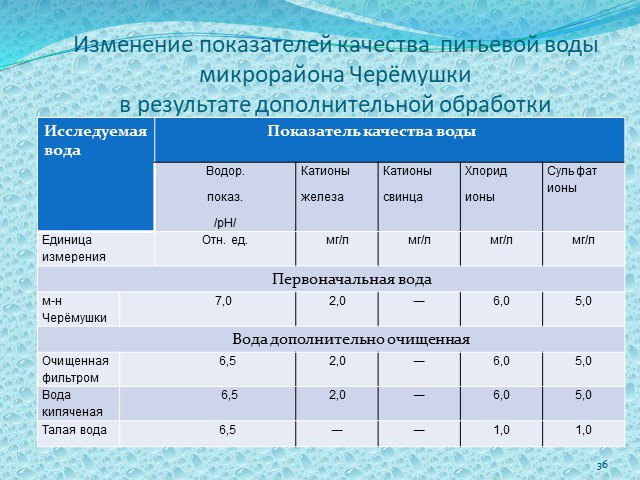
Слайд 36Изменение показателей качества питьевой воды микрорайона Черёмушки в результате дополнительной обработки
Слайд 37В результате исследований я выяснил, что в воде, прошедшей дополнительную обработку фильтром и кипячением, снижается кислотность. Наиболее очищенной явилась талая вода, уменьшилось содержание хлорид и сульфат ионов, катионы железа в талой воде не обнаруживаются.
Слайд 38Выводы
из проведенного исследования качества питьевой воды г. Краснодара можно сделать следующие выводы: 1. Качество питьевой воды по органолептическим и большинству химических показателей соответствует нормам Всемирной Организации Здравоохранения (ВОЗ), Европейского сообщества (ЕС) и Государственного стандарта (ГОСТ). 2. Питьевая вода нашей местности является водой средней жесткости, однако водопроводная вода мягче природной. 3. При движении по многокилометровым магистралям из чугунных и стальных труб, подверженных коррозии, в водопроводной воде повышается содержание ионов железа.

Слайд 394. Рекомендуется производить дополнительную обработку питьевой воды непосредственно на месте потребления: а) отстаивание водопроводной воды; при этом улетучивается остаточный свободный хлор, который применяют для обеззараживания воды. б) кипячение воды; основное предназначение процесса кипячения – обеззараживание воды и снижение карбонатной жесткости. в) вымораживание воды; считается, что такая вода самая чистая, лучше проникает через биологические мембраны, быстрее выводится из организма экскреторными органами. г) фильтрование; фильтры уменьшают ее жесткость и содержание свободного хлора. 5. Подземные воды являются основным источником питьевой воды в нашей местности, они гораздо ценнее по качеству и наиболее надежны в санитарном отношении.

Слайд 40ЛИТЕРАТУРА:
1. Алексеев С.В., Груздева Н.В., Муравьев А.Г., Гущина Э.В. Практикум по экологии: учебное пособие. Москва, Издательство АО МДС, 1998г. 2. Ашихмина Т.Я Школьный экологический мониторинг. Издательство «Агар», 2000 г. 3. Браун Т., Лемей Г. Химия – в центре наук. Пер. с англ. Москва «Мир», 1983 г. 4. Мигунов Л.Н., Мигунова М.И. Природа и общество. г. Старый Оскол, 2000 г. 5. Муравьев А.Г. Руководство по определению показателей качества воды полевыми методами. – СПб.: Крисмас +, 1999 г. 6. Небел Б. Наука об окружающей среде. Пер. с англ. – М., «Мир», 1993 г. 7. Новиков Ю.В. и др. Методы исследования качества воды водоемов. – М.: Медицина, 1990 г. 8. Паус К.Ф. Основы промышленной экологии г. Белгород, 2001 г.
Слайд 41Интернет ресурсы:
http://www.physicon. http://www.hemi.wallst.ru http://picanal.narod.ru/ http://www.hemi.wallst.ru/ http://www.alhimik.ru/ http://www.chem.msu.su/ http://www.cnit.msu.ru/