Слайд 1Муниципальное общеобразовательное учреждение лицей №10 Кировского района г.Волгограда
Ядерная модель атома. Квантовые постулаты Бора Физика 11 класс
Выполнила: Ломинога Е.С., учитель физики
Вперед
Слайд 2Перечень материалов, представленных в методической разработке:
Титульный лист- слайд №1. Перечень материалов, представленных в методической разработке – слайд №2. Структура урока – слайд №3. Рекомендации для учителей – слайд №4. Урок – слайды с № 5 по №40.
Слайд 3Структура урока
Урок выполнен в виде презентации Power Point на 41 слайде , содержит 3 основные части: 1 часть – объяснение материала, слайды №№5-37 2 часть- контроль приобретенных умений и навыков, слайд № 38,39 3 часть – домашнее задание и используемые ресурсы, слайды №№40,41
Слайд 4Рекомендации для учителя.
Урок содержит 41слайд Смена слайдов производится по щелчку «мыши». Учитель может вернуться к любому слайду, если видит, что обучающиеся не поняли материал. Слайды имеют несколько видов анимации, для того чтобы у обучающихся было время на осмысление теоретического материала. Урок разработан для обучающихся 11 класса. Цель данной презентации - создание цифрового образовательного ресурса для помощи учителю и обучающемуся
Слайд 5Тема урока: Ядерная модель атома . Квантовые постулаты Бора
Цели урока: 1. Обучающая: изучение физической модели атомов; 2. Воспитательная: формирование положительного отношения к знаниям; воспитание дисциплинированности; 3. Развивающая: развитие мышления ( формирование умения классифицировать факты, делать обобщающие выводы); развитие познавательных умений (совершенствование умений выделять главное, писать конспект, делать наблюдения); развитие умения владеть собой. Задачи урока: Изучить ядерную модель атома, 3 постулата Бора.
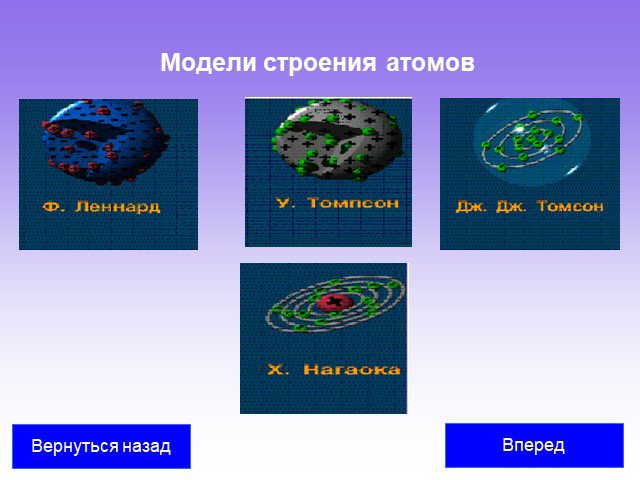
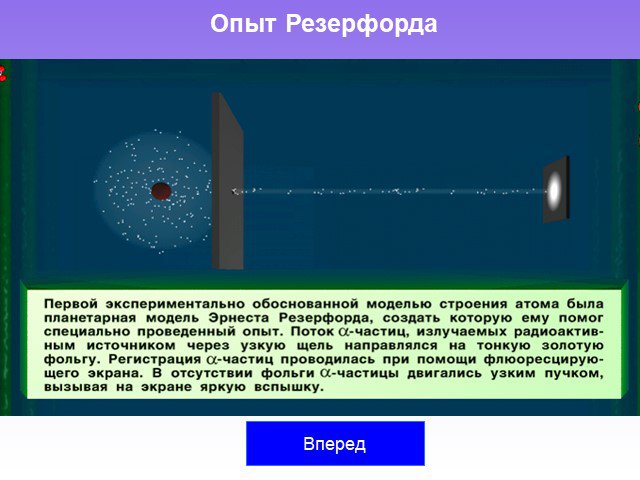
Слайд 6Развитие теории о строении атома Модели строения атомов Опыт Резерфорда Планетарная модель атома Резерфорда Постулаты Бора

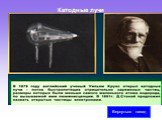
Слайд 7Сторонники атомистической теории рассматривали атом как мельчайшую неделимую частицу и считали, что все многообразие мира есть не что иное, как сочетание неизменных частиц – атомов. (Демокрит «существует предел деления атома», Аристотель « делимость вещества бесконечна») В XVIII веке трудами А. Лавуазье, М. В. Ломоносова была доказана реальность существования неделимой частицы - атома. В 1833 году при исследовании явления электролиза М. Фарадей установил, что ток в растворе электролита - это упорядоченное движение заряженных частиц – ионов. Фарадей определил минимальный заряд иона, который был назван элементарным электрическим зарядом. Его приближенное значение оказалось равным e = 1,60·10–19 Кл. В 1869 году Д. И. Менделеев разработал периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов. 1879 год - открытие катодных лучей. В начале XIX века были открыты дискретные спектральные линии в излучении атомов водорода в видимой части спектра. Впоследствии, в 1885 г., И. Бальмером были установлены математические закономерности, связывающие длины волн этих линий. 1895 год - открытие рентгеновских лучей. В 1896 году А. Беккерель обнаружил явление испускания атомами невидимых проникающих излучений, названное радиоактивностью. Учеными М. Склодовская-Кюри, П. Кюри, Э. Резерфорд было обнаружено, что атомы радиоактивных веществ испускают три вида излучений различной физической природы (альфа-, бета- и гамма-лучи). В 1897 году Дж. Томсон открыл электрон и измерил отношение e / m заряда электрона к массе. Опыты Томсона подтвердили вывод о том, что электроны входят в состав атомов. Таким образом, на основании всех известных к началу XX века экспериментальных фактов можно было сделать вывод о том, что атомы вещества имеют сложное внутреннее строение. Они представляют собой электронейтральные системы, причем носителями отрицательного заряда атомов являются легкие электроны, масса которых составляет лишь малую долю массы атомов. Основная часть массы атомов связана с положительным зарядом. Перед наукой встал вопрос о внутреннем строении атомов.
Вернуться назад
Слайд 8Демокрит (род. ок. 470 или 460 до н. э.; умер в глубокой старости) из Абдер (Фракия), древнегреческий философ, один из основателей античной атомистики. По Демокриту, существуют только атомы и пустота. Атомы – неделимые материальные элементы (геометрические тела, «фигуры»), вечные, неразрушимые, непроницаемые, различаются формой, положением в пустоте, величиной; движутся в различных направлениях, из их «вихря» образуются как отдельные тела, так и все бесчисленные миры; они невидимы для человека, истечения из них, действуя на органы чувств, вызывают ощущения. Говорил о множественности миров.
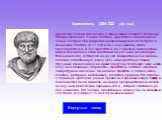
Слайд 9Аристотель (384–322 до н.э.) Древнегреческий философ и ученый-энциклопедист. Из города Стагира (Фракия). Ученик Платона. Аристотель происходил из семьи лекарей при дворе македонских царей. В 367 вступил в Академию Платона (в 17 лет) и был ее учеником, затем преподавателем. В 343 Аристотель был призван македонским царем Филиппом II стать наставником его сына (Александра Македонского), оставался им до 340. Возвратившись в Афины, основал собственную школу (335) – Ликей (отсюда лицей). Обучение происходило во время прогулок, благодаря чему школа получила название «Перипата». Аристотель оставил огромное литературное наследие. Он написал трактаты о логике, этике, поэтике, риторике, метафизике, политике, природе. Его взгляды с помощью арабских ученых проникли в средневековую Европу и повсеместно были приняты на веру и просуществовали вплоть до научной революции середины XVI в., которая поставила их под сомнение. Его лекции, прочитанные в Ликее, были собраны в 150 томов, из которых 15 дошли до наших дней.

Слайд 10Ломоносов Михаил Васильевич (19.XI.1711–15.IV.1765) Русский ученый. Его исследования относятся к математике наукам о Земле, астрономии. Ломоносов обратил внимание (1756) на основополагающее значение закона сохранения массы вещества в химических реакциях; изложил (1741–50) основы своего атомно-корпускулярного учения; выдвинул (1744–48) кинетическую теорию теплоты; обосновал (1747–52) необходимость привлечения физики для объяснения химических явлений и предложил для теоретической части химии название «физическая химия», а для практической части – «техническая химия». Развивая атомистические представления, он высказал мнение о том, что тела состоят из «корпускул», а те в свою очередь из «элементов»; это соответствует современным представлениям о молекулах и атомах. В химической лаборатории Петербургской АН выполнялась широкая программа экспериментальных исследований. Разработал точные методы взвешивания, применял объемные методы количественного анализа. Изучал жидкое, газообразное и твердое состояние тел. Достаточно точно определил коэффициенты расширения газов. Создал различные приборы (вискозиметр, прибор для фильтрования под вакуумом, прибор для определения твердости, газовый барометр, пирометр, котел для исследования веществ при низком и высоком давлении), достаточно точно градуировал термометры. Разработал технологию и рецептуру цветных стекол, которые он употреблял для создания мозаичных картин. Высказал идею биогенного происхождения гумуса почвы. Доказал органическое происхождение нефти, каменного угля, торфа и янтаря. Первым из русских академиков приступил к подготовке учебников по химии и металлургии. По его проекту в 1748 завершена постройка химической лаборатории Петербургской АН.

Слайд 11Лавуазье (Lavoisier) Антуан Лоран (26.VIII.1743–8.V.1794) Французский химик. Один из основоположников классической химии. Ввел в химию строгие количественные методы исследования. Положил начало опровержению (1774) теории флогистона. Получил (1774) кислород. Доказал (1775–77) сложный состав атмосферного воздуха, содержащего кислород и «удушливый воздух» (азот). Доказал сложный состав воды, установив, что она состоит из кислорода и водорода. Вместе с К. Л. Бертолле, Л. Б. Гитоном де Морво и А. Ф. Фуркруа разработал принципы новой химической номенклатуры. Заложил основы органического анализа. Впервые высказал мысль о том, что уксусная кислота образуется в результате окисления винного спирта кислородом воздуха. Совместно с П. Лапласом измерил термические константы ряда веществ и теплотворную способность различных видов топлива. Доказал, что процесс дыхания подобен горению и что образование углекислого газа при дыхании является главным источником теплоты в живом организме.
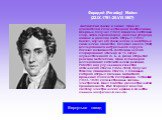
Слайд 12Фарадей (Faraday) Майкл (22.IX.1791–25.VIII.1867) Английский физик и химик. Один из основателей количественной электрохимии. Впервые получил (1823) в жидком состоянии хлор, затем сероводород, диоксид углерода, аммиак и диоксид азота. Открыл (1825) бензол, изучил его физические и некоторые химические свойства. Положил начало (1826) исследованиям натурального каучука. Показал возможность фотохимического хлорирования этилена за 15 лет до осуществленного Ж. Б. А. Дюма открытия реакции металепсии. Один из пионеров исследования каталитических реакций. Работал над улучшением качества оптического стекла (1824–1830). Получил тяжелое свинцовое стекло, с помощью которого открыл явление магнитного вращения плоскости поляризации. Установил (1833–1836) количественные законы электролиза. Ввел понятие диэлектрической проницаемости. Имя Фарадея вошло в систему электрических единиц в качестве единицы электрической емкости.
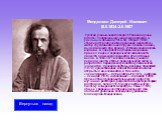
Слайд 13Менделеев Дмитрий Иванович (8.II.1834–2.II.1907 Русский ученый-энциклопедист. Ранние научные работы посвящены изучению изоморфизма и удельным объемам (1854–56). Открыл (1860) «температуру абсолютного кипения жидкостей». Автор фундаментального труда «Основы химии», выдержавшего при жизни Д. И. Менделеева восемь изданий. В ходе работ над первым изданием пришел к идее о периодической зависимости свойств химических элементов от их атомных весов. В 1869–1871 изложил основы учения о периодичности, открыл периодический закон и разработал периодическую систему химических элементов. На основе системы впервые предсказал (1870) существование и свойства нескольких не открытых еще элементов, в том числе «экаалюминия» – галлия (открыт в 1875), «экабора» – скандия (1879), «экасилиция» – германия (1886). Осуществил фундаментальный цикл работ по изучению растворов, разработав гидратную теорию растворов. Создал (1873) новую метрическую систему измерения температуры. Нашел (1874) общее уравнение состояния идеального газа, обобщив уравнение Клапейрона (уравнение Клапейрона–Менделеева).
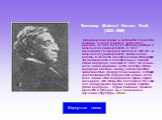
Слайд 14Бальмер (Balmer) Иоганн Якоб (1825–1898) Швейцарский физик и математик. Родился в Лозанне. Учился в Базеле, Карлсруэ, Берлине. В 1849 получил степень доктора в Базельском университете. С 1859 преподавал в средней школе и в 1865–90 – в Базельском университете. Физические работы в области спектроскопии. Обнаружил закономерность в спектральных линиях атома водорода, показав в 1885, что длины волн линий видимой части спектра атома водорода связаны между собой простой зависимостью (формула Бальмера), которая дает возможность определить длины волн всех линий этой водородной серии (серия Бальмера). Это открытие послужило толчком для обнаружения других серий в спектре атома водорода – серий Лаймана, Пашена, Брэкетта и Пфунда. Был пионером в изучении структуры атома.
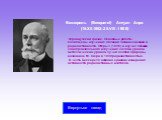
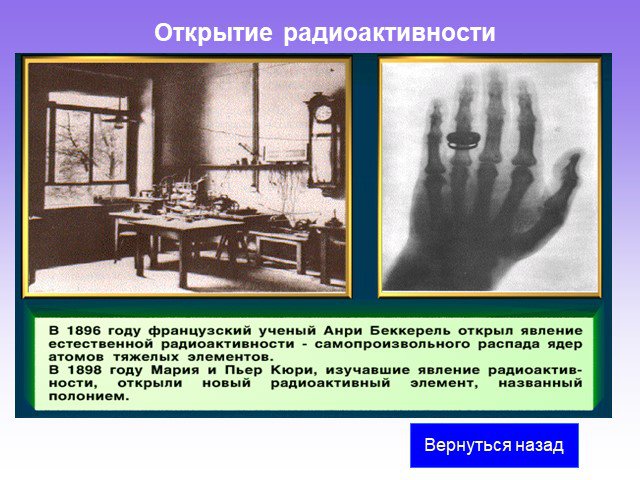
Слайд 15Беккерель (Becquerel) Антуан Анри (15.XII.1852–25.VIII.1908) Французский физик. Основные работы посвящены изучению явлений люминесценции и радиоактивности. Открыл (1896) и изучил явление самопроизвольного излучения солями урана и металлическим ураном лучей особой природы, названное М. Кюри в 1898 радиоактивностью. В честь Беккереля названа единица измерения активности радиоактивных изотопов.
Слайд 16Склодовская-Кюри (Sklodowska-Curie) Мария (7.XI.1867–4.VII.1934) Химик и физик. Является одним из основоположников учения о радиоактивности. Совместно с П. Кюри открыла (1898) химические элементы полоний и радий. Впервые употребила термин «радиоактивность». Получила (1902) вместе с П. Кюри 0,1 г соли радия и определила его атомный вес. Совместно с А. Л. Дебьеном получила (1910) радий в металлическом виде. Они же изготовили (1911) первый эталон радия. Нобелевская премия по физике (1903, совместно с П. Кюри). Нобелевская премия по химии (1911).

Слайд 17Кюри (Curie) Пьер (15.V.1859–19.IV.1906) Французский физик и химик. Один из основателей учения о радиоактивности. Научные работы посвящены также исследованию кристаллических тел, магнетизму. Изучал (до 1896) парамагнитные и диамагнитные тела и установил (1895) закон, согласно которому сущестует обратная пропорциональность между магнитной восприимчивастью парамагнетиков и абсолютной температурой (закон Кюри). Обнаружил, что для железа существует особая температура, выше которой исчезают его ферромагнитные свойства (точка Кюри). Совместно с женой М. Склодовской-Кюри открыл (1898) полоний и радий. Одним из первых использовал понятие «период полураспада». Предложил (1904) идею метода определения абсолютного возраста ураносодержащих минералов. Нобелевская премия по физике (1903, совместно с М. Склодовской-Кюри).
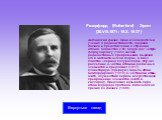
Слайд 18Резерфорд (Rutherford) Эрнст (30.VIII.1871–19.X.1937) Английский физик. Один из основателей учения о радиоактивности, ядерной физики и представлений о строении атомов. Совместно с Ф. Содди дал четкую формулировку (1903) закона радиоактивных превращений, выразив его в математической форме, и ввел понятие «период полураспада». Изучил рассеяние α-частиц атомами различных элементов и предложил (1911) планетарную (ядерную) модель атома. Бомбардировал (1919) α-частицами атомы азота, осуществив первое искусственное превращение элементов (азота в кислород). Предложил называть ядро атома водорода протоном. Нобелевская премия по физике (1908).
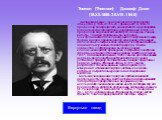
Слайд 19Томсон (Thomson) Джозеф Джон (18.XII.1856–30.VIII.1940) Английский физик, член Лондонского королевского общества (с 1884, в 1915–20 – президент). В 1884–19 профессор Кембриджского университета и руководитель Кавендишской лаборатории; одновременно в 1905–18 профессор Королевского института в Лондоне. Ранние работы Томсона посвящены вычислению электромагнитного поля движущегося заряженного шара, теории вихрей, прецизионному измерению отношения абсолютных электрических единиц к электромагнитным. Занимаясь изучением газового разряда, Томсон совместно с сотрудниками выполнил серию классических работ, приведших к открытию электрона (впервые измерил отношение заряда электрона к массе, 1897; Нобелевская премия, 1906). Томсон дал объяснение непрерывного спектра рентгеновского излучения, установил природу положительных ионов, предложил первую модель строения атома. В 1911 Томсон разработал так называемый метод парабол для измерения отношения заряда частицы к ее массе, который сыграл большую роль в исследовании изотопов. Большое значение имела научно-организационная деятельность Томсона. Возглавляемая им Кавендишская лаборатория превратилась в ведущий научно-исследовательский физический центр, в котором под его руководством работали крупнейшие английские физики (Э. Резерфорд, Ч. Вильсон, Ф. У. Астон, У. Ричардсон и др.). Будучи убежденным сторонником классической физики, Томсон придерживался гипотезы эфира.
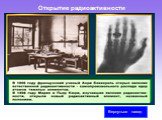
Слайд 20Открытие радиоактивности
Слайд 23Модели строения атомов
Слайд 24Модель Томсона
Дж. Томсон в 1898 году предложил модель атома в виде положительно заряженного шара радиусом 10-10м, в котором плавают электроны, нейтрализующие положительный заряд.
+ - электрон
Слайд 26Рассеивание α - частиц
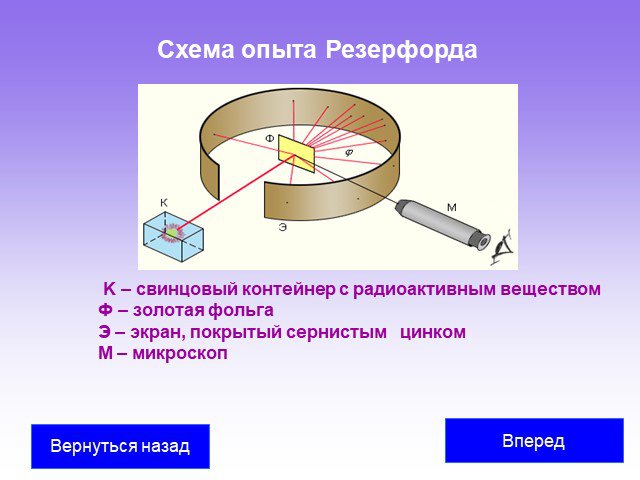
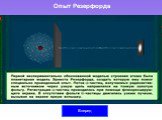
Слайд 27Схема опыта Резерфорда
K – свинцовый контейнер с радиоактивным веществом Ф – золотая фольга Э – экран, покрытый сернистым цинком M – микроскоп
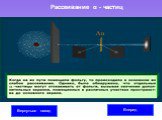
Слайд 28Рассеяние α-частицы в атоме Томсона и в атоме Резерфорда
α Атом Резерфорда Атом Томсона
Большинство альфа - частиц отклоняются от прямолинейного пути на углы не более 1- 20 2. Небольшая часть альфа – частиц испытывала отклонение на значительно большие углы 3. В среднем одна из 8000 альфа- частиц рассеивается в направлении, обратном направлению первоначального движения
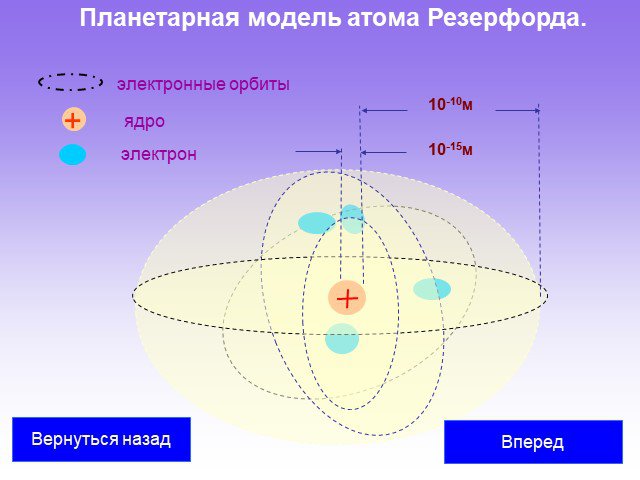
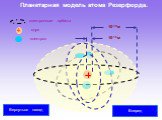
Слайд 29Планетарная модель атома Резерфорда.
10-10м 10-15м электрон ядро
электронные орбиты
Слайд 30Модели атомов водорода
Водород (H) Дейтерий (D) Тритий (T)
Атомы одного элемента, имеющие одинаковое число протонов, но разное число нейтронов, называются изотопами. Химические свойства таких атомов одинаковы, но они различны по некоторым физическим свойствам. В 1961 году изотоп 12С был выбран в качестве международного стандарта атомной массы.
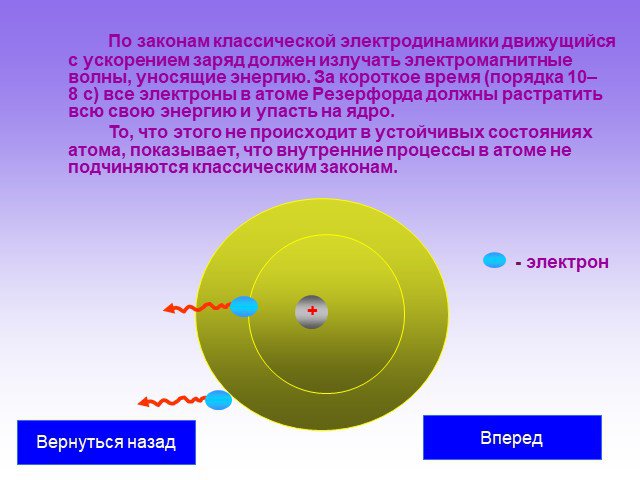
Слайд 31По законам классической электродинамики движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию. За короткое время (порядка 10–8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.
Слайд 32I ПОСТУЛАТ БОРА
Атомная система может находится только в особых стационарных квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
-
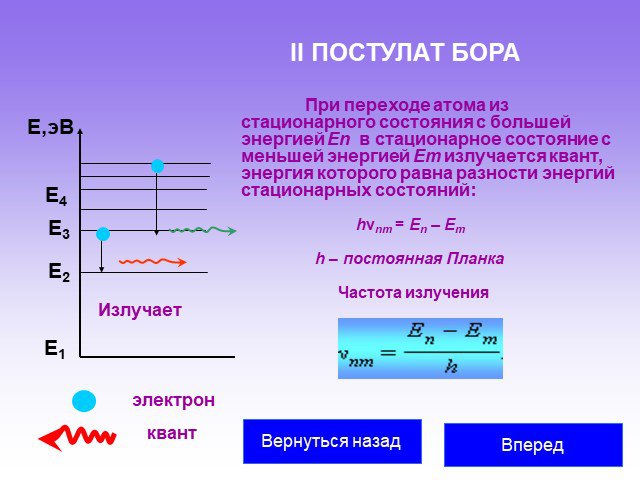
Слайд 33II ПОСТУЛАТ БОРА
При переходе атома из стационарного состояния с большей энергией En в стационарное состояние с меньшей энергией Em излучается квант, энергия которого равна разности энергий стационарных состояний:
Е1 Е2 Е3 Е,эВ Излучает Е4 hνnm = En – Em
h – постоянная Планка
Частота излучения
квант
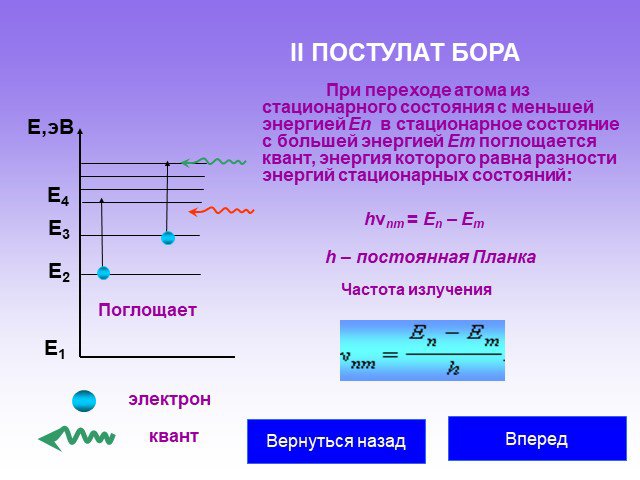
Слайд 34При переходе атома из стационарного состояния с меньшей энергией En в стационарное состояние с большей энергией Em поглощается квант, энергия которого равна разности энергий стационарных состояний:
Поглощает
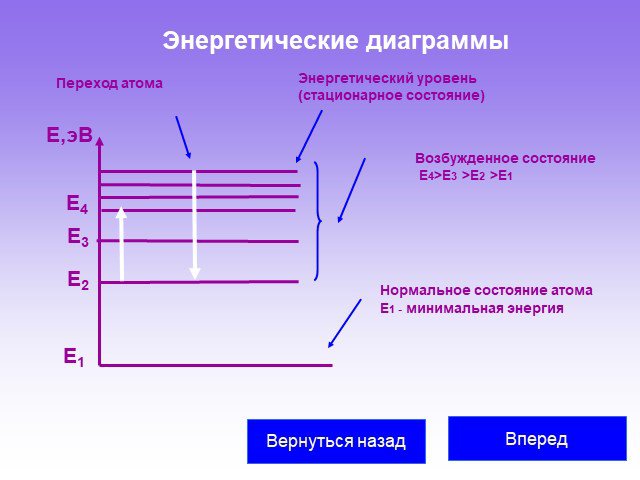
Слайд 35Энергетические диаграммы
Энергетический уровень (стационарное состояние)
Нормальное состояние атома Е1 - минимальная энергия
Возбужденное состояние Е4>Е3 >Е2 >Е1
Переход атома
Слайд 36Правило квантования Бора
В стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные, квантованные значения момента импульса
me - масса электрона, υ – скорость электрона rn – радиус стационарной круговой орбиты
Правило квантования Бора позволяет вычислить радиусы стационарных орбит электрона в атоме водорода и определить значения энергий
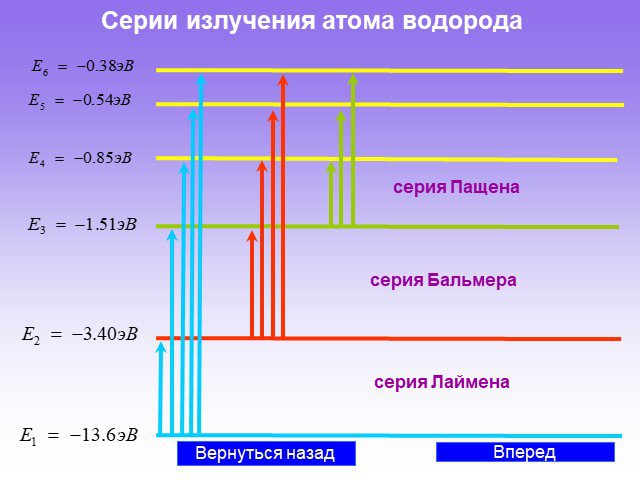
Слайд 37Серии излучения атома водорода
серия Пащена серия Лаймена серия Бальмера
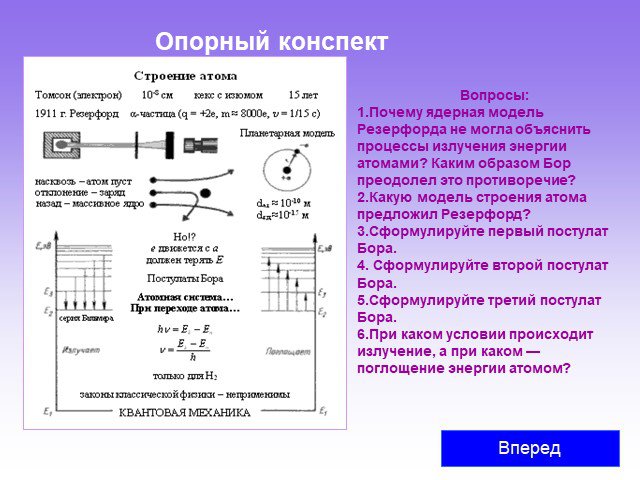
Слайд 38Опорный конспект
Вопросы: Почему ядерная модель Резерфорда не могла объяснить процессы излучения энергии атомами? Каким образом Бор преодолел это противоречие? Какую модель строения атома предложил Резерфорд? Сформулируйте первый постулат Бора. Сформулируйте второй постулат Бора. Сформулируйте третий постулат Бора. При каком условии происходит излучение, а при каком — поглощение энергии атомом?
Слайд 39Проверочный тест Тест
Слайд 40Домашнее задание
1.§ 61 2. Ответить на вопросы 3. Решить задачи 61.1, 61.2
Слайд 41Используемые ресурсы
Виртуальная школа «Кирилла и Мефодия» Уроки физики 11класс: «Ваш репетитор»; «Открытая физика», часть 2, «Физика атома и атомного ядра».