Слайд 1ФИЗИКО-ХИМИЯ ДИСПЕРСНЫХ СИСТЕМ в функционировании живых систем
Слайд 2Дисперсные системы – системы, состоящие из частиц одной фазы, распределенных в другой Диспергирование – процесс измельчения вещества одной фазы в другой Дисперсная фаза – фаза, состоящая из частиц раздробленного вещества Дисперсионная среда – среда, в которой распределены частицы
Слайд 3Признаки дисперсной системы
1. Гетерогенность 2. Дисперсность С уменьшением размера частиц при дроблении вещества увеличивается дисперсность, удельная поверхность, и, как следствие, уменьшается термодинамическая устойчивость системы
Слайд 4Свойства коллоидных растворов 1. Все коллоидные растворы способны рассеивать свет, т.е. опалесцировать. Опалесценция становится особенно заметна, если через коллоидный раствор пропускать пучок сходящихся лучей, поставив между источником света и кюветой с коллоидным раствором линзу. Тогда при наблюдении сбоку виден ярко светящийся конус (конус Тиндаля), что указывает на неоднородность коллоидных растворов.
Слайд 52. Диффузия частиц в к.р. протекает медленно. 3. К.р. Имеют низкое осмотическое давление. Два последних свойства указывают на относительно крупные по сравнению с молекулами или ионами размеры коллоидных частиц. 4. К.р. способны к диализу. Т.е. с помощью полупроницаемой перегородки (мембраны) могут быть отделены от растворенных в них низкомолекулярных веществ, которые проходят через поры мембраны в отличие от крупных кол. частиц.
Слайд 65. В отличие от истинных растворов к.р. неустойчивы. Коллоидно растворенное вещество способно выделяться (коагулировать) из раствора под влиянием незначительных внешних воздействий, образуя коагулят. Коагулят представляет собой агрегаты из слипшихся первичных частиц.
Слайд 7Коагуляцию может вызвать нагревание, вымораживание, интенсивное перемешивание, введение в к.р. небольших количеств индифферентного электролита, ультразвуковые воздействия. Т.о. коагуляция - это физический, а не химический процесс. 6. К.р. обнаруживают явление электрофореза, т.е. перенос коллоидных частиц в электрическом поле к тому или иному электроду, что свидетельствует о наличии заряда у коллоидных частиц.
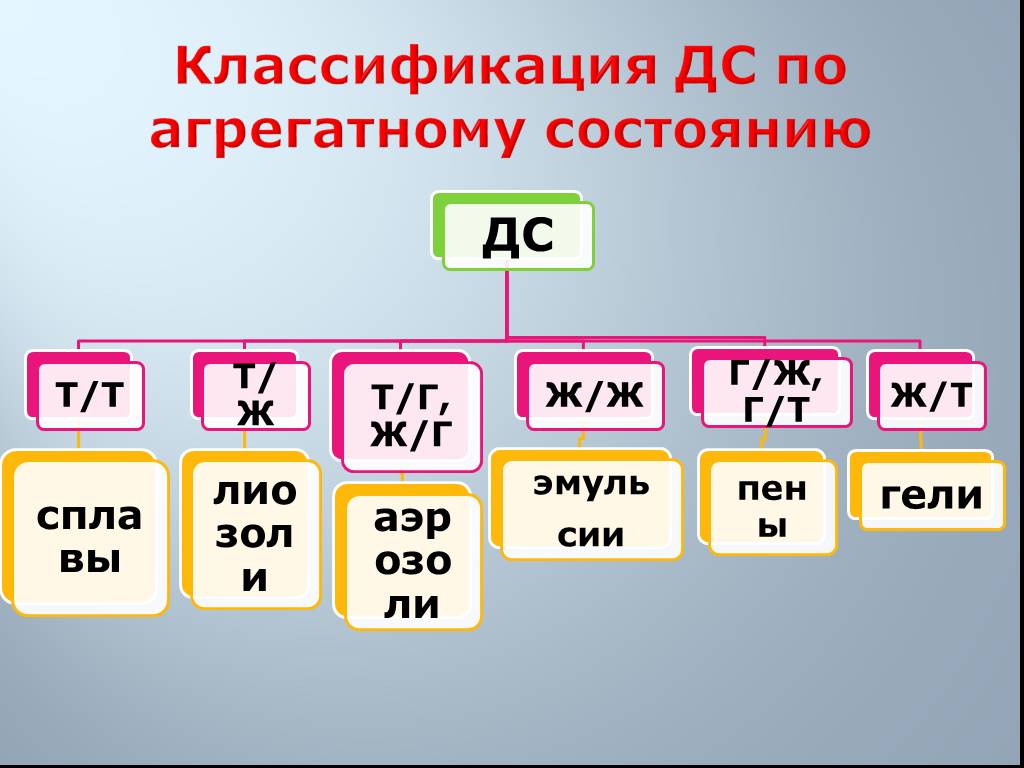
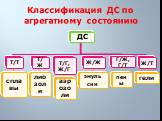
Слайд 8Коллоидные системы могут быть твердыми, жидкими и газообразными. Одно и то же вещество в зависимости от условий может образовывать и истинный, и коллоидный раствор. Например, канифоль в спирте образует истинный, а в воде коллоидный раствор. Хлорид натрия в воде образует истинный, а в бензоле – к.р.
Слайд 9Кол. Системы можно рассматривать как микрогетерогенные системы с предельной дисперсностью и огромной поверхностью раздела между дисперсной фазой и дисперсионной средой
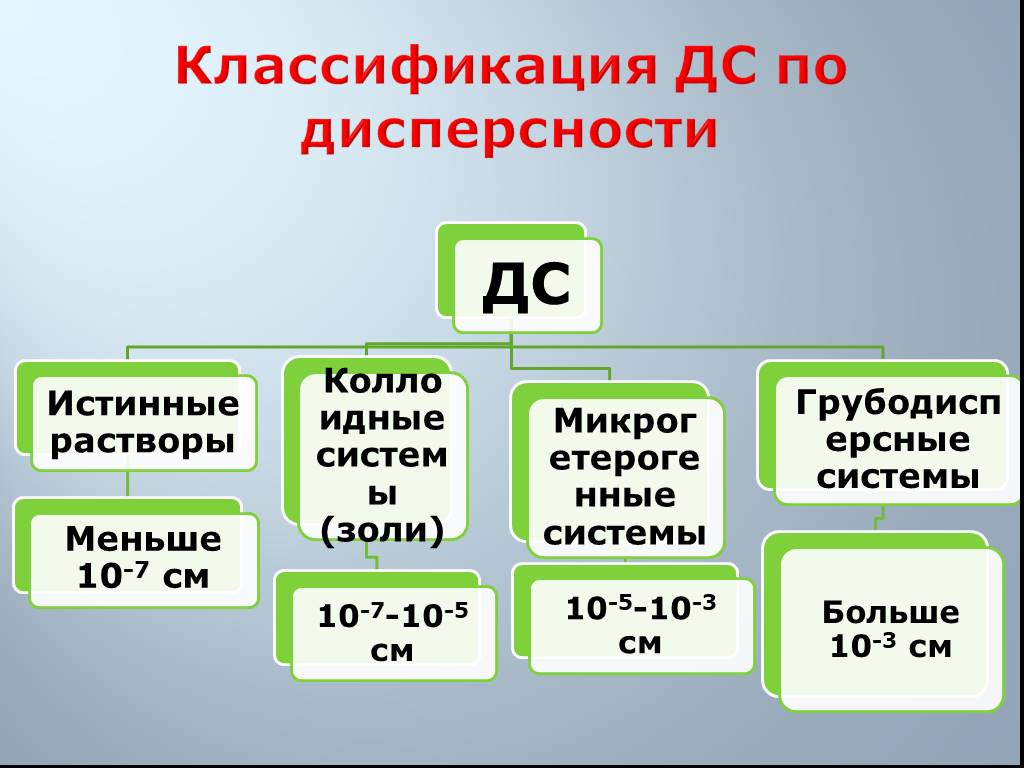
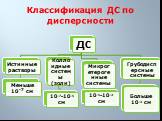
Слайд 10Классификация ДС по дисперсности
Слайд 11Классификация ДС по агрегатному состоянию
Слайд 12Классификация ДС по взаимодействию между частицами дисперсионной среды
1. Свободнодисперсные: частицы дисперсной фазы не связаны друг с другом, находятся на большом расстоянии одна от другой и могут свободно перемещаться в дисперсионной среде 2. Связнодисперсные: частицы дисперсной фазы связаны друг с другом межмолекулярными силами и не способны к взаимному перемещению
Слайд 13Переход коллоидной системы из свободнодисперсного состояния в связнодисперсное – гелеобразование, образующиеся при этом структурированные коллоидные системы – гели. Перевод геля в золь при добавлении электролита-стабилизатора - пептизация
Слайд 14Классификация ДС по межфазному взаимодействию
1. Лиофобные – слабое взаимодействие вещества дисперсной фазы со средой (лиозоли, аэрозоли, эмульсии, пены) 2. Лиофильные – сильное межмолекулярное взаимодействие веществ фазы и среды с образованием сольватных оболочек из молекул вещества дисперсионной среды (мыла, глины)
Слайд 15Ультрамикрогенные (коллоидные) системы или золи
Признаки 1. Размер частиц дисперсной фазы от 2. Гетерогенность 3. Многокомпонентность
10-7-10-5 см
Слайд 16Общие условия получения 1. Нерастворимость вещества дисперсной фазы в дисперсионной среде 2. Достижение коллоидной степени дисперсности частицами дисперсной фазы 3. Наличие третьего компонента-стабилизатора, который препятствует агрегации частиц и сообщает коллоидной системе агрегативную устойчивость
Слайд 17Методы получения коллоидных систем
1. Диспергирование – дробление крупных частиц грубодисперсных систем до коллоидной степени дисперсности 2. Конденсация – соединение атомов, ионов или ионов истинного раствора в агрегаты коллоидных размеров
Слайд 18Диспергирование
1. Механическое – раздавливание, дробление, растирание крупных частиц суспензий, эмульсий, порошков 2. Ультразвуковое 3. Электрическое 4. Пептизация
Слайд 19Конденсация
1. Конденсация паров 2. Замена растворителя 3. Различные химические реакции
Слайд 20Очистка коллоидных систем
Диализ, электродиализ, ультрафильтрация Основаны на способности молекул разных размеров или ионов проходить через полупроницаемые мембраны. Крупные частицы золей через полупроницаемые мембраны пройти не могут
Слайд 21Строение коллоидной частицы Для образования коллоидных частиц необходимо три условия: Дисперсная фаза не должна растворяться в дисперсной среде Дисперсность частиц должна быть от 1-100 нм. - Наличие электролита-стабилизатора.
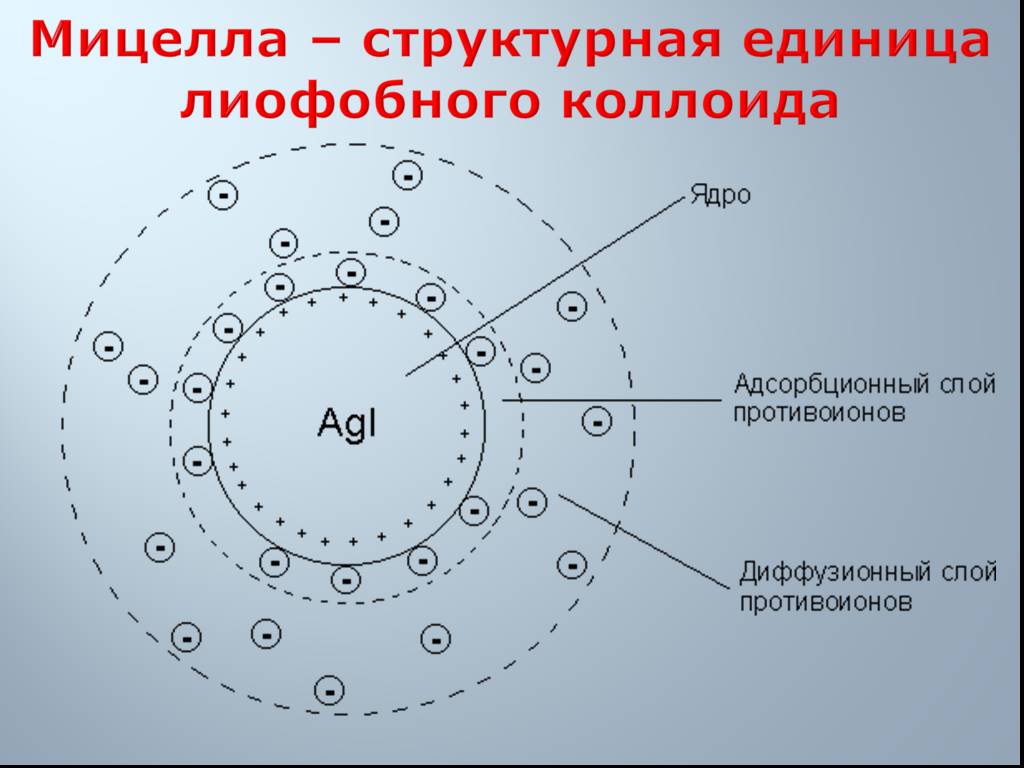
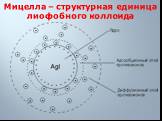
Слайд 22Твердые частицы коллоидных систем называются мицеллами. Мицеллу образуют: 1. Ядро (агрегат), состоящее из большого числа атомов или молекул нерастворимого в растворителе вещества, имеющего кристаллическое строение. 2. на поверхности ядра адсорбируются ионы электролита-стабилизатора.
Слайд 23Согласно правилу Фаянса-Пескова: «На поверхности ядра коллоидной частицы адсорбируются те ионы, которые могут достроить кристаллическую решетку этой частицы». Адсорбирующиеся ионы определяют знак и величину поверхностного потенциала и называются потенциалопределяющими ионами (ПОИ).
Слайд 243. Вокруг ПОИ располагается часть противоионов электролита –стабилизатора, образующих вместе с ПОИ адсорбционный слой. 4. Ядро и адсорбционный слой составляют гранулу. 5. остальные противоионы, не вошедшие в адсорбционный слой, образуют диффузный слой мицеллы. Этот слой подвижен и может перемещаться относительно твердой фазы-гранулы.
Слайд 25Двойной электрический слой (ДЭС) ДЭС – это слой, возникающийй на границе твердой и жидкой фазы мицеллы, состоящей из пространственно разделенных электрических зарядов противоположного знака. Электрические свойства коллоидных систем определяются наличием ДЭС.
Слайд 26Строение ДЭС
Твердая фаза Потенциалобразующие ионы Адсорбционный слой противоионов (слой по Гельмгольцу) Диффузный слой противоионов (слой по Гуи)
Слайд 27Мицелла – структурная единица лиофобного коллоида
Слайд 28Правило Панета-Фаянса-Пескова
на поверхности ядра мицеллы адсорбируются ионы, имеющиеся в составе ядра, т.е. адсорбируются ионы, находящиеся в избытке
Слайд 29AgNO3 + KI = AgI + KNO3,
{m [AgI]nI־ (n – x)K+}x־ г р а н у л а {m [AgI]nI־ (n - x)K+}x־xK+ м и ц е л л а
Слайд 30{m[AgI]nAg+(n- x)NO3 ־}x+xNO3־ (гранула положительна) {m[AgI]nI ־(n- x)K+}x־xK+ (гранула отрицательна)
Слайд 31Устойчивость коллоидных систем Дисперсные системы в отличие от истинных растворов являются термодинамически неустойчивыми. Под устойчивостью дисперсных систем понимают способность их сохранять свое состояние и свойства в течение времени.
Слайд 32Русский ученый Н. Песков в 1925 году указал на два вида устойчивости: 1 . Кинетическая (седиментационная) устойчивость – это способность дисперсных частиц оставаться во взвешенном состоянии. 2. Агрегативная устойчивость – это способность частиц дисперсной фазы противостоять их слипанию (агрегации).
Слайд 33В 1968 году русский ученый В. Мишин предложил третий вид устойчивости: Конденсационная устойчивость – способность дисперсных систем сохранять неизменной с течением времени удельную поверхность.
Слайд 34Седиментация - это явление оседания частиц достаточно большой массы под действием гравитационного поля. Грубодисперсные системы (пыль или суспензия песка в воде) кинетически неустойчивы и седиментируют. Высокодисперсные системы (смеси газов, истинные растворы) обладают высокой кинетической устойчивостью. Коллоидные системы (аэрозоли, лиозоли) занимают промежуточное положение. В них частицы представляют собой агрегаты молекул, т.е. крупнее отдельных молекул, но мельче частиц грубо дисперсной системы.
Слайд 35К факторам, определяющим кинетическую устойчивость относят: -степень дисперсности коллоидных частиц - броуновское движение - вязкость дисперсной среды - разность плотностей дисперсных фаз и среды. Наибольшее влияние на скорость осаждения коллоидных частиц имеет степень их дисперсности. Чем меньше размер частиц, тем больше кинетическая устойчивость.
Слайд 36Факторы, определяющие агрегативную устойчивость: - Наличие у коллоидных частиц одноименных зарядов, что мешает им соединиться в крупные агрегаты - наличие вокруг мицеллы сольватных оболочек, состоящих из прочно связанных молекул растворителя, обладающих значительной упругостью. Это состояние получило название расклинивающего давления (действует на расстоянии 10-5 см).
Слайд 37Коагуляция коллоидных систем Нарушение агрегативной устойчивости коллоидной системы в сторону укрупнения частиц за счет их слипания под влиянием молекулярных сил притяжения называется коагуляцией (от лат. сгущение, свёртывание). Коагуляцию коллоидов могут вызывать: - электролиты, - изменения температуры, - механические воздействия, - изменение состава дисперсионной среды, - электрический ток и др.
Слайд 38Электролитная коагуляция. Основные правила коагуляции: 1. Все электролиты могут вызвать коагуляцию. Но коагулирующим действием обладает только тот ион, который противоположен заряду гранулы 2. Коагуляцию вызывает только определенная концентрация электролита. Минимальная концентрация электролита, вызывающая быструю коагуляцию, называется порогом коагуляции (ПК). Он выражается обычно в миллимолях на литр коллоидного раствора.
Слайд 39Величина ПК зависит от величины заряда иона-коагулятора. Чем выше его валентность, тем меньшая концентрация электролита соответствует порогу коагуляции. Это правило Шульца – Гарди. Существует общая закономерность: с повышением валентности иона уменьшается концентрация добавляемого коагулирующего электролита, а соотношение порогов коагуляции для одно-, двух-, и трех-валентных ионов соответствует соотношению чисел: сотен, десятков и единиц.
Слайд 40Правило Шульце-Гарди
Порог коагуляции обратно пропорционален шестой степени электрического заряда ионов-коагуляторов γс = k/Z6, k – коэффициент. То есть, значения порогов коагуляции для одно-, двух-, и трехвалентных ионов как 1 : (1/2)6 : (1/3)6 = 1 : 1/64 : 1/729 = 729 : 11: 1.
Слайд 41Порог коагуляции зависит от природы электролита и от валентности коагулирующего иона и вычисляют по формуле: γ = СV(электролита)/(V(золя) + V(электролита)) (ммоль/л), где С – концентрация электролита, ммоль/л; V - минимальный объем раствора электролита, при добавлении которого началась коагуляция золя, мл.
Слайд 423.Коагулирующая способность ионов одинаковой зарядности увеличивается с возрастанием радиуса иона. 4.Коагулирующее действие электролита не сводится только к сжатию диффузного слоя. Одновременно протекает избирательная адсорбция на коллоидной частице тех ионов электролита, которые имеют заряд, противоположный грануле.
Слайд 43Механизм коагуляции электролитами Происходит снятие электрического заряда, т.е. приведение коллоидной частицы в изоэлектрическое состояние (ζ = 0) и уменьшение гидратной оболочки коллоидной частицы. В этом случае происходит сжатие диффузного слоя путем перехода противоионов из диффузного слоя в адсорбционный. При этом дзета-потенциал уменьшается, при ζ = 0 все коллоидные частицы седиментируют. Кроме этого происходит избирательная адсорбция на коллоидной частице тех ионов электролита, которые имеют заряд, противоположный грануле.

Слайд 44СУСПЕНЗИИ – это взвеси порошков в жидкости (почвы и грунты, глиняное тесто, цементные и известковые растворы, масляные краски). Разбавленные суспензии используются для крашения тканей, концентрированные – в строительстве. Размеры частиц суспензий больше, чем кол частицы. Суспензии одновременно и поглощают и рассеивают свет, седиментационно неустойчивы, не обнаруживают осмотического давления и броуновского движения, частицы видны в обычный микроскоп, не способны к диффузии. Как правило, на поверхности частиц образуется ДЭС или сольватная оболочка. -потенциал частиц имеет ту же величину, что и для типичных золей. Под влиянием электролитов суспензии коагулируют.

Слайд 45Эмульсии – это дисперсные системы, в которых и дисперсная фаза, и дисперсионная среда - жидкие. Степень дисперсности обычных эмульсий не очень велика: радиус их частиц порядка 10-3 – 10-5 см. Обычные эмульсии - это микрогетерогенные системы, состоящие из двух несмешивающихся жидкостей, одна из которых диспергирована в другой в виде весьма мелких капель. Обычно одна из фаз эмульсии - вода. Другой фазой может быть любая органическая жидкость, не смешивающаяся с водой: масло, бензол, бензин, керосин и др. Эту другую жидкость принято называть, независимо от ее химической природы, маслом. Кроме воды и масла, всякая устойчивая эмульсия обязательно содержит еще третий компонент, придающий ей агрегативную устойчивость, который называется эмульгатором.
Слайд 46Вода и масло образуют эмульсии двух типов. Первый тип: вода – дисперсионная среда, масло – дисперсная фаза, это эмульсии масла в воде (М/В) – прямые эмульсии. Второй тип – эмульсии воды в масле (В/М) – обратные.
Слайд 47Различают эмульсии разбавленные и концентрированные. Разбавленные эмульсии (концентрация дисперсной фазы до 0,1 %) стабилизируются электролитами, создающими двойной электрический слой на поверхности эмульгированных капель. Они устойчивы без специальных эмульгаторов. Концентрированные эмульсии (концентрация дисперсной фазы > 1%) устойчивы только в присутствии специальных эмульгаторов, в качестве которых используются вещества, образующие на капельках эмульгированной жидкости прочную пленку, не разрывающуюся при столкновениях. Это ВМС, желатин, каучук, смолы и полуколлоиды – мыла.

Слайд 48Эмульгатор выбирается в соответствии с правилом: эмульсии М/В стабилизируются растворимыми в воде ВМС, например, белками, и водорастворимыми – гидрофильными мылами, например, олеатом натрия. Эмульсии В/М стабилизируются ВМС, растворимыми в углеводородах, наример, полиизобутиленом, олеофильными смолами и мылами с поливалентными катионами (олеатом кальция), не растворимыми в воде и растворимыми в углеводородах.
Слайд 49Эмульсии с концентрацией дисперсной фазы более 74 % называют желатинированными. По физическим свойствам они отличаются от обычных. Обычные эмульсии – это жидкости, например, молоко, сливки; желатинированные – твердообразны, например, консистентные смазки, сливочное масло, маргарин, майонез, густые кремы. Эмульсию одного типа можно превратить в эмульсию другого типа. Это явление называется обращением фаз в эмульсиях, оно достигается путем изменения природы эмульгатора
Слайд 50Пенами являются дисперсные системы, в которых дисперсная фаза – газ, а дисперсионная среда – жидкость, вытянутая в тонкие пленки. Другими словами, пены – это высококонцентрированные эмульсии газа в жидкости. Пенами являются многие строительные и изоляционные материалы (пенобетоны, пенопласты, пемзы), а также продовольственные товары (пастила, зефир, мусс и т.д.). Пены используются при огнетушении, процессах флотации.
Слайд 51Для получения устойчивой пены необходимы стабилизаторы – пенообразователи, в качестве которых могут использоваться поверхностно-активные ВМС, мыла и др. Молекулы пенообразователя адсорбируются на границе раздела фаз таким образом, что их гидрофобная часть (углеводородный радикал) направлена в сторону газовой фазы, а гидрофильная в воду. Гидрофильная часть молекулы гидратируется водой, образуя гидратные слои определенной толщины, защищающие пузырьки газа от слияния.
Слайд 52Пена может быть получена встряхиванием раствора пенообразователя в цилиндре или пропусканием воздуха через пористый фильтр, помещенный в раствор пенообразователя. Третий способ состоит в том, что струя раствора с определенной высоты падает на поверхность того же раствор, находящегося в цилиндре.
Слайд 53Время жизни пены определяется временем существования ее определенного объема с момента возникновения до полного разрушения или временем, за которое высота столба пены убывает в два раза. Кратность пены – это отношение начального объема пены к объему раствора пенообразователя, израсходованного на образование этой пены. Жидкую пену, стабилизированную мылом или ВМС, можно разрушить, добавив ПАВ, вытесняющее пенообразователь с поверхности пузырьков.
Слайд 54АЭРОЗОЛИ. Аэрозоли играют важную роль в метеорологии, в сельском хозяйстве (дождевание, борьба с вредителями), в военном деле (сигнальные и маскирующие дымы). Большинство топлива сжигается в распыленном виде. Тушение пожаров эффективнее проводить при помощи водяной пыли (водяной завесы). Аэрозоли отличаются от лиозолей малой вязкостью дис среды и отсутствием стабилизирующей сольватной оболочки или ДЭС на поверхности дис частиц.
Слайд 55Аэрозоли неустойчивы. Любой аэрозоль со временем разрушается. Грубодисперсные аэрозоли седиментируют. Высокодис аэрозоли разрушаются вследствие частых столкновений частиц между собой или со стенками сосуда (для природных аэрозолей с препятствиями: деревьями, зданиями и пр.). Частицы аэрозолей перемещаются не только под действием механических сил, но и под действием других градиентов: электрического потенциала (электрофорез); температуры (термофорез).
Слайд 56СПАСИБО ЗА ВНИМАНИЕ















































































![AgNO3 + KI = AgI + KNO3, {m [AgI]nI־ (n – x)K+}x־ г р а н у л а {m [AgI]nI־ (n - x)K+}x־xK+ м и ц е л л а AgNO3 + KI = AgI + KNO3, {m [AgI]nI־ (n – x)K+}x־ г р а н у л а {m [AgI]nI־ (n - x)K+}x־xK+ м и ц е л л а](https://prezentacii.org/upload/cloud/19/02/127742/images/thumbs/screen29.jpg)
![{m[AgI]nAg+(n- x)NO3 ־}x+xNO3־ (гранула положительна) {m[AgI]nI ־(n- x)K+}x־xK+ (гранула отрицательна) {m[AgI]nAg+(n- x)NO3 ־}x+xNO3־ (гранула положительна) {m[AgI]nI ־(n- x)K+}x־xK+ (гранула отрицательна)](https://prezentacii.org/upload/cloud/19/02/127742/images/thumbs/screen30.jpg)