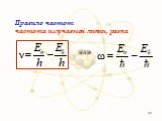
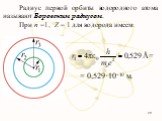
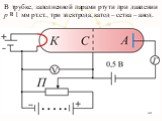
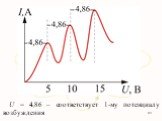
Презентация "Модель атома" по физике – проект, доклад
Презентацию на тему "Модель атома" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Физика. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 48 слайд(ов).
Слайды презентации
Список похожих презентаций
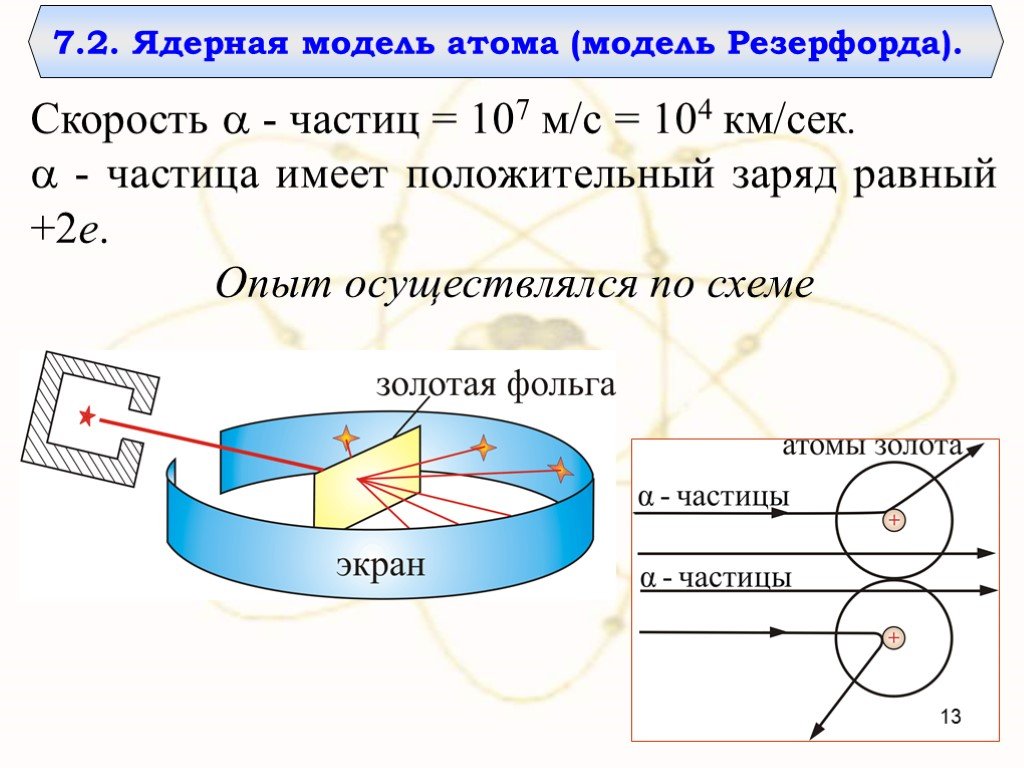
Модель атома Резерфорда
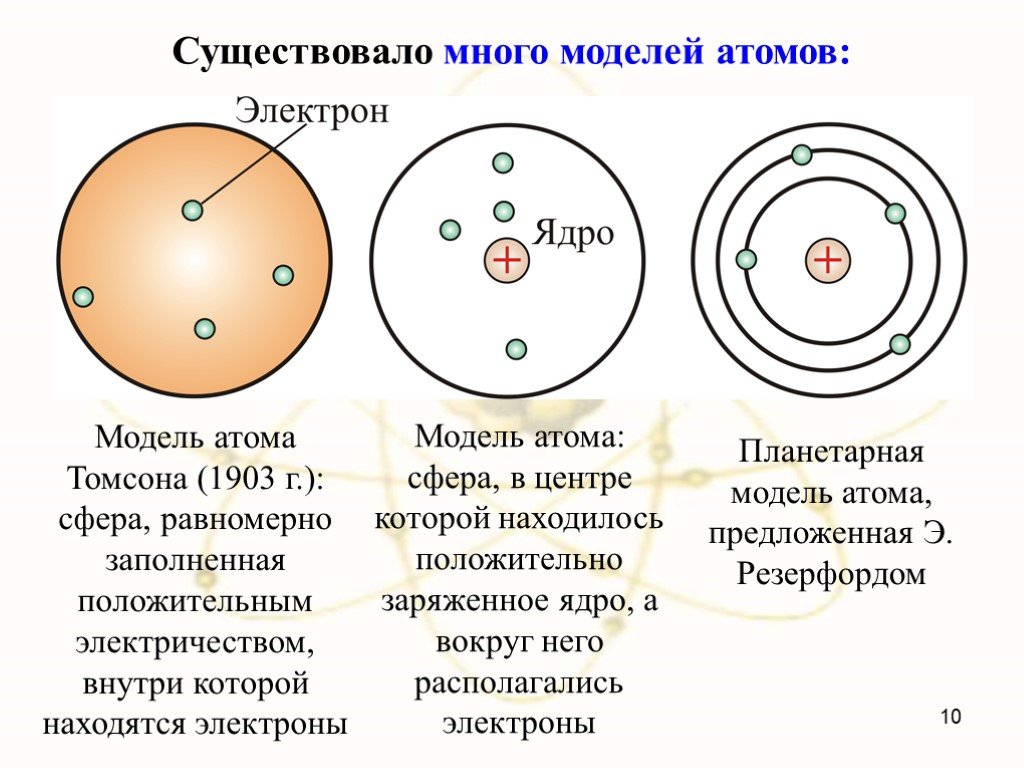
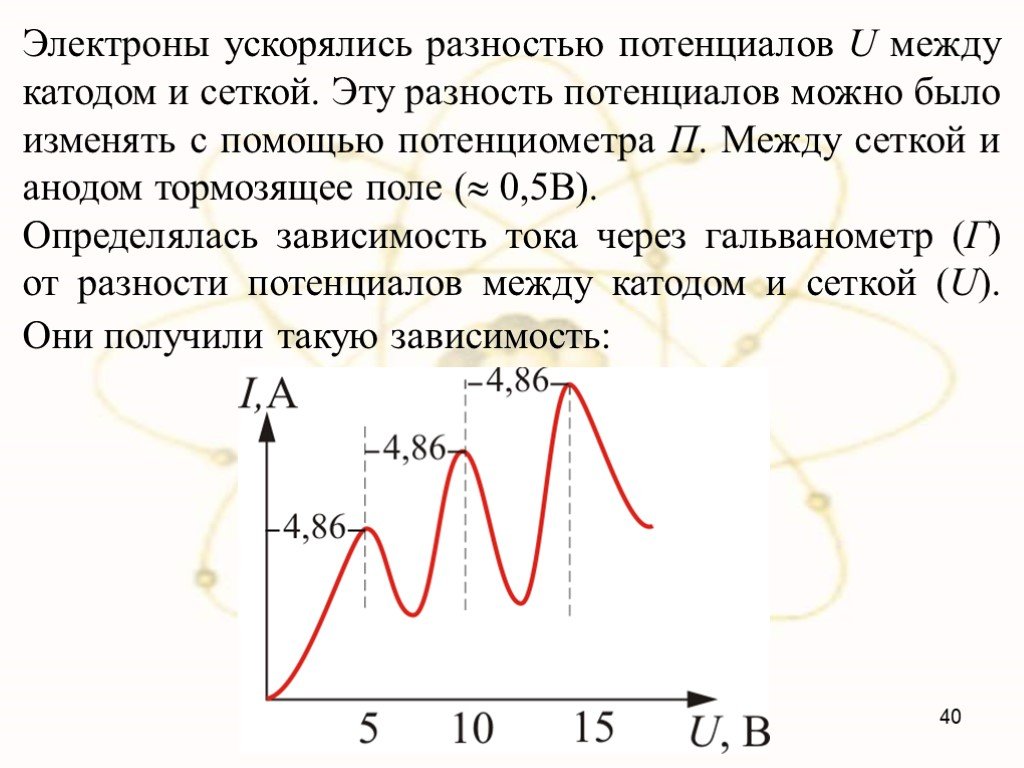
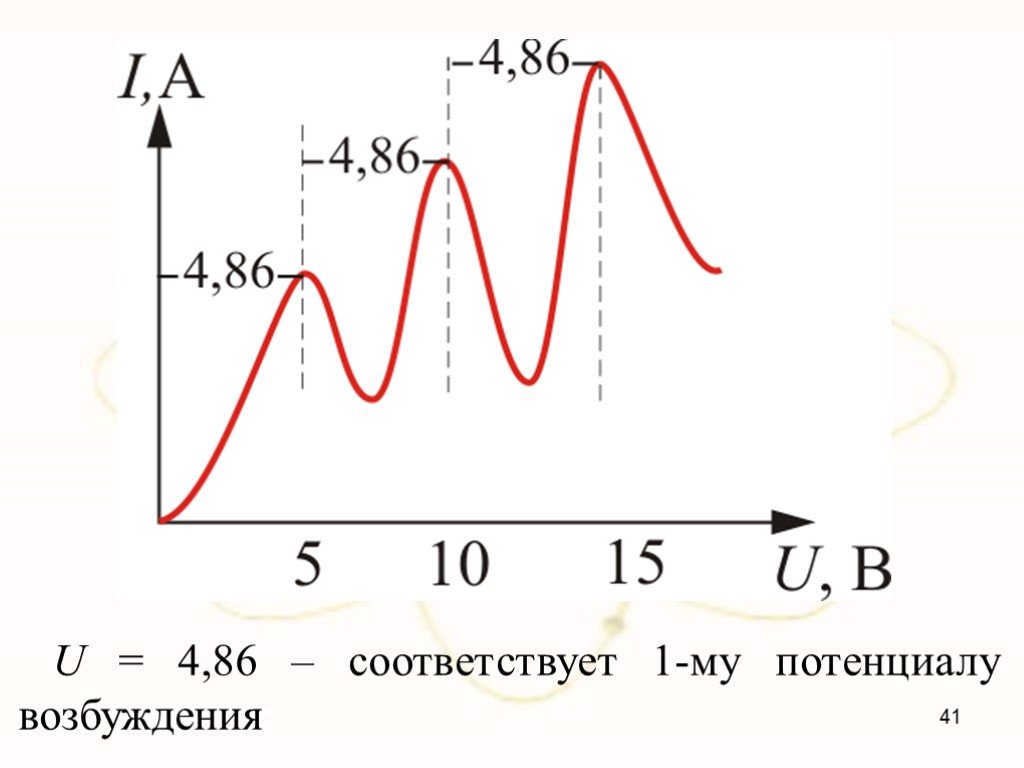
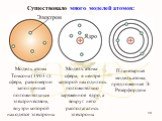
В 1903 году английским ученым Томсоном была предложена модель атома, которую в шутку назвали «булочкой с изюмом». По его версии атом представляет ..."Постулаты Бора. Модель атома водорода по Бору." Презентация: Атомная физика: Постулаты Бора. Модель атома водорода по Бору.
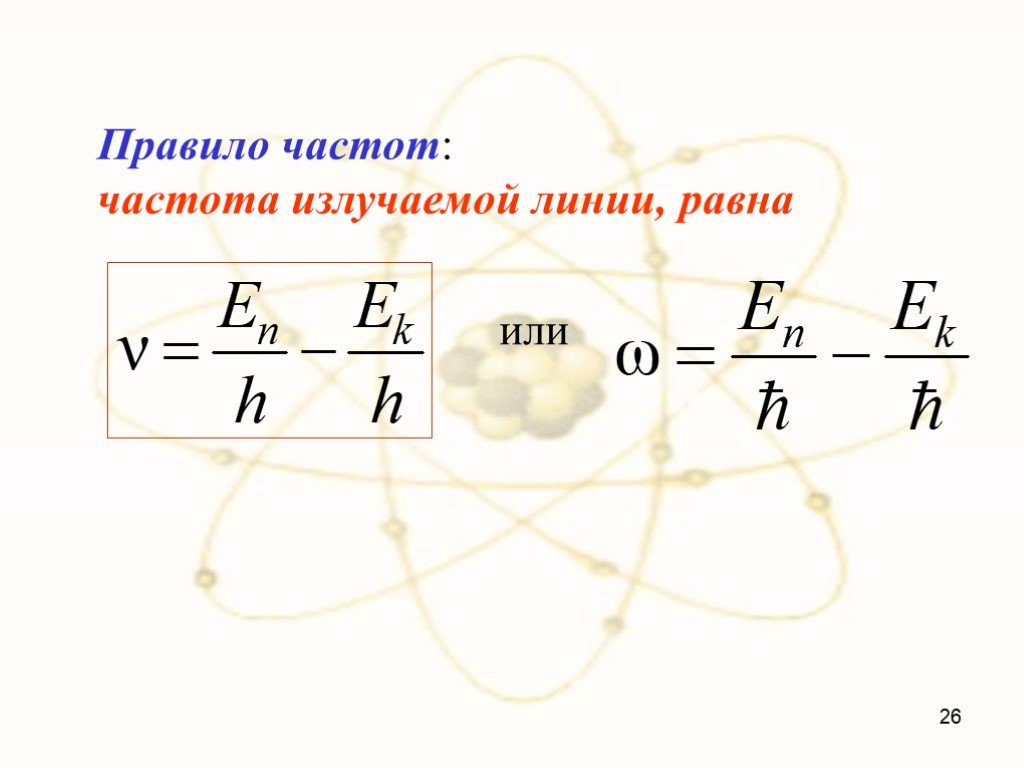
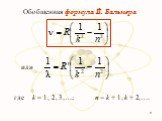
Постулаты Бора Нильс Бор 1885-1962. Первый постулат Бора: атомная система может находится только в особых стационарных, или квантовых, состояниях, ...Эрнест Резерфорд. Планетарная модель атома
«Безразлично, с чего начинать рассказ о трудах и днях великого человека. Большая и цельная жизнь как глобус: острова и материки, в каком бы отдаленье ...Планетарная модель атома
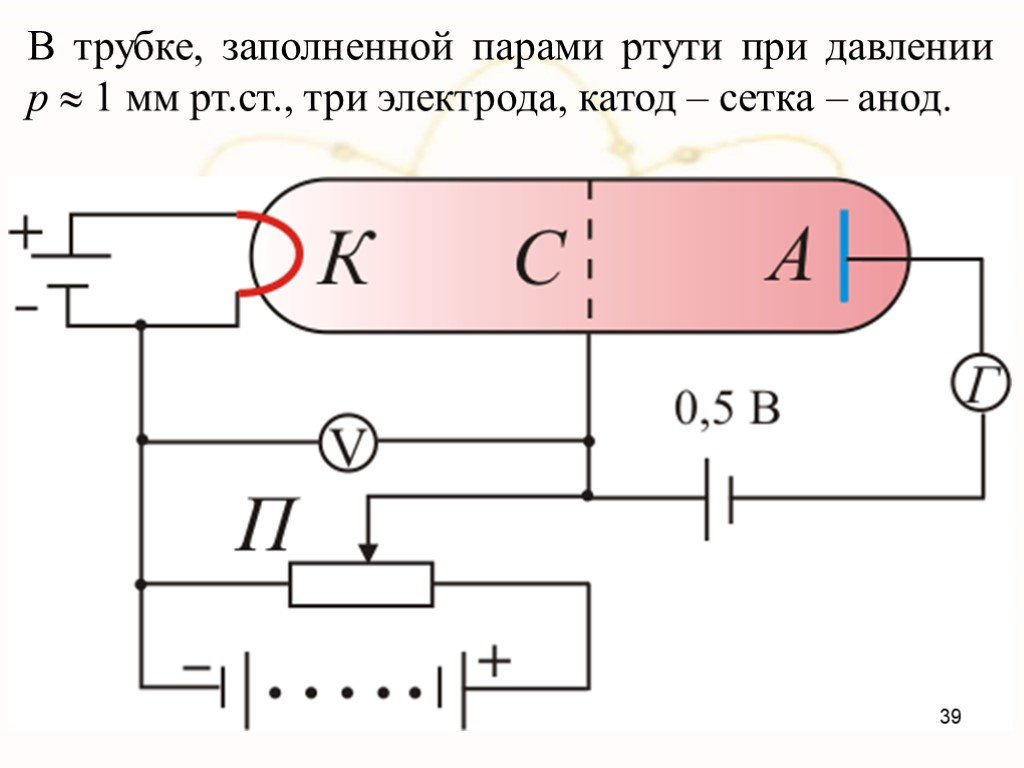
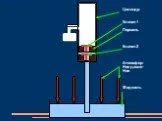
Модели атомов, созданные до 1910 года были умозрительными, их справедливость нужно было подтвердить или опровергнуть с помощью эксперимента. Решающий ...Планетарная модель атома
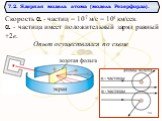
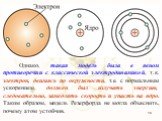
Д.Д. Томсон 1856 — 1940 гг. ЭЛЕКТРОН. ПОЛОЖИТЕЛЬНО ЗАРЯЖЕННОЕ ОБЛАКО. «ПУДИНГ С ИЗЮМОМ». ЦЕЛЬ ОПЫТА: проверить, является ли правильной модель Томсона. ...Планетарная модель атома
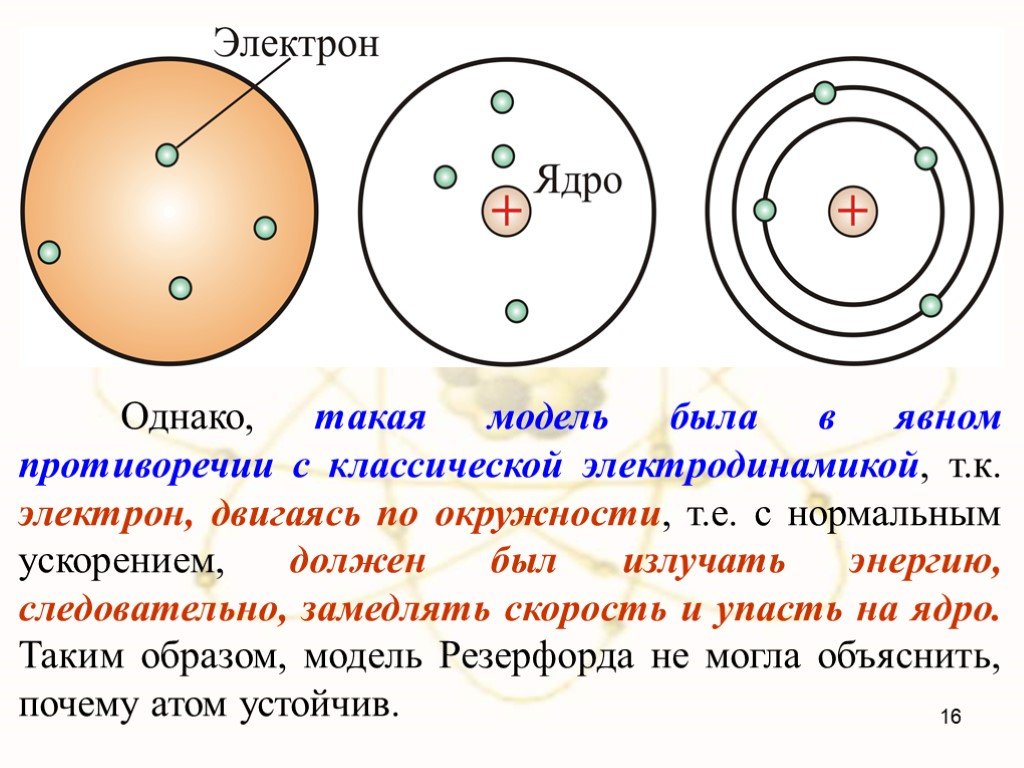
Структура атома. Планетарная модель – модель строения атома, предложенная английским физиком Резерфордом, согласно которой атом так же пуст, как Солнечная ...Модели атома
Проверка домашнего материала:. Как назвали способность атомов некоторых химических элементов к самопроизвольному излучению? Как были названы частицы, ...Элементарные частицы атома
Этап второй. От позитрона до кварков: 1932—1964 гг. Ни одна из частиц не бессмертна. Большинство частиц, называемых сейчас элементарными, не может ...Электризация тел. Два ряда зарядов. Электрон. Строение атома
Как обнаружить электрические заряды? Почему гильзы разошлись? Почему… изгибается струя воды? Притягиваются легкие бумажки к палочке из стекла? Получит ...Физика атома
ядерная энергия - что ЭТО ? Почему мирный атом стал угрозой обществу ? Как ядерная энергия используется в медицине , технических устройствах , машинах ...Теория атома Бора
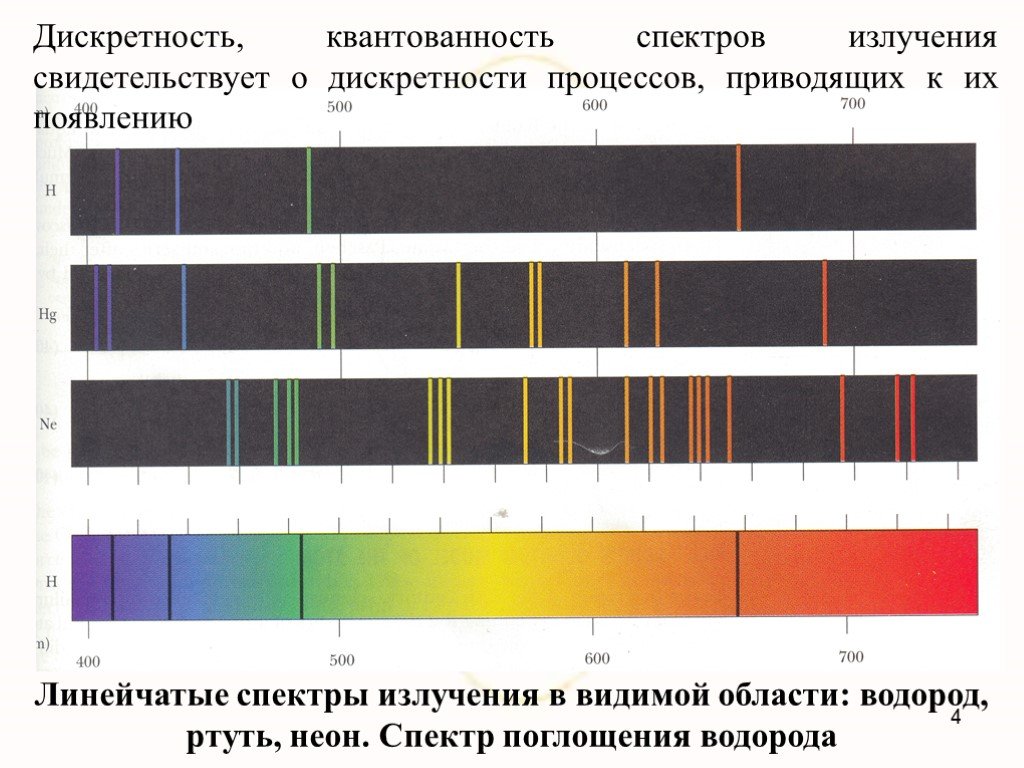
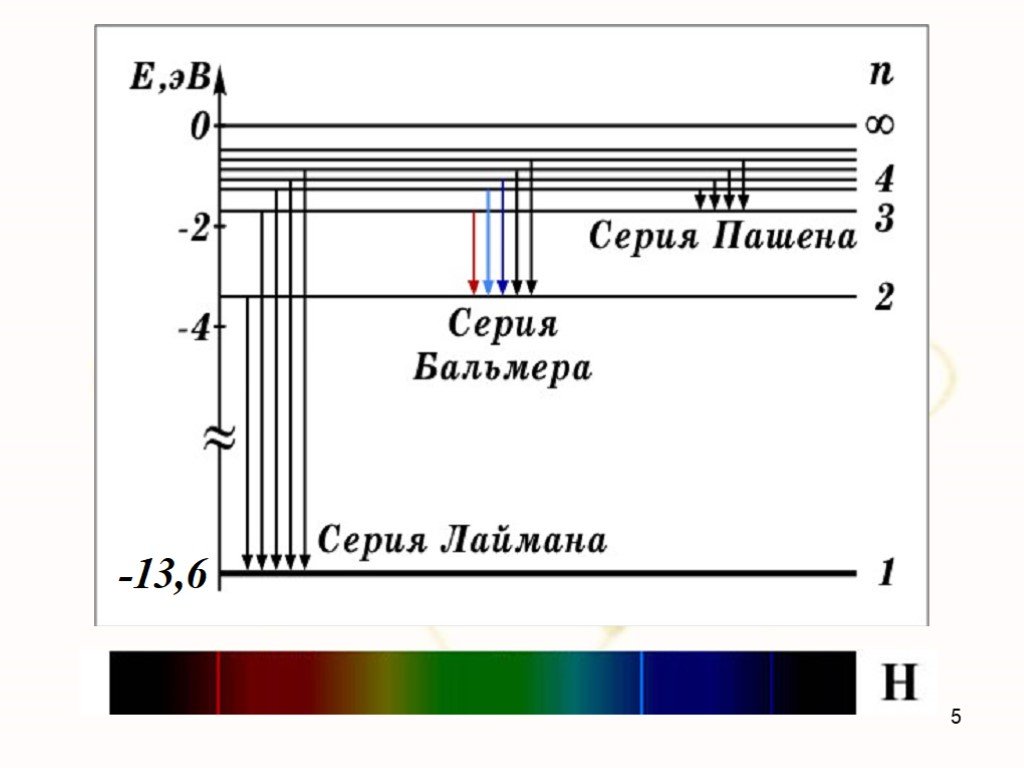
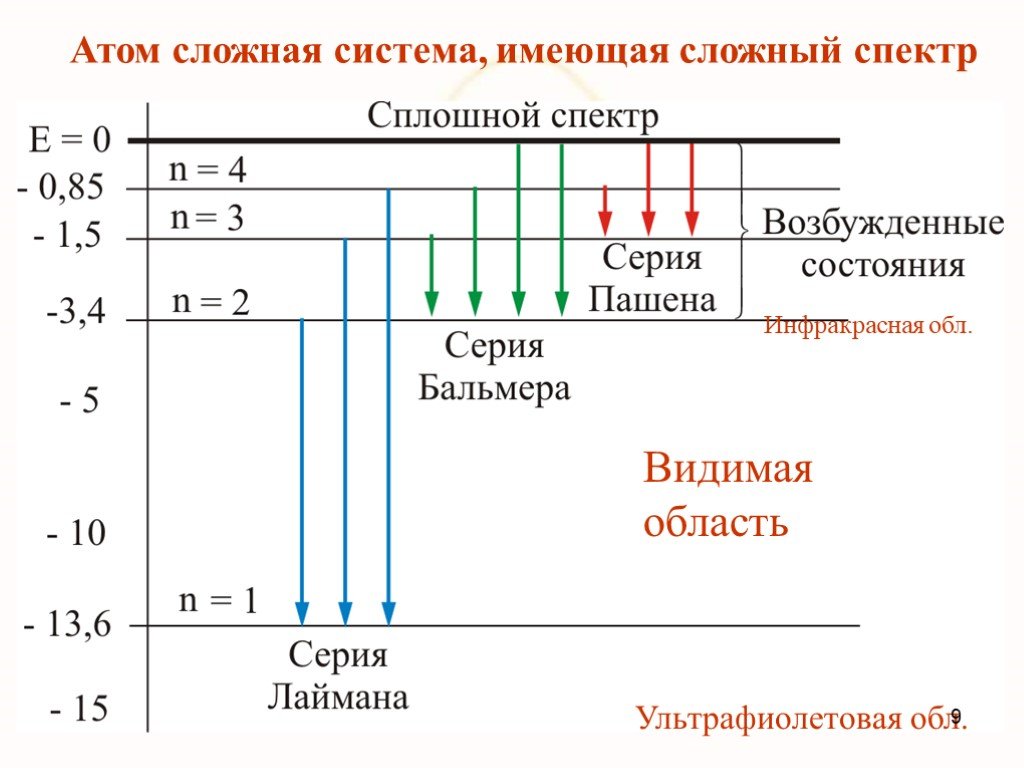
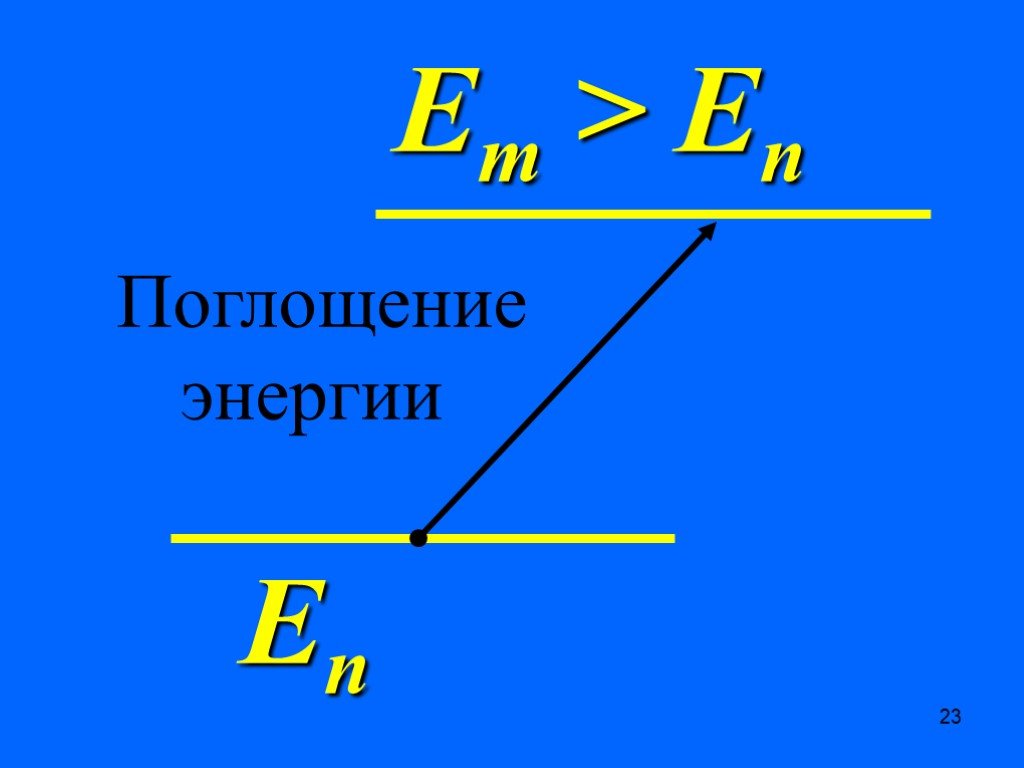
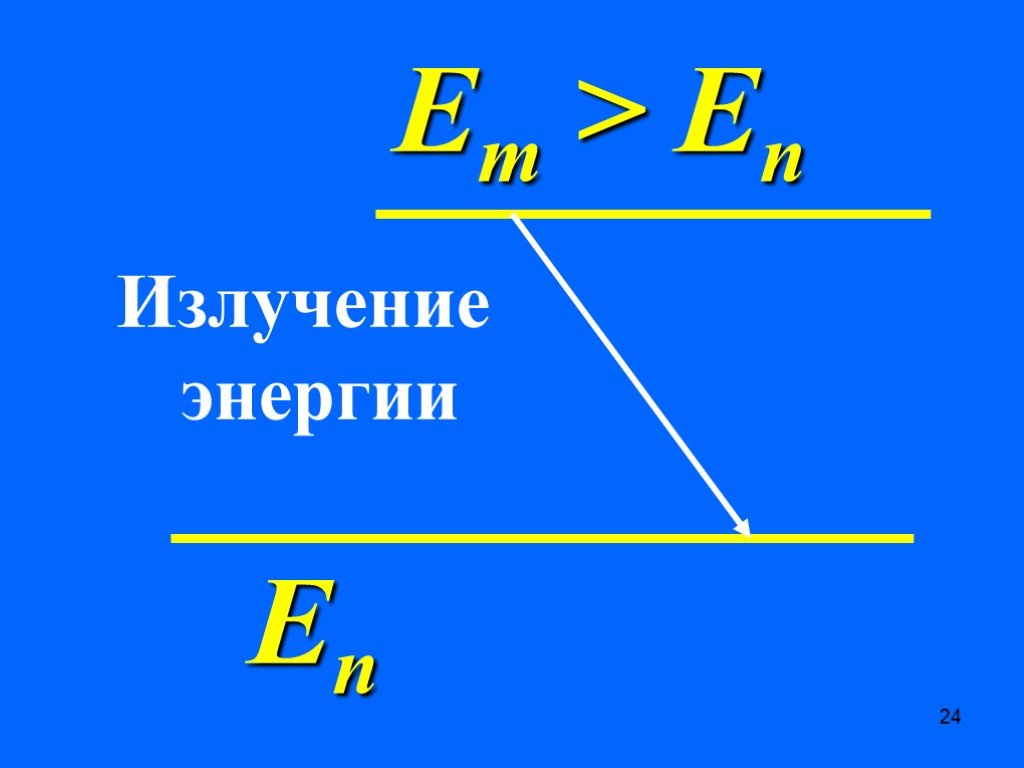
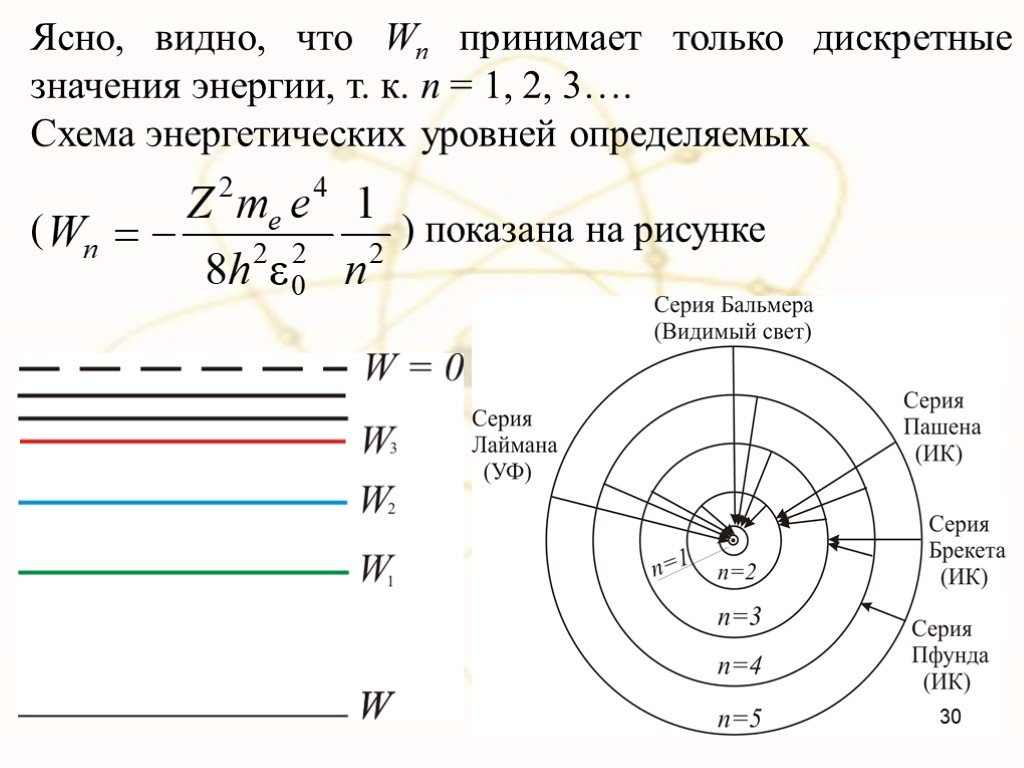
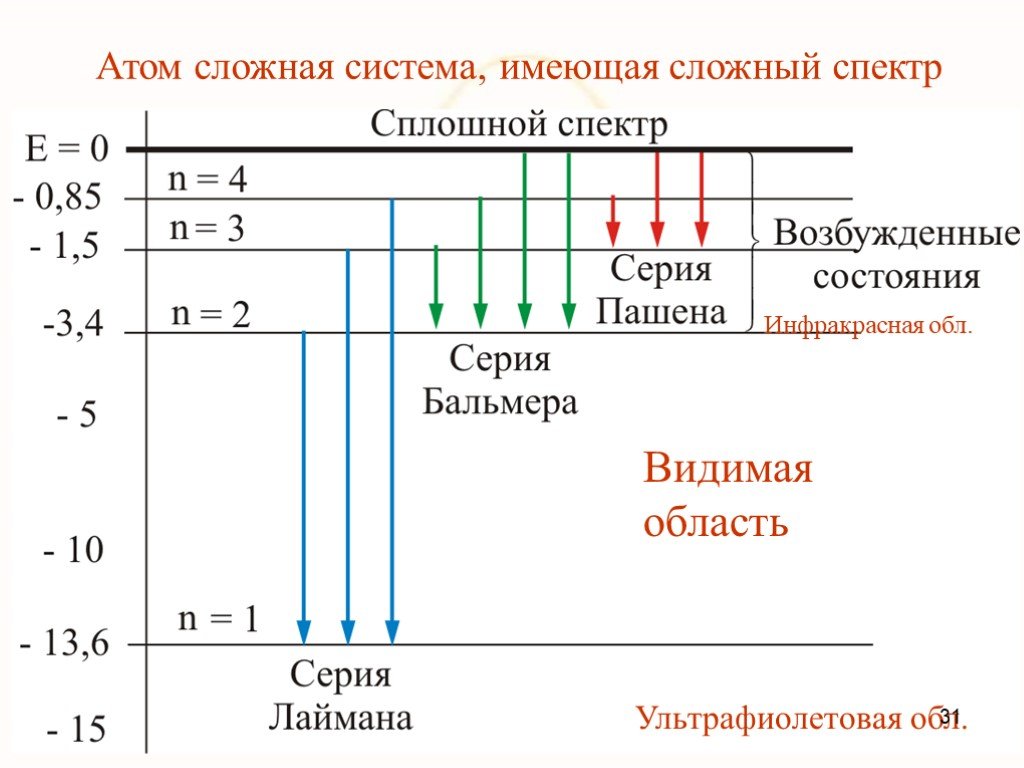
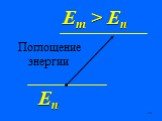
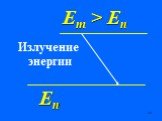
Недостатки модели Резерфорда:. § 8.2. Линейчатый спектр атома водорода. ультрафиолетовая область : серия Лаймана m=1 n=2,3,4,5, видимая область спектра ...Строение атома элемента
Строение атома. Кто открыл явление радиоактивности? Кто ввел в физику термин «радиоактивность»? Какой химический элемент стал первым известным радиоактивным ...Строение атома Квантовая физика
строение атома 11 квантовая физика ФИЗИКА КЛАСС. Данный урок проводится по типу телевизионной передачи…. Квантовая физика. Строения атома. ВЫХОД. ...Открытия, разрушившие представление о неделимости атома
...Факты, не объяснимые существующими теориями, наиболее дороги для науки, от их разработки следует по преимуществу ожидать ее развития в ближайшем ...Модель флюгерного оконного генератора для вырабатывания электрического тока
ВВЕДЕНИЕ. Актуальность исследования. Физические явления, лежащие в основе работы флюгерного оконного генератора. 1. Явление электромагнитной индукции. ...Модель расчета мощности лаборатории
Этапы выполнения исследований (границы модели). 1. Преаналитический этап частично проводится вне централизованной КДЛ и включает: прием пациента врачом ...Модель работы поршневого насоса
Остановка. Верхний клапан закрыт Нижний клапан открыт. Начало движения поршня вниз. Верхний клапан закрыт Нижний клапан закрыт. Движение поршня вверх. ...Строение атома и его электронных оболочек
Тема урока "Строение атома и его электронных оболочек». Цель урока: сформировать у учащихся понятия о строении атома и электронных оболочек, познакомить ...Строение атома и опыты
Автор презентации «Строение атома» Помаскин Юрий Иванович - учитель физики МОУ СОШ№5 г. Кимовска Тульской области. Презентация сделана как учебно-наглядное ...Радиоактивность . Строение атома
Левкипп Демокрит. Атом – «неделимый». 2500 лет назад. 1896 г. – открытие радиоактивного излучения «Лучи Беккереля». Анри Беккерель (1852-1908). Особые ...Конспекты
Модель строения атома
Муниципальное образовательное учреждение. средняя общеобразовательная школа №11. Выксунского района Нижегородской области. Конспект ...Строение атома и атомного ядра
9 класс. . Урок № 8 в теме « Строение атома и атомного ядра». Ядерные силы, ядерные реакции. Энергия связи. Дефект масс. Цели урока : ...Строение атома
Тема. «Строение атома». . 8 класс. Цели для ученика:. Общая цель. :. совершенствовать. знания об электрических явлениях. Образовательные задачи. ...Строение атома
Муниципальное бюджетное общеобразовательное учреждение. «Авнюгская средняя общеобразовательная школа». Верхнетоемского района Архангельской области. ...Ренессанс «мирного атома
Повторительно - обощающий урок по теме:. «Ренессанс «мирного атома» или его закат?». (11 класс). “Знание становится живым, если оно применяетсядля ...Путешествие в мир атома
Клюшина Ж.В.,. . учитель физики МБОУ СОШ №37. . г. Шахты Ростовской области. Тема урока: «Путешествие в мир атома». Цели урока:. Образовательные:. ...Основные сведения о строении атома
Конспект урока с применением ЛСМ (логико-смысловой модели). Тема «Основные сведения о строении атома». . 11 класс (базовый уровень). Цель: ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:31 декабря 2018
Категория:Физика
Содержит:48 слайд(ов)
Поделись с друзьями:
Скачать презентацию