Конспект урока «Фенол» по химии
образовательные: изучить строение, физические, химические свойства, применение фенола;
развивающие: продолжить формировать у учащихся умение сравнивать, анализировать, делать выводы;
воспитательные: доказать, что методы химии и химические технологии широко используется для предотвращения губительного действия производственной деятельности человека на природу.
Оборудование:
-
прибор очистки сточных вод от фенола адсорбционным методом,
-
карта города Уфы и физическая карта России.
Девиз урока: “В химии всё возможно” (Ш. Вюрц)
ХОД УРОКА
I.Проверка знаний
Графический диктант ”Многоатомные спирты”.
На столах лежат заранее приготовленные листочки с начерченной прямой, разделенной на 15 отрезков и пронумерованной соответственно вопросам диктанта.
Отметить шалашиком “^” на отрезке номер положения, которое считается неверным, с которым не согласны.
I вариант все положения диктанта рассматривает применительно к этиленгликолю.
II вариант все положения диктанта рассматривает применительно к глицерину.
ГРАФИЧЕСКИЙ ДИКТАНТ
-
Это двухатомный спирт.
-
Этот спирт относится к трехатомным.
-
tº кипения равна 197,6ºС
-
Закипает при tº=290ºС
-
Вещество очень ядовито
-
Неядовитое вещество
-
По физическим свойствам это бесцветное сиропообразная жидкость сладковатого вкуса
-
Реагирует с активными металлами
-
Качественной реакцией на этот спирт является взаимодействие его с гидроксидом меди с образованием ярко-синего раствора.
-
Его используют дл получения взрывчатых веществ
-
Он необходим для приготовления антифризов
-
Применяется для синтеза лавсана
-
Используется в медицине, парфюмерии, в кожевенном производстве, в текстильной промышленности
-
Получают его из пропилена, образующего при крекинге нефтепродуктов
-
Он образуется при окислении этилена перманганатом калия
-
Работа над темой урока.
Учитель:
Продолжим знакомство с кислородсодержащими органическими соединениями. Сегодня мы исследуем фенол по плану (на доске):
1.Строение
2.Получение.
3.Физические свойства .
4.Химические свойства.
5.Фенол и экология.
6.Фенол и медицина.
7.Применение.
1.Строение
В состав молекулы фенола входит бензольное ядро. Если мысленно вычесть из формулы молекулы бензола один атом водорода, то получается группа атомов C6H5--, называемая фенилрадикалом. Он обладает свойством оттягивать к себе электроны кислородного атома гидроксильной группы. Поэтому в молекуле фенола химическая связь между атомом кислорода и атомом водорода становится более полярной, а водородный атом более подвижен и реакционноспособен.
2.Получение
Фенол выделяют из каменноугольной смолы. Но этого источника недостаточно, так как потребность в феноле велика, поэтому разработаны синтетические методы получения фенола. Один из них осуществляется по следующей схеме:
C6H6 → C6H5Cl → C6H5OH
Но этот способ экономически относительно дорогой. Существуют более дешёвые способы получения фенола из бензола. Упрощённо процесс получения фенола одним из таких способов можно изобразить так:
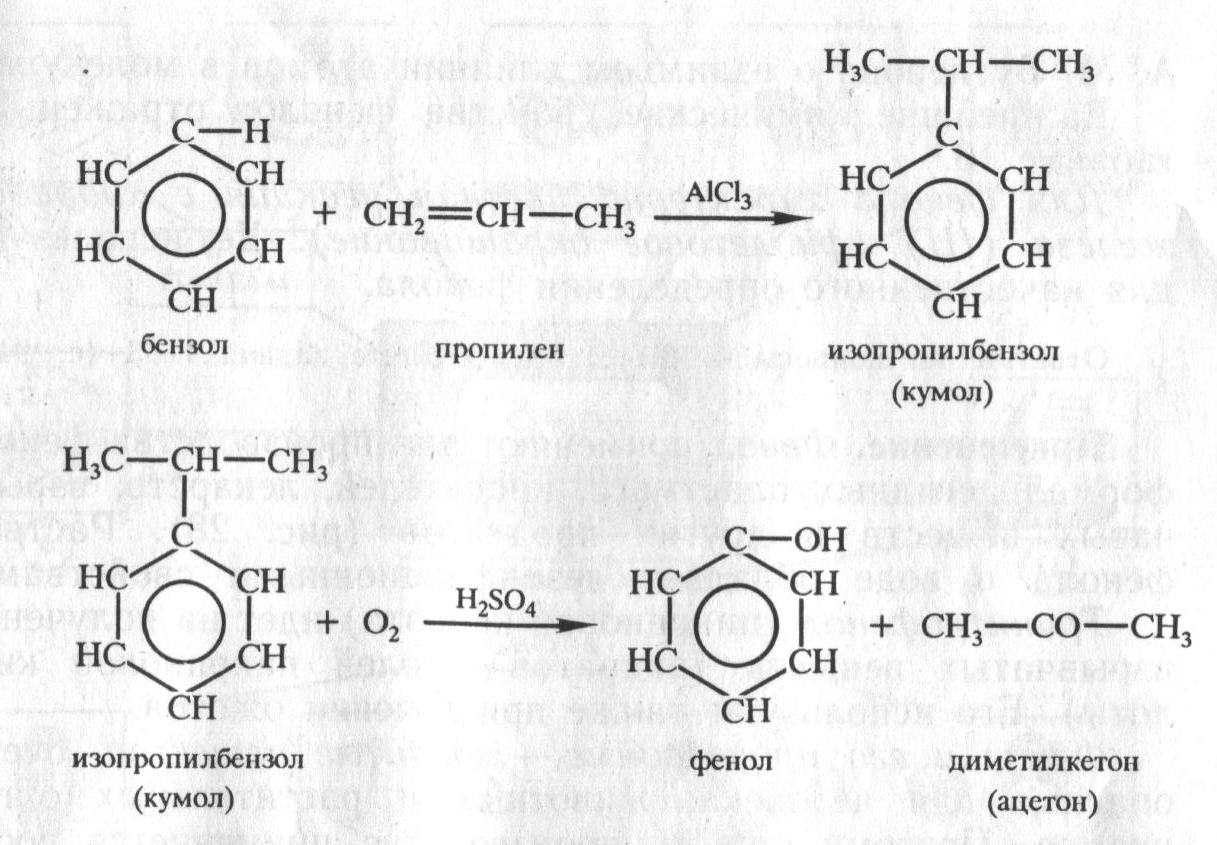
Сейчас во всём мире практически вся масса вырабатываемого фенола и ацетона производится этим способом.
3.Физические свойства:
Фенол – бесцветное, кристаллическое вещество с характерным запахом. Его температура плавления 42 градуса по Цельсию. В холодной воде он мало растворим, но уже при 700 растворяется в любых отношениях.
Фенол ядовит!
4.Химические свойства
обусловлены наличием в его молекуле гидроксильной группы и бензольного ядра, которые взаимно влияют друг на друга. Наличие гидроксильной группы предопределяет сходство фенола со спиртами. Влияние бензольного ядра на гидроксильную группу обусловливает большую подвижность её водородного атома. Поэтому фенол, в отличие от спиртов, реагирует с щелочами, то есть обладает свойствами слабых кислот. Его иногда называют карболовой кислотой. Это объясняется тем, что бензольное ядро оттягивает к себе электроны кислородного атома гидроксильной группы. Чтобы компенсировать это, атом кислорода сильнее притягивает к себе электронную плотность от атома водорода. Вследствие этого ковалентная связь между атомами кислорода и водорода становится более полярной, а атом водорода – более подвижным. Гидроксильная группа в свою очередь придет атомам водорода большую подвижность в положении 2,4,6. Это один из многих примеров, подтверждающих тезис теории А.М. Бутлерова о взаимном влиянии атомов в молекулах.
Важнейшие химические свойства фенолов отражены в таблице 10 учебника .
Для фенола характерна цветная реакция с хлоридом железа (3) (фиолетовое окрашивание). Её используют для качественного определения фенола.
5. Фенол и экология.
Что вы знаете из курса географии Башкортостана о вреде фенола?
(Рассказ ученика.)
Сообщение “эколога”.
Задача.
Фенольное загрязнение обычно соответствует нефтяному.
В 1995 г. На реке Казым (Ханты-Мансийский автономный округ) были взяты 3 пробы воды для химического анализа объемом по 100 мл. каждая. Масса фенола в этих пробах составила 0.00140; 0.00170; 0.00155 мг.
Рассчитайте среднюю концентрацию фенола (мг/л) и сравните её с ПДК в метах водопользования (0.001 мг/л).
Решение:
С1=0.0140 мг/л
С2=0.0170 мг/л
С3=0.0155 мг/л
Ссред=0.0155 мг/л > 0.001 мг/л (ПДК)
Вода загрязнена, ПДК в 15 раз больше. Значит, нужна очистка воды от фенола.
Сообщение “инженера-технолога”.
Посмотрите на одну из моделей промышленной очистки сточных вод адсорбционным методом. [“Химия в школе”, №2-2000, с.77]
6.Фенол и медицина.
Сообщение “медработника”.
Применение фенола как дезинфицирующего средства началось ещё в 1865 г., когда шотландский хирург Джозеф Листер обработал раны больного раствором фенола, 30 г. которого содержались в 3 л. Воды. Такой раствор за 5 минут убивал практически все микробы. Правда, фенол оказывает сильное раздражающее действие на живые ткани, поэтому со временем его стали заменять другими веществами. Например, крезолом, антисептическое действие которого удобнее.
Учитывая пионерскую роль фенола как антисептика, действие даже самых новых антисептических средств до сих пор измеряют фенольным коэффициентом, показывающим, во сколько раз данный антисептик действует сильнее фенола.
7.Применение фенола.
Сообщение “менеджера”.
-
Закрепление.
Природные соединения – ментол и тимол, содержащиеся в эфирных маслах растений – мяты перечной и тимьяна обыкновенного, имеют следующее строение:
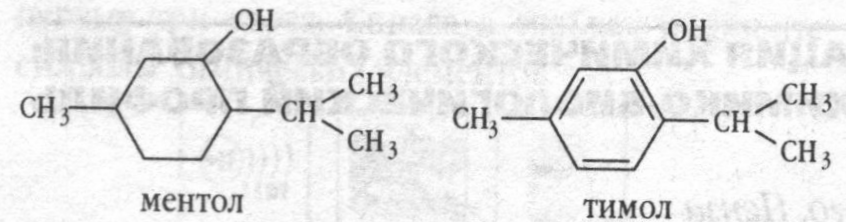
Укажите принадлежность этих веществ к определенным классам органических соединений.
-
Итоги. Выводы. Оценки учащимся.
-
Что нового узнали?
-
Чему научились?
-
Всё ли мы знаем об органических веществах?
-
Что еще предстоит узнать?
-
Домашнее задание
§3. Задача 1, упр.7, с. 94.
Литература
-
Рудзитис Г.Е., Фельдман Ф.Г. Органическая химия. Учебник для 10 класса средней школы. – М.: Просвещение, 1991.
-
Журнал «Химия в школе”, №2. 2000, с.77.
Здесь представлен конспект к уроку на тему «Фенол», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Химия Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

