Тест «Механизация сельского хозяйства» по химии





























































































Государственное бюджетное образовательное учреждение
Саратовской области среднего профессионального образования
«Базарнокарабулакский техникум агробизнеса»
Утверждаю Заместитель директора по УР: ______________________ Н.А.Зайчикова «___»_________20___ г.
Комплект контрольно-оценочных средств
для оценки результатов освоения
учебной дисциплины «Химия»
основной профессиональной образовательной программы (ОПОП)
по специальности СПО
110809 «Механизация сельского хозяйства»
Базарный Карабулак
2013
Разработчики: ГБОУ СО СПО «Базарнокарабулакский техникум агробизнеса», Евдокова Н.А., преподаватель естественно-научных дисциплин
Рассмотрено на заседании цикловой комиссии математических и общих естественно - научных дисциплин
Протокол № __ от «__» ___________ 201__ г.
Председатель: ______С.В. Мельникова
Утверждено методическим советом техникума
Протокол № __ от «__» __________ 201__ г.
-
Паспорт комплекта контрольно-оценочных средств
Комплект контрольно-оценочных средств предназначен для оценки результатов освоения учебной дисциплины «Химия».
В результате оценки осуществляется проверка следующих объектов:
| Показатели оценки результата по каждому объекту оценивания | Критерии, признак, на основе которого производится оценка по показателю | Тип задания; № задания | Форма аттестации | |
| У 1: уметь объяснять роль химии в формировании научного мировоззрения У 2. уметь назвать изученные вещества по тривиальной и международной номенклатуре У 3. уметь определять валентность, степень окисления, тип химической связи в соединениях, заряд иона, окислитель и восстановитель, принадлежность веществ к различным классам органических и неорганических веществ У 4. Уметь объяснить строение Периодической системы, общие химические свойства металлов и неметаллов У 5. Уметь объяснить зависимость свойств веществ от их строения и состава, природы химической связи зависимости скорости химических реакций, химического равновесия У 6. Уметь выполнять химический эксперимент, проводить самостоятельный поиск информации с использованием различных источников У 7. Уметь связывать изученный материал с профессиональной деятельностью У 8. Уметь решать задачи по химическим формулам и уравнениям | Объяснение роли химии в формировании научного мировоззрения Объяснение названия веществ по тривиальной и международной номенклатуре Объяснение определения валентности, степени окисления, типа химической связи, заряда иона, принадлежность веществ к разным классам органических и неорганических соединений Объяснение строения Периодической системы, общие свойства металлов и неметаллов и их соединений Объяснение зависимости свойств веществ от их строения и состава, природы химической связи, зависимости скорости химических реакций, и химического равновесия Использование лабораторной посуду и оборудования. Использование различных источников (научно-популярных изданий, компьютерных данных, ресурсов интернета) использование компьютерных технологий для обработки и передачи химической информации Перечисление областей практического применения полученных химических знаний и умений Объяснение алгоритмов решения химических задач | Дано объяснение роли химии в формировании научного мировоззрения в полном объёме Дано объяснение названия веществ по тривиальной и международной номенклатуре Валентность, степень окисления, заряд иона, основные классы органических и неорганических веществ освоены в полном объёме Строение Периодической системы, свойства металлов и неметаллов, а также их соединений изучены в полном объёме Свойства веществ их строение и состав, скорость химических реакций, химическое равновесие изучено в полном объёме Перечислены источники информации о химических объектах, (учебники, справочники, научно-популярные издания. Компьютерные базы, ресурсы Интернета) Названы области практического применения химических знаний Химические задачи решены верно | Практическое задание: работа с опорным конспектом, текстом в учебнике. Практическое задание: дать название формулам по тривиальной и международной номенклатуре Комплекты упражнений по определению валентности, степени окисления, заряда иона и основных классов органических и неорганических веществ. Практическое задание: на конкретных примерах необходимо дать характеристики элементам по Периодической системе Практическое задание: Комплект задач на определение скорости химических реакций и смещения химического равновесия Практическое задание: Работа с дополнительными источниками информации Практическое задание: Составить план схему применения химических наук в различных областях практической деятельности и в повседневной жизни Практическая работа: Комплект задач по органической и неорганической химии | Диф. зачет Диф. зачет Диф. зачет Диф. зачет Диф. зачет Диф. зачет Диф. зачет Диф. зачет |
| З-1 знать и понимать основные химические понятия З-2 Знать основные законы химии З-3 Знать важнейшие вещества и материалы используемые в химической промышленности и повседневной жизни З-4 Знать объяснения химическим явлениям, происходящим в природе, быту, на производстве. Протекание химических превращений в различных условиях и оценка их последствий З- 5 Знать влияние химического загрязнения окружающей среды на организм человека и другие живые организмы, также безопасность обращения с горючими и токсичными веществами и лабораторным оборудованием З-6: знать теоретические основы органической химии; З-7: знать понятие химической кинетики и катализа; З-8: знать классификацию химических реакций и закономерности их протекания; З-9: знать обратимые и необратимые химические реакции, химическое равновесие, смещение химического равновесия под действием различных факторов; З-10: знать гидролиз солей, диссоциацию электролитов в водных растворах, понятие о сильных и слабых электролитах; З-11: знать характеристики различных классов органических веществ | Объяснение сущности важнейших химических понятий Понимание основных законов химии для решения расчетных задач и осуществления химических процессов в производстве Понимание на основе каких свойств можно использовать химические вещества и материалы в промышленности и повседневной жизни человека Дано объяснение химическим явлениям, происходящим в природе, быту и на производстве и различные условия для их осуществления Объяснено влияние химического загрязнения окружающей среды на организм человека и другие живые организмы, а также безопасность обращения с горючими и токсичными веществами и лабораторным оборудованием Понимание значения практики и вопросов, возникающих в самой химии для формирования и развития химической науки Понимание законов лежащих в основе о-в реакций Понимание законов лежащих в основе реакций гидролиза и реакций ионного обмена Понимание сущности законов вычисления количества выделившейся или поглотившейся теплоты Дано объяснение химическим явлениям, происходящим в природе, быту и на производстве и различные условия для их осуществления Понимание на основе каких свойств можно использовать химические вещества и материалы в промышленности и повседневной жизни человека | Дано определение и объяснение основных химических понятий и основных положений полностью Даны определения основных законов химии для решения расчетных задач и осуществления химических процессов в производстве Даны основные вещества и сплавы, материалы, которые используются в промышленности и повседневной жизни человека Химические процессы протекающие в природе, быту, на производстве описаны полностью; воспроизведены все этапы химических процессов Даны определения сущность химической науки для окружающей среды, живых организмов, а также безопасность обращения с горючими и токсичными веществами и лабораторным оборудованием Химические процессы описаны полностью Химические процессы описаны полностью Дано определение сущности химической науки для решения задач, возникающих в теории и практики Химические процессы описаны полностью; воспроизведены все этапы химических процессов Химические процессы описаны полностью Химические процессы описаны полностью | Теоретическое задание: Работа с учебником и дополнительной литературой по данным темам Теоретическое задание: Работа с учебником и дополнительной литературой Теоретическое задание: Работа с учебником, дополнительной литературой, Интернет-ресурсами Теоретическое задание: Работа с конспектами по данным темам Практическое задание: Работа с тестами Теоретические задания Практические задания: Тесты в оболочке Veraltest Практические задания: Тесты в оболочке Veraltest Практические задания: Тесты в оболочке Veraltest Практические задания. Тесты в оболочке Veraltest Теоретические задания: Работа с конспектами по данной теме | Диф. зачет Диф. зачет Диф. зачет Диф. зачет Диф. зачет Диф. зачет Диф. зачет Диф. зачет Диф. зачет Диф. зачет Диф. зачет |
Комплект контрольно-оценочных средств.
2.1 Текущая аттестация.
2.1.1 Тесты
Тема: «Основные понятия и законы химии»
Исходя из определений, впишите соответствующие слова
-
Наука о веществах и их превращения друг в друга изучает………(химия)
-
Вид материи, имеет определенный состав, строение и характерные, постоянные в данных условиях, свойства называется…………(веществом)
-
Описание вещества по следующим параметрам: агрегатное состояние при обычных условиях, цвет, блеск, твердость, мягкость, хрупкость, запах, вкус, плотность, температура кипения или плавления, электропроводность и теплопроводность, растворимость в воде или других веществах являются ,……….(физическими) свойствами веществ
-
Способность одного вещества взаимодействовать с другими веществами и превращаться в те или иные вещества называют ……..(химическими) свойствами веществ.
-
Наименьшая частица химического элемента, носящая его свойства, называется……..(атомом)
-
Наименьшая частица веществ молекулярного строения это ……..(молекула)
-
Вид атома с одинаковым зарядом ядра ,это ……….(химический ) элемент
-
Вещество, образованное атомами одного химического элемента, называют…….(простым) веществом
-
Вещество, образованное атомами разных химических элементов, называют…….(сложным) веществом
-
Условная запись состава вещества посредством символов элементов и индексов, называют……..(химической) формулой
-
Число структурных единиц вещества, выраженные в молях, есть ……..(количество) вещества
-
Реакции, входе которых из нескольких простых веществ или сложных образуется одно вещество, называются ……..(соединения)
-
Реакции, в ходе которых из сложного вещества образуется несколько других простых или сложных веществ, называют…….(разложения)
-
Реакции, в ходе которых в результате взаимодействия простого и сложного вещества образуется другое простое и другое сложное вещество, называют…….(замещения)
-
Реакции, в ходе которых в результате взаимодействия двух сложных веществ образуется два других сложных вещества, называют………(обмена)
Тема: «Основные понятия и законы термодинамики»
Исходя из определений, впишите соответствующие слова
-
Термодинамика изучает законы взаимных превращений различных видов………….(энергии)
-
Химическая термодинамика изучает изменения энергии в результате процессов в материальных системах, приводящих к изменению ……..
и ……… физических тел (состава и свойств)
3. Термодинамическая система, которая может получать или отдавать теплоту в окружающую среду и производить работу называется……….(незамкнутой)
4.Система, которая не обменивается с другими системами веществом и энергией называют……….(замкнутой)
5 Система, в которой все свойства одинаковы называют……….(однородной)
6. Системы, между частями которой нет поверхностного раздела называют………(гомогенной)
7. Система, состоящая из различных по свойствам частей, разграниченных поверхностями раздела называют……….(гетерогенной)
8. Совокупность одинаковых гомогенных частей гетерогенной системы, разграниченных поверхностями раздела называют…………(фазой)
9. Мера энергии, переданной путем беспорядочного движения частиц системы, является……………(количеством теплоты)
10. Мерой энергии, переданной путем упорядоченного движения таких частиц, является ……….. (работа)
11. Изучением тепловых эффектов химических реакций занимается………(термохимия)
12. Основу технологических процессов пищевых производств составляют законы сохранения………. и……….(энергии и массы0
13. Движущей силой тепловых процессов является …………температур(разность)
-
Тематический зачет.
Тема: Дисперсные системы. Коллоидные растворы.
-
Молекулярно-кинетические и оптические свойства коллоидных систем.
-
Дисперсные системы, их классификация.
-
Методы получения коллоидных систем.
-
Очистка коллоидных систем.
-
Агрегатная устойчивость коллоидных систем
-
Коагуляция коллоидных растворов. Порог коагуляции.
-
Пептизация.
-
Набухание. Виды набухания
-
Физико-химические свойства студней
-
Суспензии. Какой вид устойчивости для них характерен?
-
Что представляют собой эмульсии? Как их классифицируют?
-
Какие методы стабилизации эмульсий известны?
-
Какими свойствами должен обладать эмульгатор?
-
Какие дисперсные системы называются пенами?
-
От чего зависит устойчивость пены? Как можно её разрушить?
-
Что такое аэрозоли, какими основными свойствами они обладают?
-
Расскажите об использовании свойств пенообразования в кондитерском и пищевом производствах.
Тема: Химическая кинетика и катализ. Химическое равновесие и скорость химических реакций. Свойство растворов.
Задание с выбором ответа
1.Гомогенной является реакция между:
А. оксидом меди(2) и соляной кислотой; Б. магнием и кислородом;
В. серой и железом; Г. азотом и кислородом.
2. Гетерогенной является реакция между:
А. серой и кислородом; Б. азотом и водородом;
В. оксидом серы(4) и кислородом; Г. этанолом и уксусной кислотой.
3.Скорость химической реакции не зависит:
А.от концентрации реагирующих веществ;
Б. от природы реагирующих веществ;
В. от объема сосуда; Г. от температуры.
4. Изменение давления влияет на скорость реакции между:
А.железом и соляной кислотой; Б. серой и железом;
В. серой и кислородом; Г. соляной кислотой и гидроксидом калия.
5. Оцените правильность суждений:
А. При понижении давления скорость реакции с участием газообразных веществ уменьшается.
Б. Катализатор- вещество, которое ускоряет химическую реакцию, но само в ней не участвует.
А. верно только А; Б. верно только Б;
В. верно оба суждения; Г. оба суждения неверны.
6. При химическом равновесии в реакционной системе концентрации исходных веществ и продуктов реакции:
А. равны; Б. не изменяются
В. увеличиваются для продуктов, уменьшаются для исходных веществ;
Г. уменьшаются для продуктов, увеличиваются для исходных веществ.
7. Оцените правильность суждений:
А. Повышение температуры смещает равновесие в сторону эндотермической реакции.
Б. Катализатор увеличивает скорость прямой и обратной реакции, но не вызывает смещение химического равновесия.
А. верно только А; В. верны оба суждения;
Г. оба суждения неверны.
8. Оцените правильность суждения:
А. Повышение давления смещает равновесие в сторону образования продуктов реакции.
Б. Повышение концентрации любого из исходных веществ приводит к смещению равновесия в сторону образования продуктов реакции.
А.верно только А; Б. верно только Б;
В. верно оба суждения; Г. оба суждения неверны.
9. При сжигании 64г. серы выделилось 594 кДж теплоты. Теплота образования оксида серы(4) равна:
А. 148,5 кДж; Б. 297 кДж; В. 594кДж; Г. 1188кДж.
10. Степень диссоциации веществ не зависит от:
А.природы вещества;
Б. молярной массы растворенного вещества;
В. температуры раствора;
Г. концентрации растворенного вещества.
11. Слабыми электролитами являются все группы веществ:
А. фосфат натрия, уксусная кислота, сульфат натрия;
Б. гидроксид натрия, серная кислота, вода;
В. хлорид натрия, соляная кислота, гидроксид натрия;
Г. сероводородная кислота, вода, уксусная кислота.
12. С помощью реакции ионного обмена в водном растворе невозможно получить соль:
А. карбонат кальция; Б. сульфат бария;
В. сульфид алюминия; Г. фосфат серебра.
Ключ ответов: 1-Г; 2-А; 3-В; 4-В; 5-1; 6-Б; 7-В; 8-Б; 9-Б; 10-Б; 11-Г; 12-В
Тема: Неметаллы
-
Работа по группам.
-
Какие свойства проявляет аммиак в окислительно-восстановительных реакциях? Напишите соответствующие уравнения реакций.
-
Может ли аммиак осушать серной кислотой или оксидом фосфора(5)? Ответ мотивируйте.
-
На чем основано применение NH4HCO3 в хлебопечении? Напишите уравнения реакции.
-
Фильтрующая коробка противогаза, в которой находится адсорбент, имеет определенный срок действия. Объясните, почему противогаз не защищает, если он проработал дольше указанного срока?
-
Почему при некоторых пищевых отравлениях рекомендуется принимать таблетки активированного угля?
-
Где в общественном питании используется ионообменная адсорбция
-
Какие аллотропные видоизменения образует фосфор? Как различаются они по физическим свойствам
-
Какое из удобрений содержит больше питательных веществ: аммофос, нитрофоска, двойной суперфосфат?
2 группа
-
Докажите, что без химии немыслим современный быт человека.
-
Покажите, что достижения химии могут не только служить во благо, но и причинять вред. От чего зависит последний.
-
Как нужно относиться к многочисленным рекламным роликам о лекарствах, которые бесконечно передают по телевидению?
-
Какую роль играют витамины? Как их применять? Как сохранить витамины в пище?
-
Что такое СМС? Какие преимущества и недостатки имеют они по сравнению с мылами?
-
Какие чистящие и моющие средства вы используете в быту? Каковы основы их наиболее безопасного применения?
Семинарское занятие:
-
Подготовить сообщение на тему «Химия и красота» (роль химии в косметике)
-
Подготовить сообщение на тему «Химия и гигиена».
-
Подготовить групповое сообщение на тему «Химия и пища», поделив между собой части, посвященные белкам, жирам, углеводам, консервированию пищи.
-
Принести на занятия различные упаковки от пищевых продуктов и укажите, какие пищевые добавки в них использованы.
-
Напишите сочинение на тему « Химия и её роль в моей профессии»
Тематический зачет.
Тема: Химия и проблемы охраны окружающей среды.
-
Назовите основные факторы, вызывающие химическое загрязнение окружающей среды.
-
Охарактеризуйте роль атмосферы для обеспечения жизнедеятельности биосферы- живой оболочки Земли.
-
Назовите основные источники химического загрязнения атмосферы и укажите пути борьбы с ними.
-
Что такое кислотные дожди? Какую роль играют они в природе и в жизни человека? Как с ними бороться?
-
Что такое парниковый эффект? Какую роль он играет в природе и в жизни человека?
-
Назовите основные источники химического загрязнения гидросферы и пути борьбы с ними.
-
Что такое эрозия почвы? Какие виды эрозии вы знаете?
Тема: « Основные классы органических веществ»
Перечень вопросов
-
Вещества, стоящие в одном ряду и имеющие одну и ту же математическую формулу называют?
-
Какое окончание имеют радикалы предельных углеводородов?
-
Какое окончание имеют непредельные углеводороды ряда этилена?
-
Какую функциональную группу имеют одноатомные спирты?
-
Функциональная группа СОН, характеризует какой класс органических веществ?
-
К какому классу органических веществ относятся вещества, содержащие карбоксильную группу?
-
От каких углеводородов образуются названия спиртов?
-
Какое из перечисленных соединений относится к мономерам белка?
-
Какое из веществ относится к моносахаридам?
-
Амины являются, производными какого неорганического вещества?
-
Что представляет собой вторичная структура белка?
-
Какой спирт входит в состав как жидких, так и твердых жиров?
-
Вещества, имеющие одну и ту же молекулярную формулу, но разные структурные называют?
Перечень ответов
-
Изомеры 7. ЕН или ИЛЕН
-
ИЛ 8. Альдегиды
-
Глюкоза 9. Аммиак
-
Спираль 10. ОН
-
Гомологи 11. Предельных
-
Кислоты 12. Аминокислота
13. Глицерин
Ключ ответов: 1-5; 2-2; 3-7; 4-10; 5-8; 6-6; 7-11; 8-12; 9-3; 10-9; 11-4; 12-13; 13-1.
2.2 Промежуточная аттестация.
2.2.1. Теоретические задания.
Тесты в оболочке VeraItest
Вариант 1
-
Если дисперсионная среда жидкость, а дисперсная фаза твердая, то систему называют:
а) эмульсия; б) суспензия; в) взвесью.
-
Коагулирующим действием на золь, полученным по реакции
K2SiO3изб+ H2SO4 = H2SiO3+ K2SO4 будет
а) анионы электролита; б) катионы электролита;
в) анионы и катионы электролита.
3. Прибор, позволяющий наблюдать коллоидные частицы, размером не более 3 нмк в рассеянном свете, основанный на использовании эффекта Тиндаля, называется:
а) ультрамикроскопом; б) электронный микроскоп;
в) световой микроскоп.
4. Перенос частиц дисперсной фазы под действием внешнего электрического поля, называется:
а) электрофорез; б) электролиз; в) электроосмос.
5. Если дисперсная фаза и дисперсионная среда представляют собой капельки жидкости, то систему называют:
а) эмульсия; б) суспензия; в) взвесью.
6. Различная окраска дисперсных систем зависит от………… дисперсной фазы:
а) формы частиц; б) размера частиц;
в) скорости движения.
7. Некоторая минимальная концентрация электролита необходима для начала коагуляции золя называется:
а) порогом коагуляции; б) лиотропным рядом;
в) вершиной коагуляции.
8. Системы, в которых частицы дисперсной фазы слабо взаимодействуют с дисперсионной средой относятся:
а) лиофобным коллоидам; б) лиофильным коллоидам;
в) грубодисперсным системам.
9. Коагулирующее действие ионов возрастает с увеличением их заряда.
Это положение называется правилом:
а) Пакета-Фаянса; б) Пескова-Фаянса; в) Шульце- Гарди.
10. Молекулярно(ионно) дисперсные системы являются:
а) истинными растворами т.е. гомогенными системами;
б) ложными растворами; в) гетерогенными растворами.
11. Термодинамическая неустойчивость лиофобных коллоидных систем является причиной:
а) пептизации; б) автокоагуляции; в) взаимной коагуляции.
12. Дисперсные системы, в которых газ диспергирован в жидкость называются:
а) эмульсии; б) пены; в) пористые тела.
13. Системы, размер частиц дисперсной фазы в которой составляет 10 , 10 м называются:
а) пенами; б) коллоидными системами; в) грубодисперсными системами.
14. Коллоидные системы, в которых растворитель(вода) не взаимодействует с коллоидными частицами, называется:
а) гетерофильными; б) гидрофильными; в) гидрофобными.
15. Методы получения высокодисперсных систем, основанных на дроблении крупных частиц до необходимой степени дисперсности, называют:
а) диспергированием; б) гидродинамическим; в) конденсационным.
Вариант 2
1. Коллоидные системы относятся к:
а) гетерогенным; б) дисперсионным; в) гомогенным.
2. Гетерогенная система, в которой дисперсионная среда является газом, а дисперсная фаза жидкостью называется:
а) эмульсия; б) гидрозоль; в) аэрозоль.
3. Коллоидная частица( гранула), образуется согласно уравнению реакции
AgNO3 + HClизб =AgCl +HNO3 имеет заряд:
а) положительный; б) отрицательный; в) нулевой.
4. Наиболее распространенным методом очистки коллоидных систем является:
а) диализ; б) коагуляция; в) пептизация.
5. Если дисперсионная среда твердая, а дисперсная фаза газообразная, то систему называют:
а) эмульсии; б) твердые пены; в) взвесью.
6. Способность золей сохранять степень дисперсности носит название:
а) термодинамической неустойчивости;
б) агрегативной устойчивостью;
в) термодинамической устойчивостью.
7. Как влияет на степень диссоциации разбавление?
а) увеличивается; б) уменьшается; в) не влияет.
8. Концентрация ионов водорода в щелочной среде:
а) (Н )>10; б) (Н )>10; в) (Н )
9. Что значит раствор глюкозы с массовой долей 0,15?
а) в100г раствора 85г воды и 15 г глюкозы;
б) в 100г раствора 15 г глюкозы и 100г воды;
в) в 90г раствора 15г глюкозы и 90г воды.
10. Истинный раствор отличается от коллоидного:
а) концентрацией; б) плотностью;
в) размерами частиц растворенного вещества.
11. От чего зависит осмотическое давление белковых растворов?
а) от молекулярной массы белка; б) от заряда белка;
в) от числа растворенных молекул.
12. Какой из представленных растворов обладает буферными свойствами:
а) раствор глюкозы; б) раствор хлорида натрия;
в) раствор уксусной кислоты + ацетат натрия.
13. Чему равен рН 0,001М раствора соляной кислоты:
а) 1; б) 3.
14. Как заряжена коллоидная частица мицелла?
а) положительно; б) отрицательно; в) электронейтрально.
15. Для золя иодида серебра полученного взаимодействием избытка нитрата серебра и иодида калия, коагуляцию могут вызвать:
а) анионы электролита; б) катионы электролита;
в) нейтральные молекулы.
Вариант 3
-
Растворимостью вещества называется:
а) активность раствора;
б) предельная концентрация вещества, способная растворяться;
в) любая концентрация вещества.
2. Определите в какой реакции энтропия увеличивается:
а) CO2(K) CO2(Г); б) 2 NOг+ O2 Г =2NO2Г;
в) 2 H2Г + O2Г = 2H2O Ж.
3. Изотонические растворы - это растворы:
а) у которых одинаковое осмотическое давление со стандартным;
б ) у которых разная концентрация со стандартным;
в) у которых одинаковая концентрация со стандартным.
4. Основным качественным признаком коллоидно-дисперсных систем является:
а) гетерогенность; б) дисперсность; в) диффузия.
5. В чем причина броунского движения частиц дисперсной фазы:
а) кинетическое движение молекул дисперсионной среды на частицы дисперсионной фазы;
б) седиментация; в) коагуляция частиц дисперсной фазы.
6. К какому типу дисперсных систем относятся эмульсии:
а) ж/ж; б) т/ж; в) ж/т.
7. Почему белки относятся к полиэлектролитам:
а) гидрофобность молекул;
б) наличие групп, способных к ионизации;
в) способность к набуханию.
8. В водном растворе вещество, поверхностное натяжение которого меньше, чем у воды, преимущественно находится:
а) у стенок сосуда; б) на дне сосуда;
в) в поверхностном слое.
9. Какое из приведенных веществ является дисперсной системой:
а) раствор сахара; б) молоко; в) вода.
10. Коллоидная частица, образующаяся согласно уравнению реакции:
K2SiO3 + H2SO4изб =H2SiO3 +K2SO4 имеет заряд:
а) нулевой; б) высокий отрицательный; в) положительный.
11. Какой заряд имеет белок в изоэлектрической точке?
а) положительный; б) отрицательный;
в) электрически нейтральный.
12. Если дисперсионная среда жидкость, а дисперсная фаза твердая, то систему называют:
а) взвесью; б) эмульсией; в) суспензия.
13. Перенос частиц дисперсной фазы под действием внешнего электрического поля называют:
а) электрофорез; б) электролиз; в) электроосмос.
14. Как влияет на степень диссоциации разбавление раствора?
а) не влияет; б) уменьшается; в) увеличивается.
15. Какой из представленных растворов обладает буферными свойствами?
а) раствор уксусной кислоты+ ацетат натрия;
б) раствор хлорида калия; в) раствор глюкозы.
Вариант 4
-
Какой закон выражает зависимость скорости реакции от концентрации реагирующих веществ:
а) закон Вант-Гоффа; б) закон постоянства состава;
в) закон действующих масс.
2. Как влияет повышение температура на скорость экзотермической реакции?
а) повышает; б) понижает; в) не влияет.
3. К какому каталитическому процессу следует отнести реакцию
2 H2O2 = 2H2O + O2:
а) гомогенный; б) гетерогенный; в) ингибированный.
4.В какую сторону сместится равновесие при повышении давления в системе
H2 +CI2= 2 HCI:
а) вправо; б) влево; в) не сместится.
5. Как следует изменить концентрацию СО, чтобы сместить равновесие вправо:
2СО + О2 = 2СО2
а) увеличить; б) уменьшить; в) не изменять.
6. Какой электролит при диссоциации образует только ОН ионы:
а) Н2О; б)Zn(OH)2; в) NaOH.
7. При диссоциации какой молекулы образуется наибольшее число ионов:
а) KCI; б ) K2SO4 ; в ) AI2(SO4)3.
8. Диссоциация по трем ступеням возможна в растворе:
а) ортофосфорной кислоты; б) хлорида алюминия;
в) ортофосфата калия.
9. Скорость химической реакции между медью и азотной кислотой зависит от
а) массы меди; б) концентрации кислоты;
в) объёма кислоты.
10. Ионы иода образуются при диссоциации:
а) KIO3; б)KI; в) NaIO4.
11. Для увеличения скорости взаимодействия железа с кислородом следует:
а) измельчить железо; б) уменьшить давление кислорода;
в) уменьшить температуру.
12. Слабым электролитом является:
а) HCOOK; б) HCOOH; в) (HCOO)2Ca.
13. Скорость реакции цинка с раствором серной кислоты не зависит от:
а) температуры; б) числа взятых гранул цинка;
в) степени измельчения цинка.
14. С помощью реакции ионного обмена в водном растворе не возможно получить соль:
а) фосфат магния; б) карбонат кальция; в) нитрат олова.
15. При обычных условиях с наибольшей скоростью протекает реакция между:
а) Fe и O2; б ) Na и O2; в )Na2SO4р-р и BaCI2р-р.
Вариант 5
-
С наибольшей скоростью соляная кислота реагирует с:
а) железными стружками; б)свинцовыми опилками;
в) порошком мела.
2. Для смещения равновесия в сторону продуктов реакции в системе
N2 г + 3H2 г= 2NH3 г + G
Необходимо:
а) увеличить температуру; б) уменьшить давление;
в) уменьшить температуру.
3. Ортофосфорная кислота:
а) относится к слабым электролитам;
б) легко разлагается при хранении;
в) не взаимодействует с щелочными металлами.
4. Для увеличения скорости взаимодействия цинка с хлором следует:
а) уменьшить давление хлора; б) уменьшить температуру;
в) измельчить цинк.
5. К экзотермическим реакциям относится
а) гидролиз сульфата меди; б) разложение карбоната кальция;
в) взаимодействие азота и кислорода.
6. Для уменьшения скорости взаимодействия алюминия с хлором следует:
а) измельчить алюминий; б) добавить катализатор;
в) уменьшить температуру.
7. К какому из приведенных типов реакций можно отнести реакцию обмена:
а) разложения; б) замещения; в) нейтрализации.
8. Для уменьшения скорости химической реакции необходимо:
а) понизить температуру; б) повысить температуру;
в) ввести в систему катализатор.
9. Вещество, при диссоциации которого образуются катионы натрия, водорода, а также анионы SO4 является:
а) кислотой; б) кислой солью; в) щелочью.
10. Наиболее слабым электролитом является:
а) HCI; б) HI; в)HF.
11. Осадок выпадает при взаимодействии растворов:
а) FeCI3 и Ba(OH)2; б) H3PO4 и KOH; в) Na2SO4 и HCI.
12. В промышленности повышение выхода аммиака обеспечивается:
а) действием высоких температур; б) использованием катализаторов;
в) циркуляцией азотно-водородной смеси.
13. С наибольшей скоростью при комнатной температуре протекает реакция:
а) углерода с кислородом;
б) растворов гидроксида натрия и серной кислоты;
в) железа с соляной кислотой.
14. В качестве анионов только ионы ОН образуются при диссоциации
а) NaOH; б) CH3OH; в)CH3COOH.
15. Нерастворимая соль образуется при сливании водных растворов:
а) гидроксида калия и хлорида алюминия;
б) сульфата меди(2) и сульфида калия;
в) серной кислоты и гидроксида лития.
Ответы:
| Варианты ответов | |||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 1 | б | а | б | а | а | б | а | а | б | в | б | б | в | в | а |
| 2 | б | в | б | а | б | б | а | в | а | в | в | в | б | в | а |
| 3 | б | а | а | а | а | а | б | в | б | б | в | в | а | в | а |
| 4 | в | б | б | в | а | в | в | а | б | б | а | в | а | в | в |
| 5 | в | б | а | в | б | а | в | а | б | в | а | в | б | а | б |
Тесты в оболочке VeraItest
Вариант 1
-
Какой элемент должен обязательно содержаться в оксидах:
а) металл; б) неметалл; в) кислород; г) воздух.
-
Сколько веществ представлено следующими формулами:
Н Cl H Cl
H – C – Cl H – C – H Cl – C – H H – C – H
H H H Cl
а) одно; б) два; в) три; г) четыре.
-
Органическим является вещество, формула которого:
а) С2Н2; б) СО; в) Н2СО3; г) CuCO3.
-
Бромную воду обесцвечивает:
а) пропан; б) этан; в) циклобутан; г) ацетилен.
-
Укажите «лишнее» понятие:
а) ректификация; б) коксование;
в) термический крекинг; г) каталитический крекинг.
-
В воде растворяются оба вещества пары:
а) этанол и бензол; б) метанол и этанол;
в) фенол и этан; г) метан и аммиак.
-
Этанол взаимодействует:
а) с кислородом; б) калием;
в) водородом; г) бромводородом.
-
Общая формула альдегидов:
О
а) R – С
ОH
О
б) R – С
R
в) R – OH
О
г) R – С
H
+Х О
-
В схеме реакции С2Н5ОН СН3 – С
Н
вещество Х имеет формулу:
а) CuO; б) H2;
в) Cu (OH)2; г) NaOH.
-
Реакцией этерификации называется взаимодействие кислот с:
а) щелочью; б) спиртом;
в) галогеноми; г) металлами.
-
Углеводом не является вещество, формула которого:
а) (С6Н10О5)n; б) С6Н12О2;
в) С12Н22О11; г) С6Н12О6.
-
При нагревании раствора глюкозы с аммиачным раствором оксида серебра образуется:
а) ярко-синий раствор;
б) газ;
в) красный осадок;
г) серебряный налет на стенках пробирки.
-
Амины – это производные:
а) кислот; б) солей;
в) аммиака; г) аминокислот.
-
Аминокислотой является вещество, формула которого:
О
а) С2H5 – С
NH2
О
б) NH2 – С2Н4 – С
ОН
О
в) NH2 – СН2
ОН
О
г) NH2 – С
ОН
-
Полимерную природу имеют:
а) жиры; б) воски; в) белки; г) аминокислоты.
Вариант 2
-
Массовая доля (%) меди в оксиде меди (II) равна:
а) 40 %; б) 80 %; в) 10 %; г) 60 %.
-
Органическим является вещество, формула которого:
а) СО2; б) Н2СО3; в) С3Н8; г) СаСО3.
-
Молекулярная формула гептана:
а) С6Н14; б) С7Н16; в) С7Н14; г) С6Н12.
-
По составу к ароматическим углеводородам относится вещество, формула которого:
а) С7Н14; б) С5Н10; в) С6Н6; г) С6Н12.
-
В составе нефти наибольшую долю имеют:
а) арены; б) циклоалканы;
в) другие соединения; г) алканы.
-
Предельные одноатомные спирты не вступают в реакцию:
а) замещения; б) окисления;
в) дегидратации; г) присоединения.
-
Глицерин в отличие от этанола:
а) имеет запах; б) сиропообразная жидкость;
в) не растворим в воде; г) без цвета.
-
Альдегидом является вещество, формула которого:
О
а) СH3 – С
СН3
О
б) СH3 – С
С2Н5
О
в) H – С
Н
г) СH3 – СН2 – ОН
-
Общая формула одноосновных карбоновых кислот:
О
а) R – С
ОН
О
б) R1 – С
О – R 2
О
в) R1 – С
О – R 3
О
г) R – С
Н
-
Формула сложного эфира:
а) СH3 – О – С2Н5
О
б) С2H5 – С
ОН
О
в) H – С
О – СН3
О
г) СH3 – С
С2H5
-
К дисахаридам относится:
а) сахароза; б) крахмал;
в) фруктоза; г) рибоза.
-
При гидролизе сахарозы образуются:
а) фруктоза и рибоза; б) фруктоза и глюкоза;
в) глюкоза; г) фруктоза.
-
Метиламин образует соль при взаимодействии с веществом, формула которого:
а) Н2О; б) NaOH; в) C2H5NO2; г) HCl.
-
Аминокислоты проявляют свойства:
а) амфотерные; б) только кислот;
в) только оснований; г) свойства не изучены.
-
В основе усвоения белков в желудочно-кишечном тракте лежит реакция:
а) окисления; б) этерификации;
в) денатурации; г) гидролиза.
Вариант 3
-
Какой из оксидов является кислотами:
а) К2О; б) FeO; в) NO2; г) CrO3.
-
Элемент, атомы которого способны соединяться в длинные цепи:
а) кислород; б) азот; в) хлор; г) углерод.
-
Атомы углерода могут соединяться друг с другом связями:
а) одинарными; б) двойными;
в) тройными; г) все ответы верны.
-
Не обесцвечивает бромную воду:
а) бензол; б) этин; в) бутен; г) этен.
-
Нефть – это смесь:
а) глины с песком; б) спирта с водой;
в) углеводородов; г) неорганических веществ.
-
При дегидратации метанола можно получить:
а) метан; б) диметиловый спирт; в) этан; г) этен.
-
Глицерин взаимодействует:
а) с натрием; б) бромводородом;
в) гидрооксидом меди (II); г) все ответы верны.
-
Двойная связь между атомами углерода и кислорода содержится в молекуле:
а) этаналя; б) этилена; в) этанола; г) ацетилена.
-
К карбоновым кислотам относится вещество, формула которого:
О
а) H – С
Н
О
б) СH3 – С
ОН
О
в) H – С
СН3
О
г) СH3 – С
О – СH3
-
Сложные эфиры получают взаимодействием карбоных кислот с:
а) щелочами; б) оксидами металлов; в) спиртами; г) солями.
-
Гидролизу не подвергаются:
а) глюкоза; б) лактоза; в) целлюлоза; г) крахмал.
-
Глюкоза в отличие от сахарозы:
а) не растворяется в воде; б) имеет свойства многоатомных спиртов;
в) имеет свойства альдегидов; г) является природным углеводом.
-
Метиламин имеет формулу:
а) СН3NН2; б) (СН3)2NH; в) С2Н5NH2; г) С6Н5NH2.
-
Аминокислоты являются амфотерными соединениями, так как они взаимодействуют с:
а) кислотами; б) щелочами;
в) спиртами; г) кислотами и щелочами.
-
Гидролиз белков используют для:
а) снижения растворимости белков в воде;
б) для получения - аминокислот;
в) качественного обнаружения белков;
г) получения любых аминокислот.
Вариант 4
-
Найдите строку, в которой перечислены только элементы:
а) оксид меди, азот, вода; б) кислород, водород, хлор, железо;
в) алмаз, озон, графит, сероуглерод; г) аммиак, хлороформ, вода, водород.
-
Структурная формула гексана:
а) СН3 – СН – СН2 – СН2 – СН3
СН3
б) СН3 – СН2 – СН2 –СН3
СН3
в) СН3 – С – СН3
СН3
г) СН3 – СН2 – СН – СН2 – СН2 – СН3
СН3
-
Изомер СН3 – СН – СН – СН3 имеет название:
СН3 СН3
а) гексан; б) 2,3 диметилгексан; в) 2,3 диметилбутан; г) 2 метилбутан.
-
Горит коптящим пламенем:
а) метан; б) бензол; в) спирт; г) этилен.
-
Общая формула предельных одноатомных спиртов:
а) CnH2n -1OH; б) CnH2n OH; в) CnH2n +1OH; г) CnH2n +2OH.
-
Предельные одноатомные спирты не взаимодействуют:
а) с кислородом; б) щелочами;
в) галогеноводородами; г) оксидом меди (II) .
-
Этилен окисляется раствором перманганата калия с образованием:
а) этана; б) этанола; в) этиленгликоля; г) ацетилена.
-
При окислении альдегидов образуются:
а) фенолы; б) карбоновые кислоты;
в) спирты; г) кетоны.
-
Общая формула предельных одноосновных кислот:
а) CnH2n O; б) CnH2n +2O; в) CnH2n +1O2; г) CnH2n O2.
-
Реакция взаимодействия сложных эфиров с водой называется:
а) омылением; б) гидролизом;
в) гидратацией; г) этерификацией.
-
Гидролизу подвергается:
а) глюкоза; б) рибоза; в) целлюлоза; г) фруктоза.
-
В природе крахмал образуется в процессе:
а) фотосинтеза; б) брожения;
в) гидролиза; г) полимеризации.
-
К аминам не относится вещество, формула которого:
а) CH3NH2; б) C2H5NO2; в) C6H5NH2; г) (C2H5)2NH.
-
Для получения аминоуксусной кислоты из уксусной потребуются:
а) хлор и метиламин; б) хлорводород и аммиак;
в) хлор и аммиак; г) гидроксид натрия и хлорид амония.
-
В полимерной цепи белков соседние остатки аминокислот связаны друг с другом связью:
а) водородной; б) ионной; в) пептидной; г) дисульфидной.
Вариант 5
-
Какой из оксидов является только основным:
а) NO2; б) SO3; в) P2O5; г) CuO.
-
При сгорании 5 л метана выделяется углекислый газ объемом:
а) 10 л; б) 5 л; в) 2,5 л; г) 4л.
I II
-
Для осуществления превращений I и II С СН4 СН3Сl потребуются вещества, формулы которых:
а) Н2О, Cl2; б) О2, НCl; в) О2, Cl2; г) Н2, Cl2.
-
Шесть атомов углерода в бензольном кольце соединены:
а) одноатомными σ связями;
б) единой связью;
в) чередующимися одинарными и двойными связями;
г) r связями и связью.
-
Укажите формулу предельного одноатомного спирта:
а) СН3ОН; б) НО – СН2 – СН2 – ОН;
в) НСОН; г) С6Н5ОН.
-
Метанол может взаимодействовать:
а) с гидроксидом натрия; б) оксидом натрия;
в) хлоридом натрия; г) натрием.
-
Фенол в отличие от этанола:
а) кристаллическое вещество; б) имеет запах гуаши;
в) ароматические соединения; г) все ответы верны.
-
Альдегидом не является вещество, формула которого:
О
а) СH3 – С
H
О
б) СH3 – СН – С
H
СН3
в) СН3 – СН2 – СН2ОН
О
г) H – С
H
-
Плохо растворима в воде кислота:
а) муравьиная; б) азотная; в) масляная; г) уксусная.
-
В состав природных жиров не входит кислота:
а) щавелевая; б) стеариновая; в) масляная; г) олеиновая.
-
Углеводом не является вещество:
а) фруктоза; б) рибоза; в) мальтоза; г) мимоза.
-
Сахароза в отличие от глюкозы:
а) растворяется в воде; б) имеет свойство многоатомного спирта;
в) не дает реакции «серебряного зеркала»;
г) является кристаллическим веществом.
-
К аминам относится вещество, формула которого:
а) C2H5NO2; б) C2H5NH2; в) NH4NO3; г) NH3.
-
Формула аминоуксусной кислоты:
а) NH2СН2СООН; б) NH2С2Н4СООН;
в) NH2СН2ОН; г) NH2СН2 СН2NН2.
-
Аминокислоты, необходимые для построения белков, попадают в организм человека с:
а) пищей; б) водой; в) воздухом; г) все ответы верны.
Ответы:
| Варианты ответов | |||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| 1 | в | б | а | г | б | б | в | г | а | б | б | г | в | а | в |
| 2 | б | в | в | в | г | а | б | в | а | г | а | в | г | а | г |
| 3 | в | г | г | а | в | б | г | а | б | в | а | г | а | г | г |
| 4 | б | а | в | б | в | б | в | в | г | б | в | а | б | в | в |
| 5 | г | б | г | в | г | г | г | в | в | а | г | в | б | а | а |
2.2.2 Практические задания
Задания для оценки освоения умений
ПРАКТИЧЕСКОЕ ЗАДАНИЕ (ПЗ) №1
Решение задач на расчет энтальпий химических реакций
Задача №1
Стандартные энтальпии образования жидкой и газообразной воды при 298К равны -285, -241,8 кДж/ моль соответственно Рассчитайте энтальпию испарения воды при этой температуре.
Решение:
Энтальпии образования соответствуют следующим реакциям:
H2г +SO2 г = H2Oж ( H1=-285, 8)
H2г + SO2г = H2O г ( H2 =- 241, 8)
Вторую реакцию можно провести в две стадии: сначала сжечь Н с образованием жидкой воды по первой реакции, а затем испарить воду:
Н2Ож= Н2Ог Н исп =?
Тогда по закону Гесса,
Н1 + Нисп= Н2
Откуда: Нисп= -241,8-(-285,)=44кДж
Ответ: 44 кДж
Задача №2
На основании термохимического уравнения горения этилена (С2Н4):
С2Н4г + 3О2г =2 СО2 г+2Н2О ж+1400кДж
вычислите массу и объём (н.у.) сгоревшего этилена, если в ходе реакции выделилось 2450кдж теплоты.
Решение:
Согласно уравнению реакции при сгорании 1 моль этилена выделяется 1400кДж теплоты. По условию задачи выделилось 2450кДж теплоты. Составим пропорцию:
1моль этилена----1400кДж
х моль этилена-----2450кДж
1 = 1400
Х =2450
Решаем уравнение:
1400х=2450
Откуда х=1,75(моль)
Теперь вычислим массу и объём (н.у.) этилена:
m(С2Н4)= 28г/моль х1, 75 моль=49г.
V(С2Н4)=22,4л/моль х 1,75 моль=39,2л(н.у.)
Ответ: Масса этилена 49г
Объём этилена 39,2л
ПРАКТИЧЕСКОЕ ЗАДАНИЕ (ПЗ) №2
Химическое равновесие. Смещение равновесия
Задание № 1
В какую сторону сместится равновесие при повышении давлении в системе.
H2г + CI2г = 2HCIг
Решение:
Реакция идет без изменения объёма системы (2 объёма в левой и 2 объёма в правой части уравнения), изменение давления не вызовет смещение химического равновесия, так как будет одинаково влиять на скорость прямого и обратного процессов. Равновесие не сместится
Ответ: Равновесие не сместится
Задание №2
В какую сторону сместится равновесие реакции
2SO2 + O2 = 2SO3 H=-192кДж
при повышении температуры.
Решение:
Повышение температуры согласно принципу Леш ателье смещает равновесие в сторону эндотермической реакции. В приведенном примере эндотермической является обратная реакция, следовательно, равновесие сместится влево
Ответ: равновесие сместится влево
Задание №3
Как следует изменить концентрацию СО, чтобы сместить равновесие вправо: 19
2 СО + О2 =2 СО2
Решение:
Увеличение скорости прямой реакции (смещение равновесия вправо) можно достичь повышением концентрации СО.
Ответ: Повысить концентрацию СО
ПРАКТИЧЕСКОЕ ЗАДАНИЕ (ПЗ) №3
Скорость химических реакций
Факторы, влияющие на скорость реакций
Задача 1.
Во сколька раз возрастёт скорость реакции при повышении температуры на 30°? Температурный коэффициент равен 3.
Решение.
По правилу Вант-Гоффа
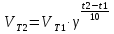
По условию задачи требуется определить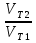 . Подставляем данные в формулу и решаем
. Подставляем данные в формулу и решаем
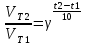 =
=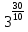 = 33 = 27
= 33 = 27
Задача 2.
На сколько градусов следует повысить температуру, чтобы скорость реакции возросла в 2 раза (=2)?
Решение.
Подставляем в формулу отражающую правило Вант-Гоффа данные задачи и решаем
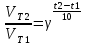 ; 8=
; 8=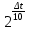 ;
; 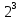 =
=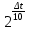 ;
; 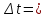 30°.
30°.
Задача 3.
Как измениться скорость реакции: 3H2+N2=2NH3, если концентрацию водорода увеличить в 3 раза?
Решение.
После увеличения концентрации водорода в 3 раза
V2= k(3[H2])3[N2] = 27k[H2]3[N2]
Следовательно скорость реакции возрастёт в
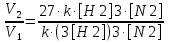 =27раз
=27раз
Ответ: в 27 раз
2.3 Пакет экзаменатора
| Задания теоретические проводятся в форме тестового контроля знаний в оболочке VeraItest в центре тестирования. Задания практические проводятся в форме решения химических задач в кабинете | ||
| Объекты оценки | Критерии оценки результата (в соответствии с разделом 1 «Паспорт комплекта контрольно-оценочных средств) | Отметка о выполнении |
| У.1: уметь объяснять роль химии в формировании научного мировоззрения У.2. уметь назвать изученные вещества по тривиальной и международной номенклатуре У.3 уметь определять валентность, степень окисления, тип химической связи в соединениях, заряд иона, окислитель и восстановитель, принадлежность веществ к различным классам органических и неорганических веществ У.4 уметь объяснить строение Периодической системы, общие свойства металлов и неметаллов в зависимости от положения в Периодической системе У.5. уметь объяснять зависимость свойств веществ от их строения и состава, природы химической связи, зависимость и скорость химических реакций, химическое равновесие У.6.уметь выполнять химический эксперимент, проводить самостоятельный поиск информации с использованием различных источников У.7. уметь связывать изученный материал с профессиональной деятельностью У.8. уметь решать задачи по химическим формулам и уравнениям | Дано объяснение роли химии в формировании научного мировоззрения в полном объёме Названия веществам по тривиальной и международной номенклатуре даются верно Валентность, степень окисления, заряд иона, основные классы органических и неорганических веществ освоены в полном объеме Строение Периодической систему, свойства металлов и неметаллов, а также их соединений изучены в полном объёме Свойства веществ их строение и состав, скорость химических реакций, химическое равновесие изучено в полном объеме Перечислены источники информации о химических объектах( учебники, справочники, научно-популярные издания, компьютерные базы, ресурсы Интернета) Названы области практического применения химических знаний Проводят расчеты по химическим формулам и уравнениям реакции правильно | |
| З-1 Знать и понимать основные химические понятия З-2.Знать основные законы химии З-3. Знать важнейшие вещества и материалы ,используемые в химической промышленности и повседневной жизни З-4. Знать объяснения химическим явлениям, происходящим в природе, быту, на производстве. Течение химических превращений в различных условиях и оценка их последствий З-5: Знать влияние химического загрязнения окружающей среды на организм человека и другие живые организмы, также безопасность обращения с горючими и токсичными веществами и лабораторным оборудованием З-6: знать теоретические основы органической химии; З-7: знать понятие химической кинетики и катализа; З-8: знать классификацию химических реакций и закономерности их протекания; З-9: знать обратимые и необратимые химические реакции, химическое равновесие, смещение химического равновесия под действием различных факторов; З-10: знать гидролиз солей, диссоциацию электролитов в водных растворах, понятие о сильных и слабых электролитах; З-11: знать характеристики различных классов органических веществ | Даны определения основных химических понятий Даны определения основных законов химии Даны основные вещества и материалы, сплавы, которые используются в промышленности и в повседневной жизни человека. Химические процессы, протекающие в природе, быту, на производстве описаны полностью; воспроизведены все этапы химических процессов Даны определения сущности химической науки для окружающей среды, живых организмов, а также безопасность обращения с горючими и токсичными веществами и лабораторным оборудованием Химические процессы описаны полностью Химические процессы описаны полностью Дано определение сущности химической науки для решения задач, возникающих в теории и практики Химические процессы описаны полностью; воспроизведены все этапы химических процессов Химические процессы описаны полностью Химические процессы описаны полностью | |
Условия выполнения задания
-
Место(время) выполнения задания: Кабинет № 7 естественно-научных дисциплин
2. Требования охраны труда: инструктаж по технике безопасности.
3. Оборудование: индивидуальное рабочее место, оборудованное компьютером
4. Можно использовать литературу:
1) О.С.Габриелян Химия 10 кл. Москва Дрофа 2009г.
2) О.С. Габриелян Химия 11кл. Москва Дрофа 2008г.
3) О.С. Габриелян Химия:учеб.для студ. сред. проф. учеб. заведений, Москва «Академия» 2009г.
Здесь представлены материалы теста на тему «Механизация сельского хозяйства», которые могут быть просмотрены в онлайн режиме или же их можно бесплатно скачать. Предмет теста: Химия (все классы). Также здесь Вы найдете подборку тестов на схожие темы, что поможет в еще лучшей подготовке к тестированию.
