Тест «Обзор неметаллов» по химии для 11 класса
Тестовое задание по химии на тему «Обзор неметаллов» (11 класс)
ФИО: Тимохина Алёна Владимировна
Должность: учитель биологии, химии
Место работы: МОБУ «Рассветская СОШ» им. В. В. Лапина
Цель - повторить физические и химические свойства неметаллов.
Задачи:
1. Образовательные – изучить свойства и получение неметаллов;
2. Воспитательные – роль неметаллов в природе;
3. Развивающие – сравнить свойства неметаллов.
Тестовое задание
-
Химический элемент, который имеет следующие изотопы: протий, дейтерий, тритий.
-
Кислород
-
Сера
-
Водород
-
Фосфор
-
В окислительно – восстановительных реакция Водород является.
-
Сильный окислитель
-
Нейтральный
-
Окислитель, восстановитель
-
Сильный восстановитель
-
Степень окисления Водорода с соединениями металлов.
-
+1
-
– 1
-
– 2
-
+2
-
Продолжите предложение: «При поджигании смеси 2 объемов водорода с 1 объемом кислорода соединение газов происходит мгновенно и сопровождается сильным взрывом» Назовите такую смесь?
-
Напишите уравнения реакций, следуя цепочке.
2H2H2OH2H2O
-
Назовите химический элемент, соответствующий следующему высказыванию: «Типичный неметалл, для которого не характерны восстановительные свойства».
-
Кислород
-
Хлор
-
Фтор
-
Сера
-
Выберите общие свойства, характерные для галогенов?
-
В основном имеют степень окисления – 1
-
Взаимодействуют с простыми веществами
-
Все проявляют и окислительные и восстановительные свойства
-
К галогенам относятся – F2, Cl2, I2,Br2,At
-
Назовите химический элемент, имеющий следующие физические свойства: бесцветный газ, не имеющий запаха, тяжелее воздуха.
-
Кислород
-
Водород
-
Азот
-
Углерод
-
Напишите уравнение реакции, которое используется для получения Кислорода в лаборатории.
-
Выберите физическое свойство, которое не соответствует Сере.
-
Хрупкие кристаллы желтого цвета
-
Растворим в воде
-
Имеет аллотропные модификации: ромбическая, пластическая
-
Растворяется хорошо в сероуглероде, бензоле
-
Химический элемент, который имеет следующие аллотропные модификации: алмаз, графит, уголь.
-
Сера
-
Углерод
-
Фосфор
-
Селен
-
Соотнесите полуреакции ионов и уравнения реакций в Окислительно – восстановительном процессе.
| 1 |
| |
| Б) S0 - 4e = S+4 | 2 |
|
| В) N+5 +1e = N+4 | 3 |
|
| Г) N+4 - 1e = N+5 | 4 |
|
-
Допишите уравнения реакций (к окислительно - восстановительным реакциям написать ОВ баланс).
-
Решите задачу: Из перманганата калия 7, 9 г был получен кислород, который прореагировал с магнием. Какая масса оксида магния будет при этом получена?
-
Решите задачу: При взаимодействии 14, 2 г хлора с 1 г водорода получен хлороводород HCl. Определите: а) массу полученного хлороводорода; б) какой газ останется в избытке и массу этого избытка.
Ответы на тестовые задания
1. в
2. г
3. б
4. Гремучий газ
5. 2H2 + O2 = 2H2O
2H2O + CaH2 = 2H2 + Ca (OH) 2
H2 + CuO = H2O + Cu
6. в
7. абг
8. а
9. ![]()
10. б
11. б
12. А – 1,4; Б – 1; В – 2; Г – 3.
13. а) ![]()
б) ![]()
в) ![]()
г) ![]()
д) ![]()
е) ![]()
ж) ![]()
14. Из перманганата калия 7, 9 г был получен кислород, который прореагировал с магнием. Какая масса оксида магния будет при этом получена?
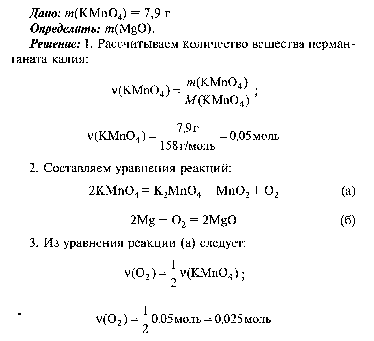
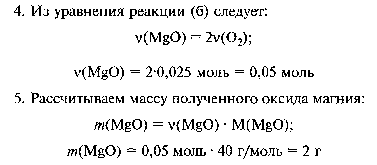
15. При взаимодействии 14, 2 г хлора с 1 г водорода получен хлороводород HCl. Определите: а) массу полученного хлороводорода; б) какой газ останется в избытке и массу этого избытка.

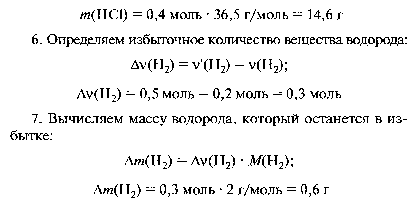
Список литературы
-
Рудзитис Г. Е. Химия. Основы общей химии. 11 класс : учеб. для общеобразоват. учреждений / Г. Е. Рудзитис, Ф. Г. Фельдман. – 14 –е изд. – М.: Просвещение, 2011. – 159 с.
-
Лидии Р.А. Химические свойства неорганических веществ: Учеб. пособие для вузов. 3-е изд., испр./Р.А. Лидин, В.А. Молочко, Л.Л. Андреева; Под ред. Р.А. Лидина. - М.: Химия, 2000. 480 с:
-
Н. Л. Глинка. Общая химия
-
Хомченко И. Г. Сборник задач и упражнений по химии для средней школы. – 2 – е изд., испр. и доп. – М.: РИА «Новая волна»: Издатель Умеренков, 2011. – 214 с.
Здесь представлены материалы теста на тему «Обзор неметаллов», которые могут быть просмотрены в онлайн режиме или же их можно бесплатно скачать. Предмет теста: Химия (11 класс). Также здесь Вы найдете подборку тестов на схожие темы, что поможет в еще лучшей подготовке к тестированию.
