Слайд 1Состояние электронов в атомах
Почему электрон не падает на ядро?
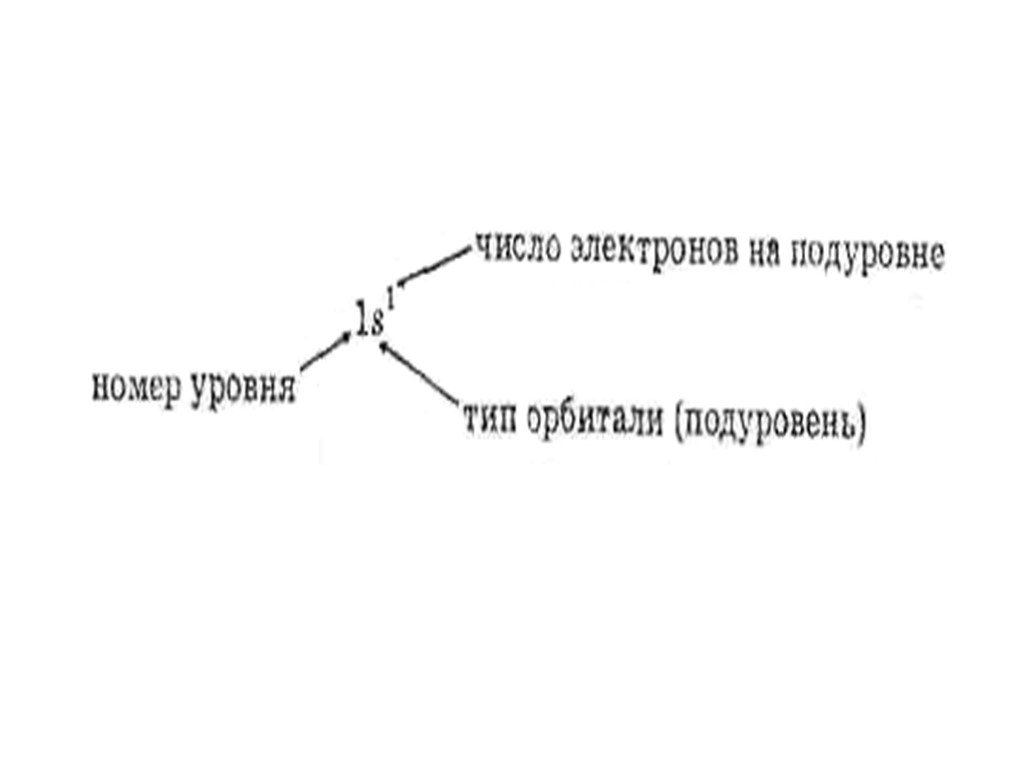
Квантовая теория подразумевает, что энергия электрона может принимать только определенные значения, т.е. квантуется. Энергия электрона, форма электронного облака и другие параметры описывают состояние электрона в атоме. Состояние электрона характеризуется совокупностью чисел, называемых квантовыми числами. Главное квантовое число n служит для отнесения состояния электрона к тому или иному энергетическому уровню, под которым понимается набор орбиталей с близкими значениями энергии. Главное квантовое число может принимать любое значение из области натуральных чисел, т.е.n=1, 2, 3.
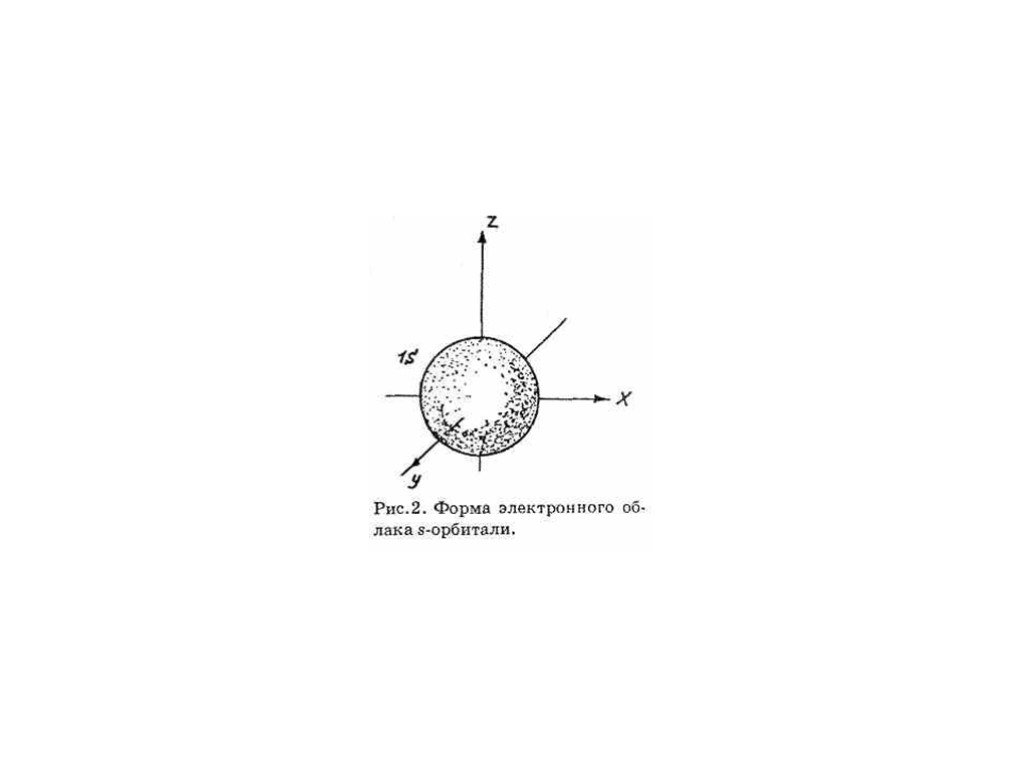
ОРБИТАЛИ - место расположения электрона в атоме.

Слайд 2Орбитальное квантовое число
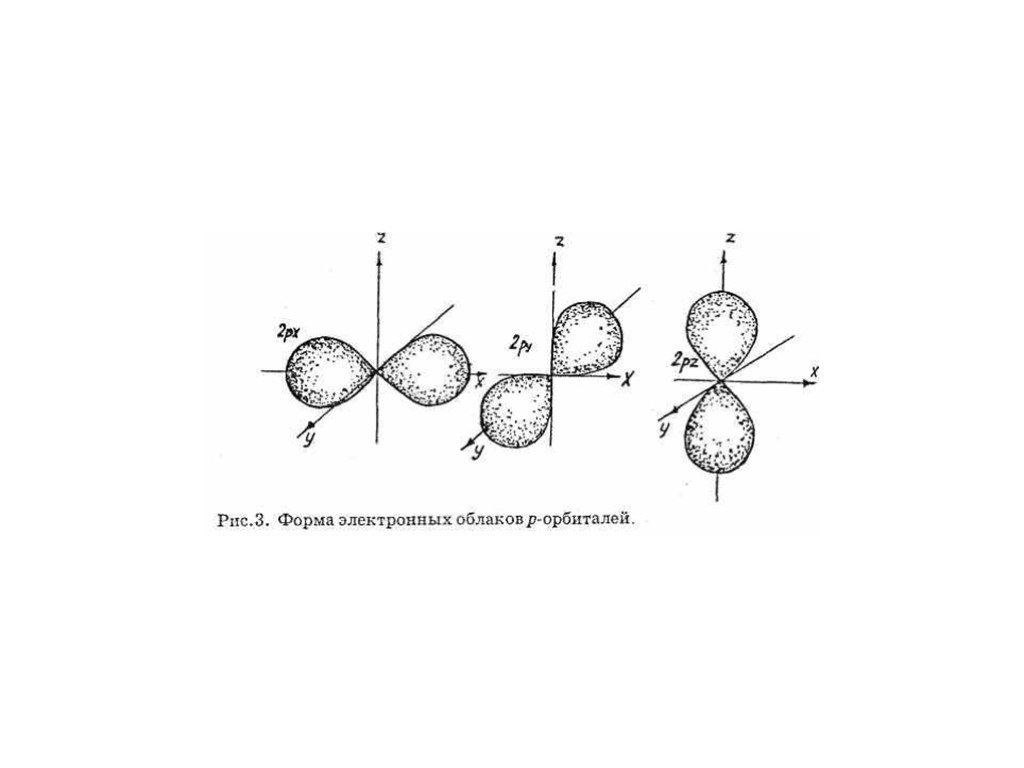
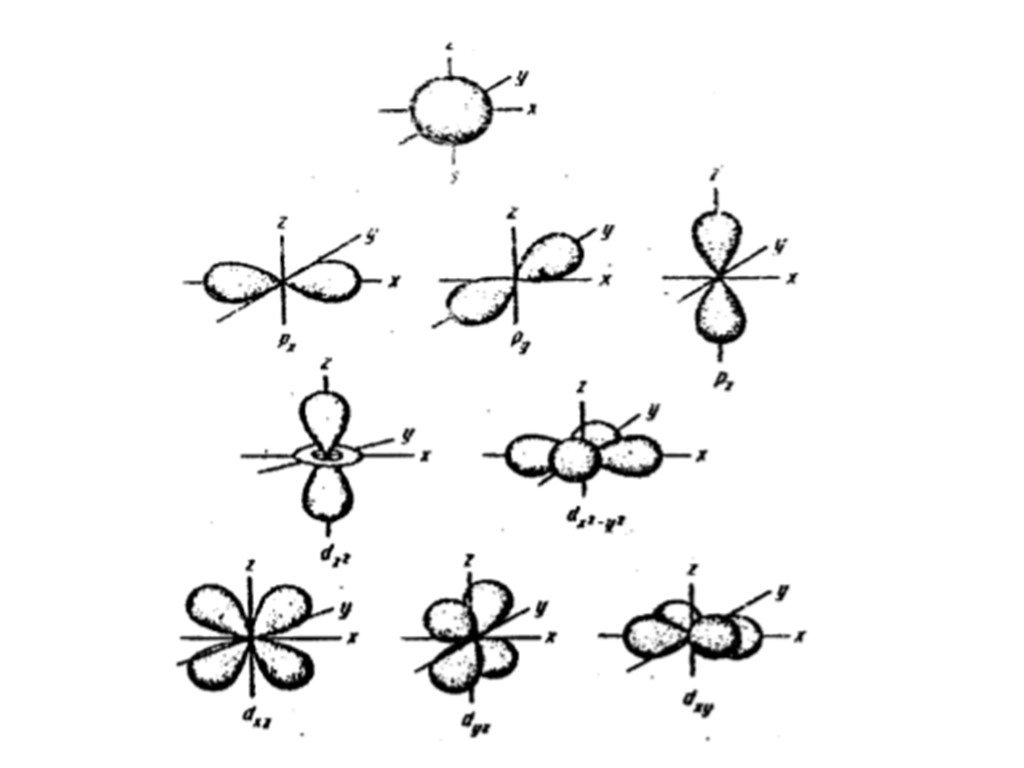
Энергетический уровень включает в себя несколько орбиталей. Орбитали с одинаковой энергией, принадлежащие одному энергетическому уровню, образуют энергетический подуровень. Отнесение орбитали к какому-либо подуровню производится при помощи побочного (орбитального) квантового числа l. Орбитальное квантовое число показывает, какому подуровню данного энергетического уровня соответствует характер движения рассматриваемого электрона. Очень часто состояния электрона обозначают латинскими буквами, при этом состояние с l=0 называют s-орбиталью, l=1 — р-орбиталью, l=2 — d-орбиталью l=3 — f-орбиталью, l=4 — g-орбиталью и т.д. Электронные облака орбиталей с разными значениями l имеют разную конфигурацию, а с одинаковыми l похожую.

Слайд 6Магнитное квантовое число
Для того, чтобы различать электроны, занимающие одинаковые по энергии орбитали, введено магнитное квантовое число ml. Его квантово-механический смысл в том, что ml выражает проекцию орбитального момента импульса на направление магнитного поля. Именно магнитное квантовое число отражает пространственную ориентацию орбиталей с одинаковым числом l.
Слайд 7Спиновое квантовое число
Спин электрона есть собственный момент количества движения. Хотя интерпретация этого свойства сложна, его можно уподобить вращению электрона вокруг своей воображаемой оси.
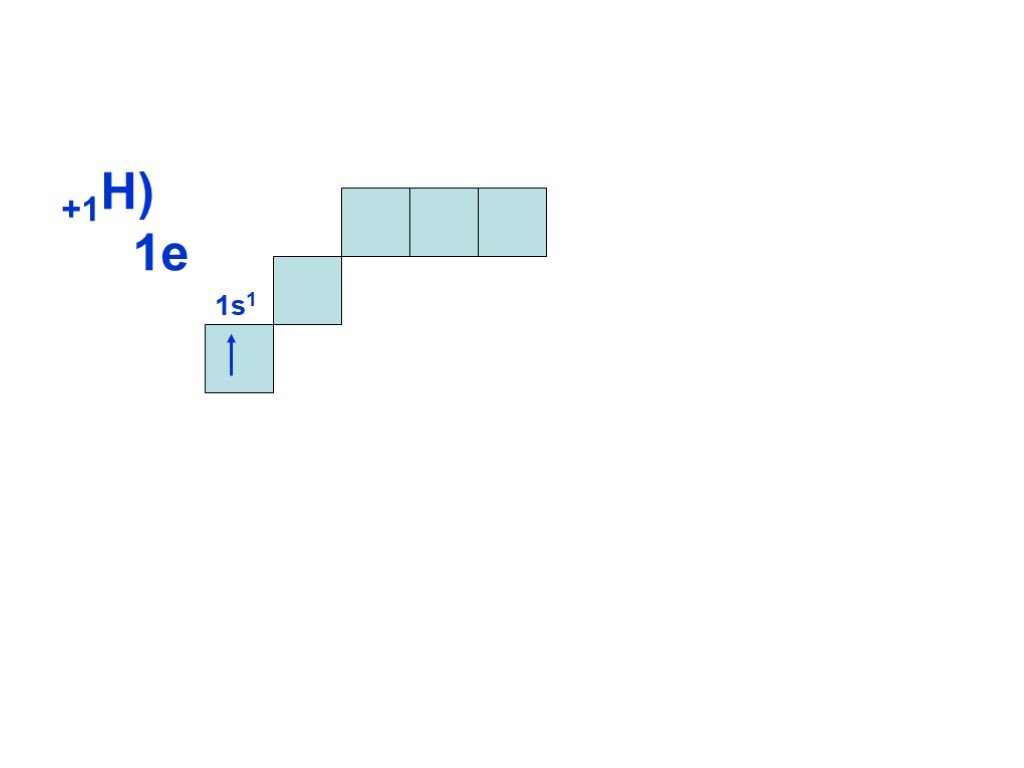
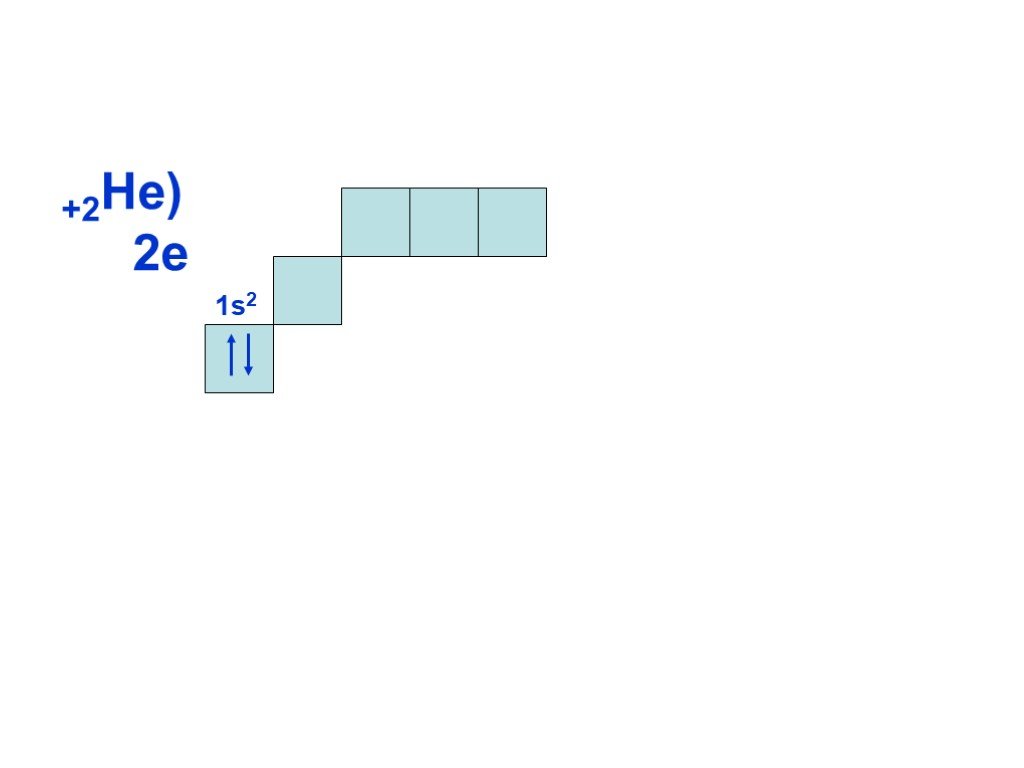
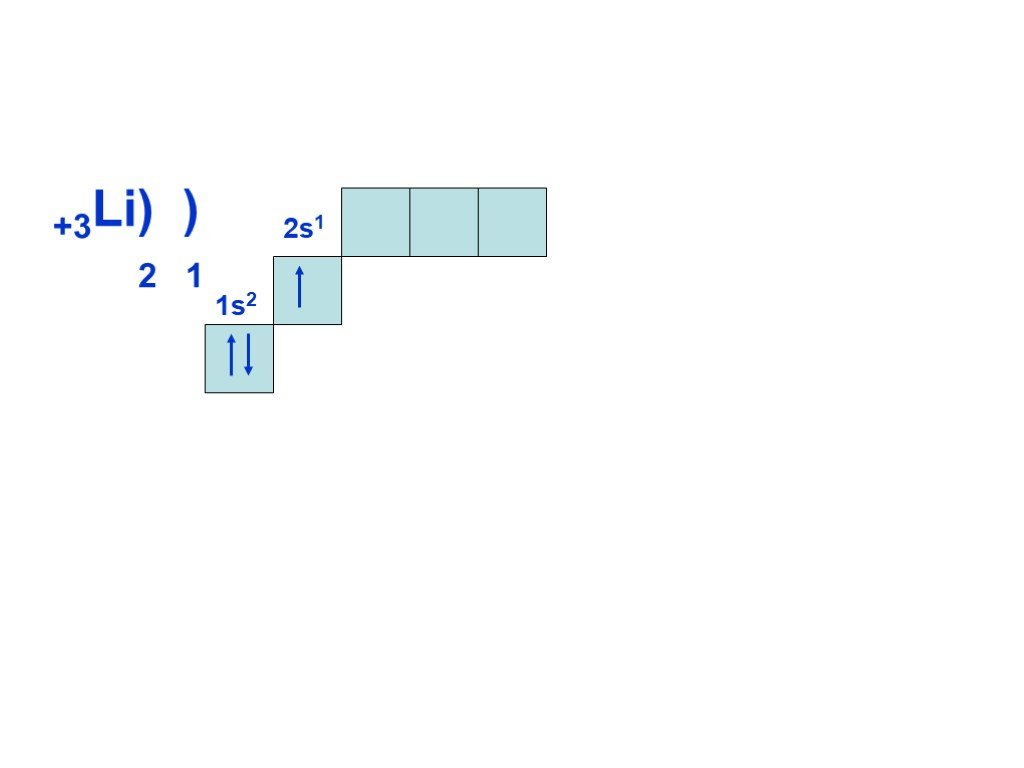
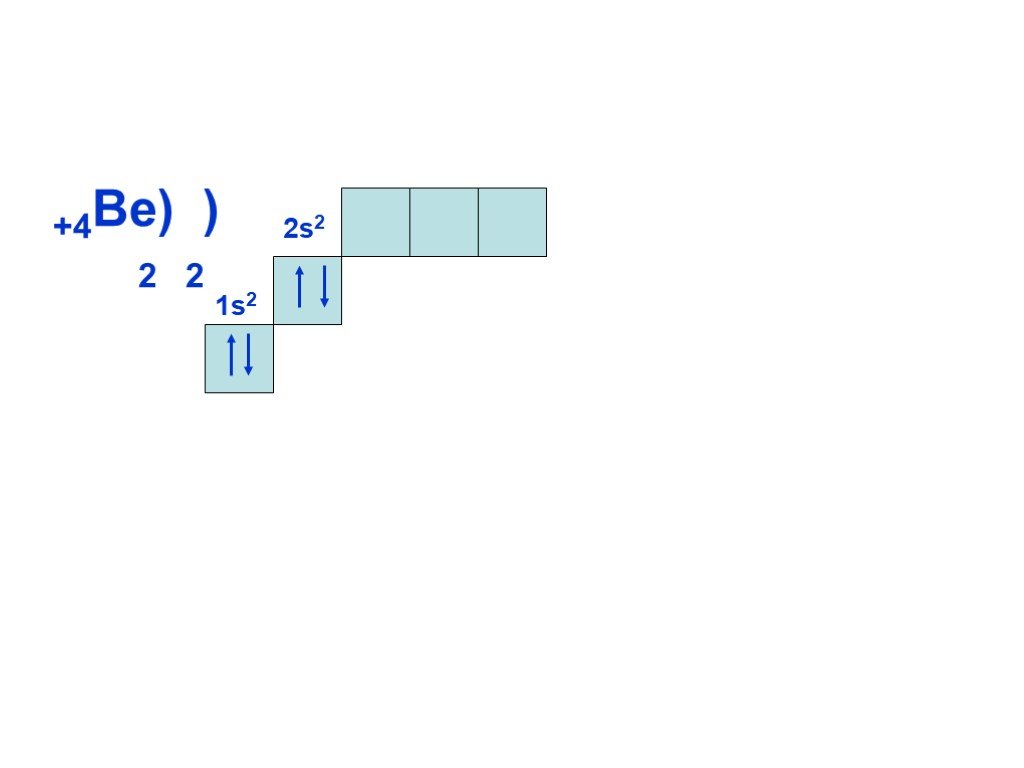
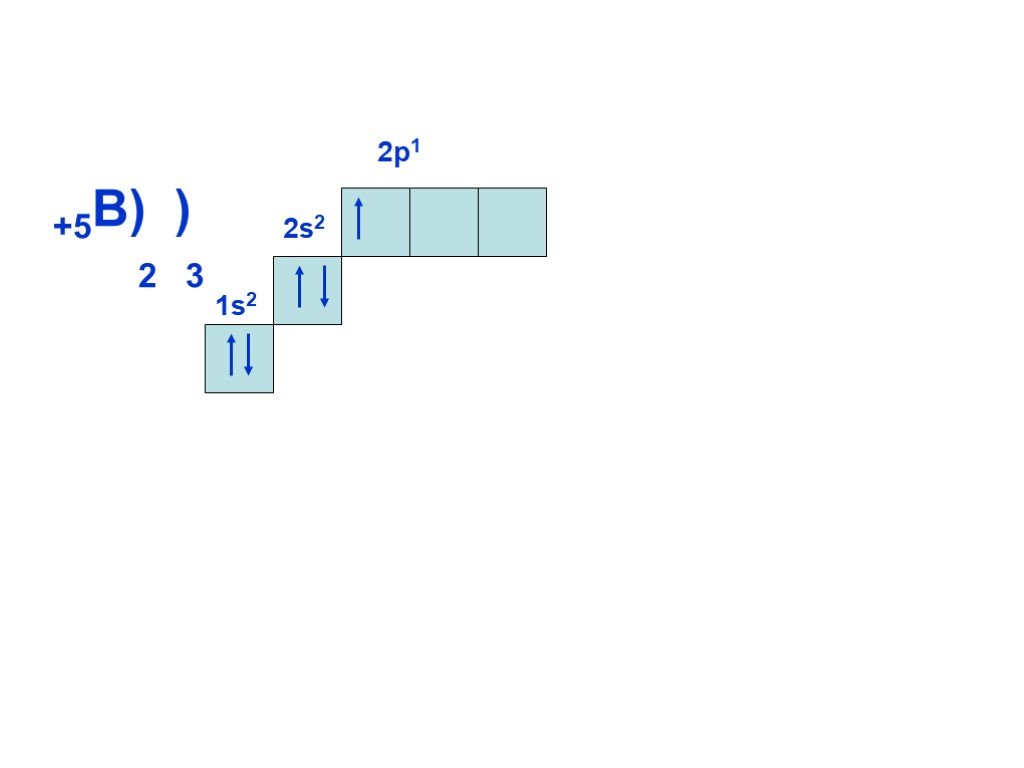
Слайд 8Согласно принципу наименьшей энергии, сначала заполняется энергетический уровень с n=1, затем, после заполнения первого уровня, с n=2 и т.д. Всего на первом уровне (n=1) может находиться только два электрона, на втором (n=2) восемь, на третьем (n = 3) восемнадцать, т.е. на уровне с номером n может находиться не более 2n электронов. Это следует из другого правила, которое выполняется при построении электронной оболочки атома и называется принципом Паули: в атоме не может быть электронов, у которых бы совпадал весь набор из четырех квантовых чисел.
2
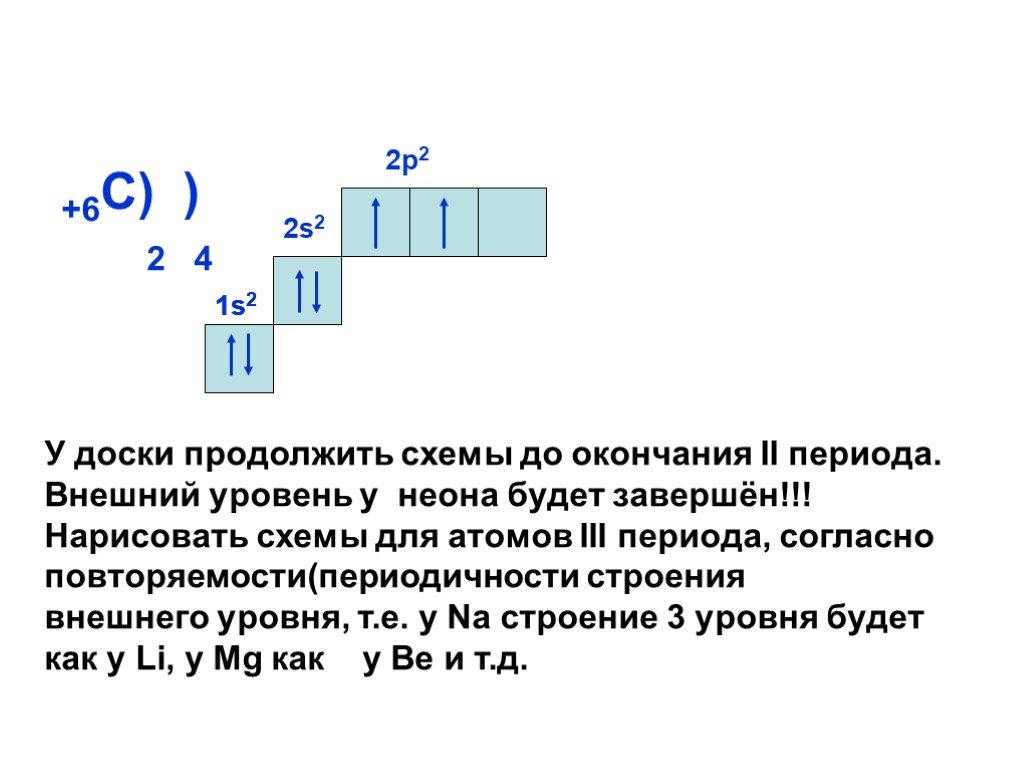
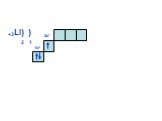
Слайд 15+6С) ) 2 4 2р2
У доски продолжить схемы до окончания II периода. Внешний уровень у неона будет завершён!!! Нарисовать схемы для атомов III периода, согласно повторяемости(периодичности строения внешнего уровня, т.е. у Na строение 3 уровня будет как у Li, у Mg как у Be и т.д.
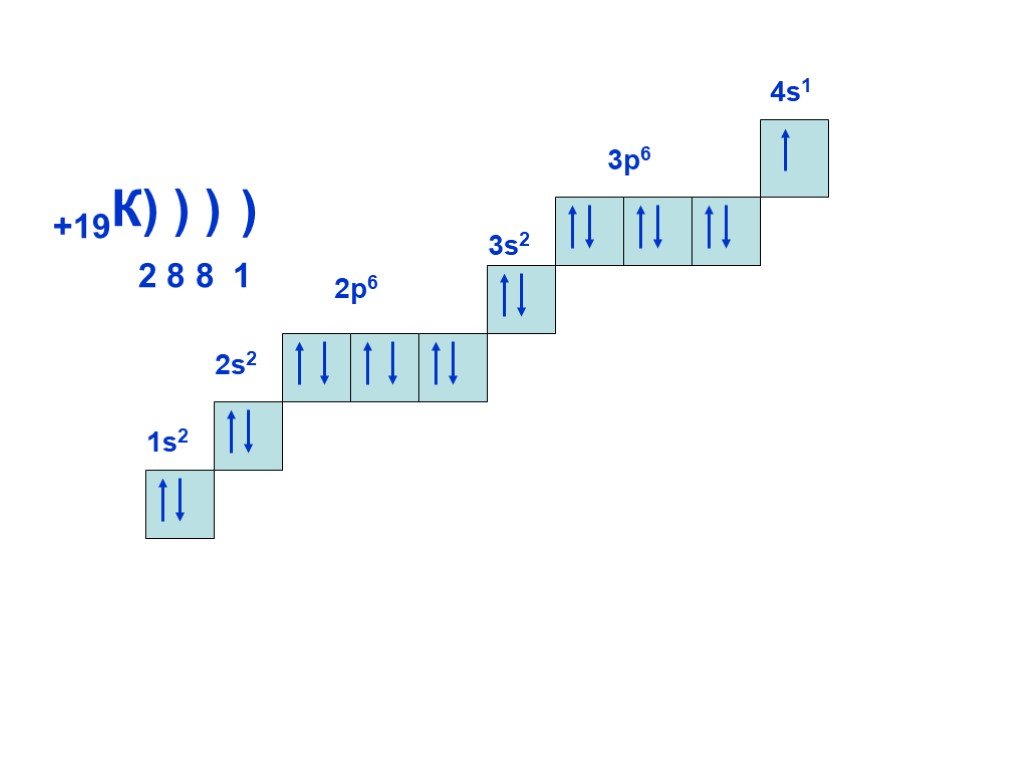
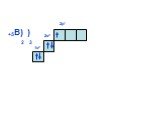
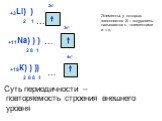
Слайд 16+19К) ) ) 2 8 8 1 2р6 3s2 4s1 3р6 )
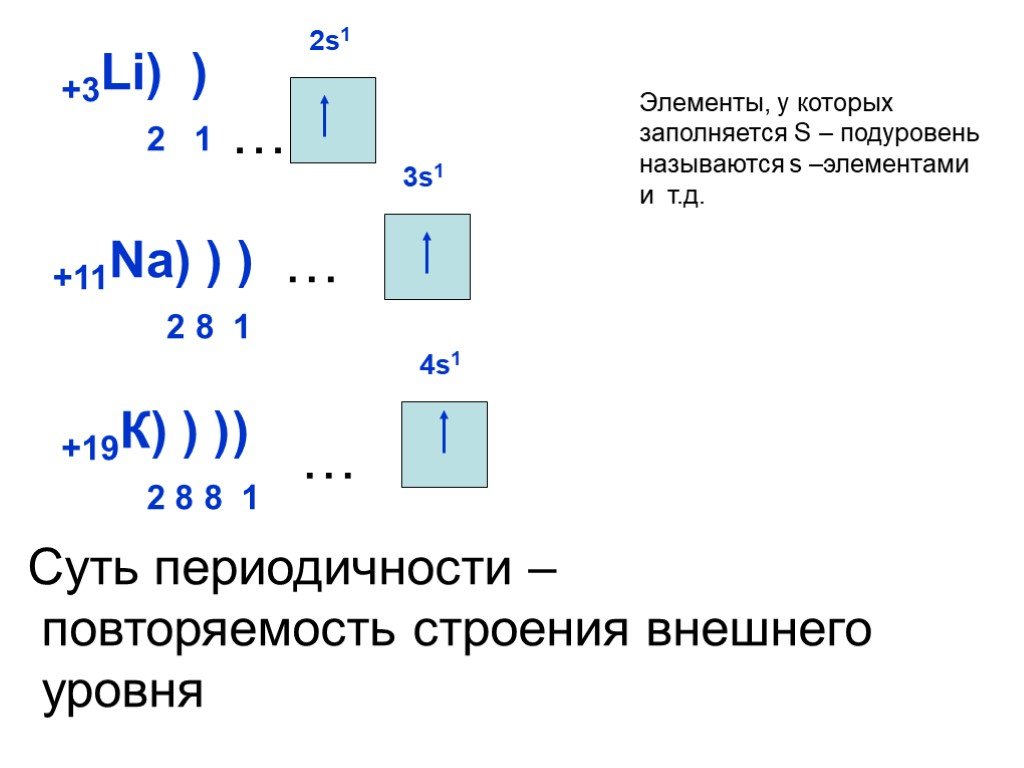
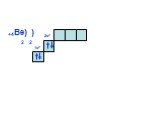
Слайд 17… +11Na) ) ) 2 8 1 3s1
Суть периодичности – повторяемость строения внешнего уровня
Элементы, у которых заполняется S – подуровень называются s –элементами и т.д.
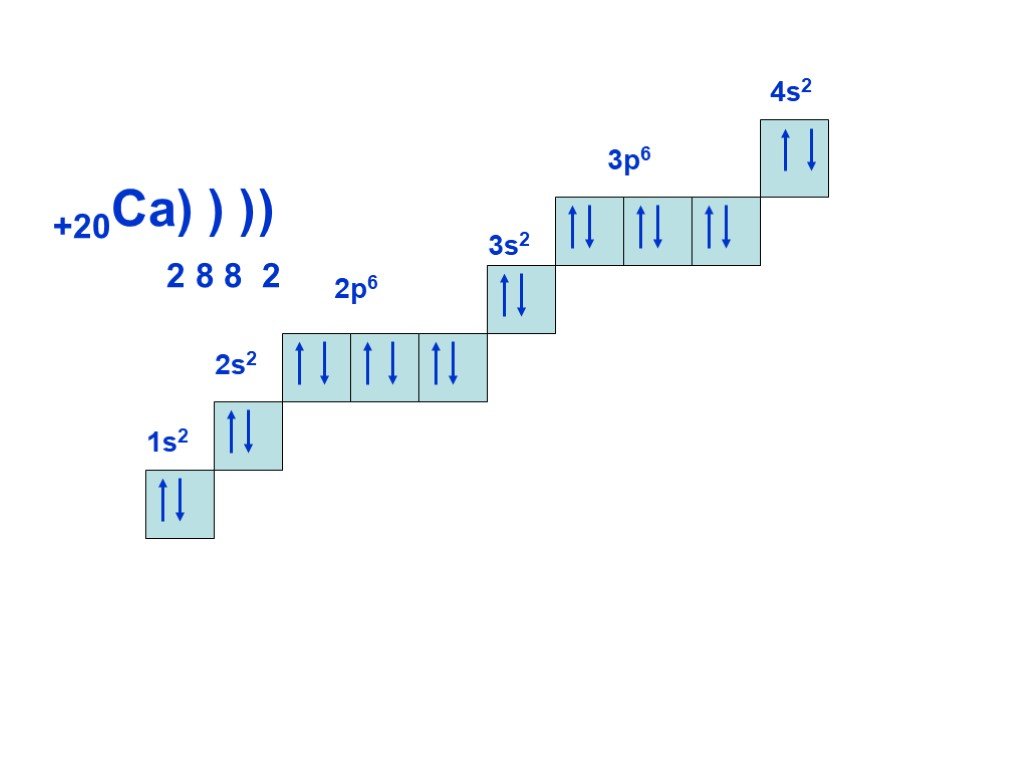
Слайд 18+20Ca) ) ) 2 8 8 2 4s2
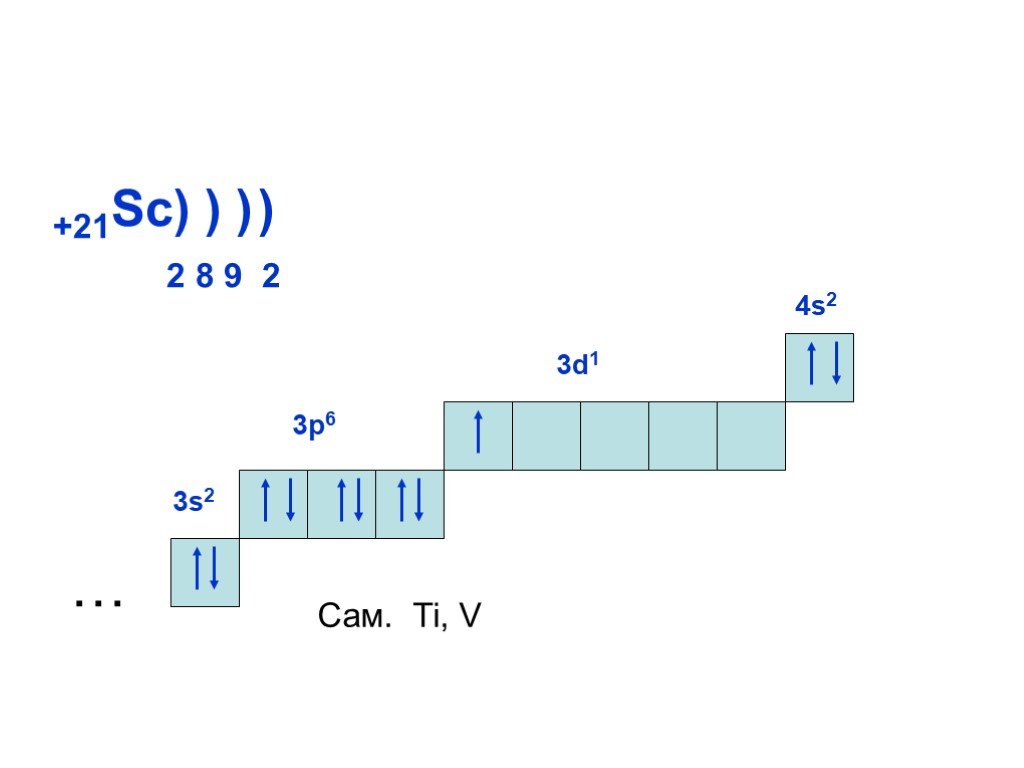
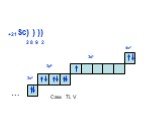
Слайд 19+21Sc) ) ) 2 8 9 2 3d1 Сам. Ti, V
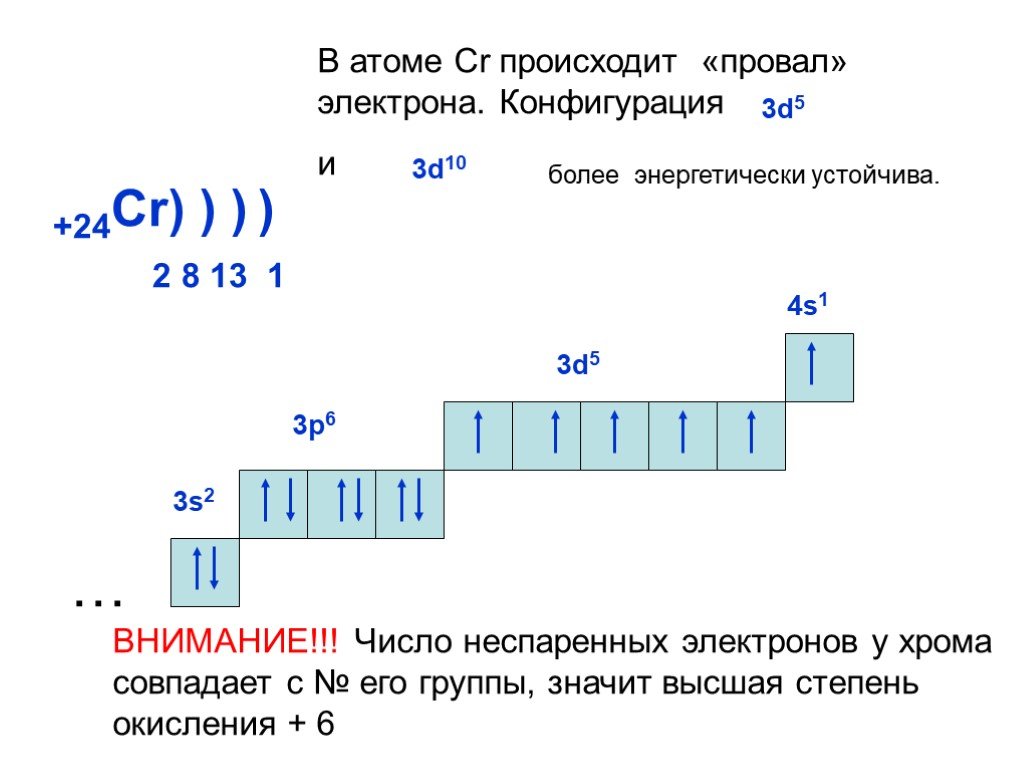
Слайд 20+24Cr) ) ) 2 8 13 1 3d5
В атоме Cr происходит «провал» электрона. Конфигурация и
3d10
более энергетически устойчива.
ВНИМАНИЕ!!! Число неспаренных электронов у хрома совпадает с № его группы, значит высшая степень окисления + 6
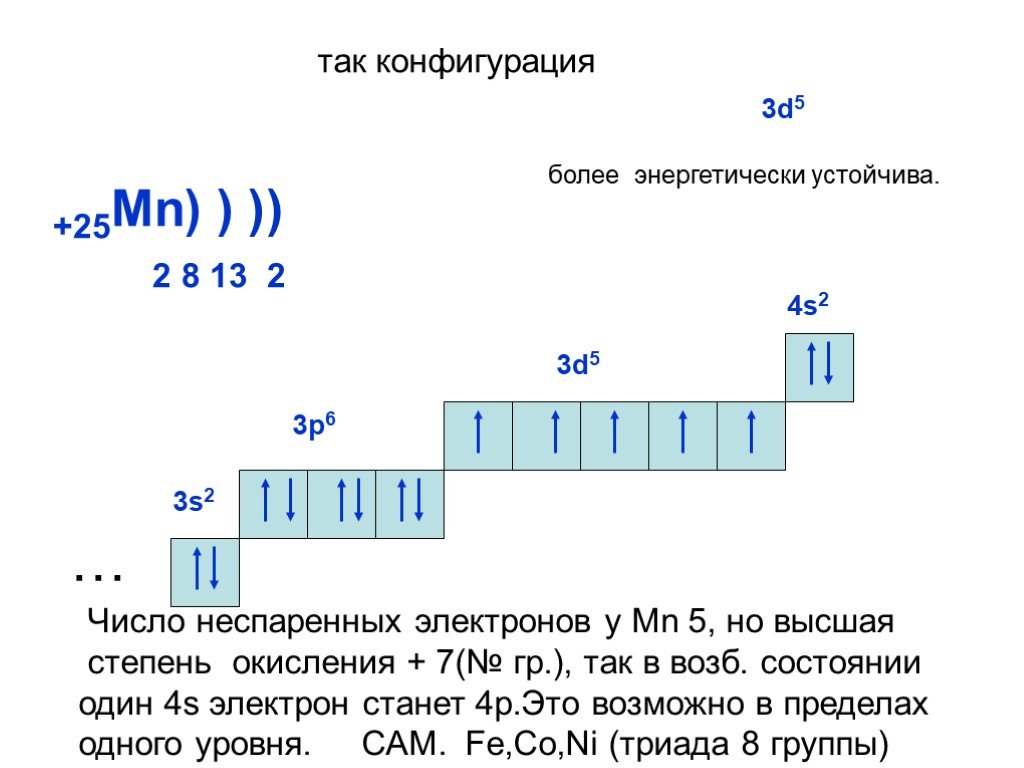
Слайд 21+25Mn) ) ) 2 8 13 2 так конфигурация
Число неспаренных электронов у Mn 5, но высшая степень окисления + 7(№ гр.), так в возб. состоянии один 4s электрон станет 4р.Это возможно в пределах одного уровня. САМ. Fe,Co,Ni (триада 8 группы)
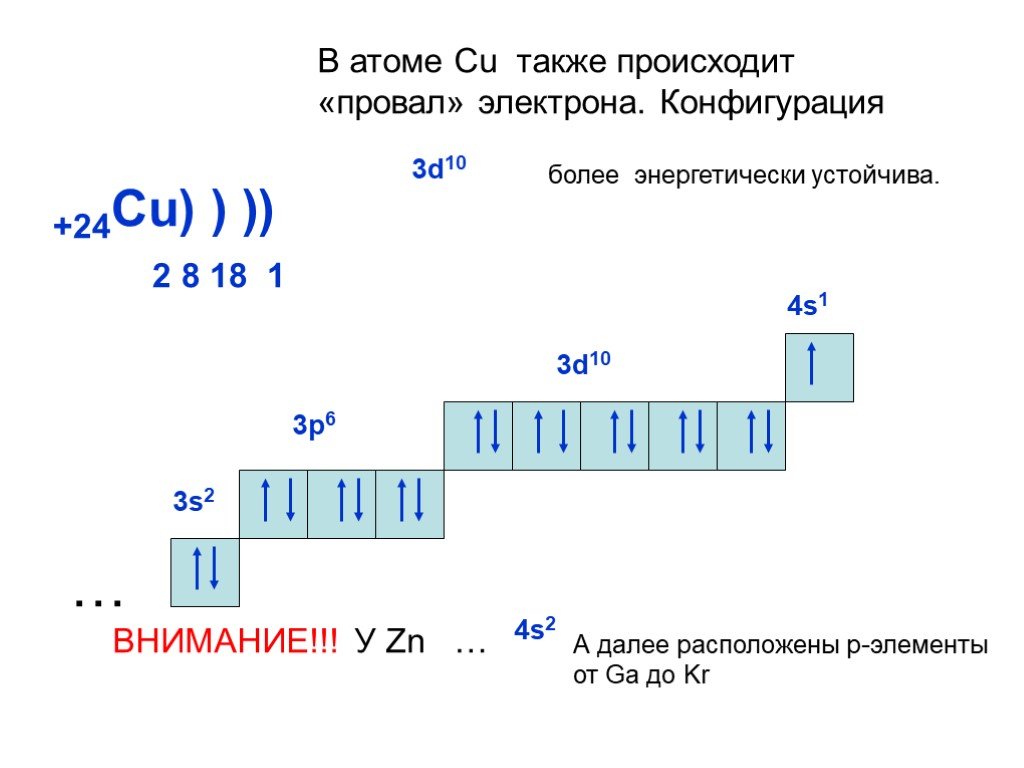
Слайд 22+24Cu) ) ) 2 8 18 1
В атоме Cu также происходит «провал» электрона. Конфигурация
ВНИМАНИЕ!!! У Zn …
А далее расположены р-элементы от Ga до Kr
Слайд 23У элементов V периода идёт заполнение подуровней в следующем порядке: 5s 4d 5p и тоже есть исключения - «провалы» электронов (см. табл. Менделеева в учебнике).
Слайд 24В VI и VII периодах появляются f –элементы на 3-ем снаружи уровне. 4f- элементы – лантаноиды 5f- элементы – актиноиды Так, Cs и Ba - 6s – элементы; La 5d-элемент Ce - Lu – 4 f- элементы Здесь также встречаются «провалы», связанные с эн.устойчивостью Наполовину и полностью заполненных f- подуровней.
Слайд 25Ряд последовательного заполнения электронами орбиталей атомов
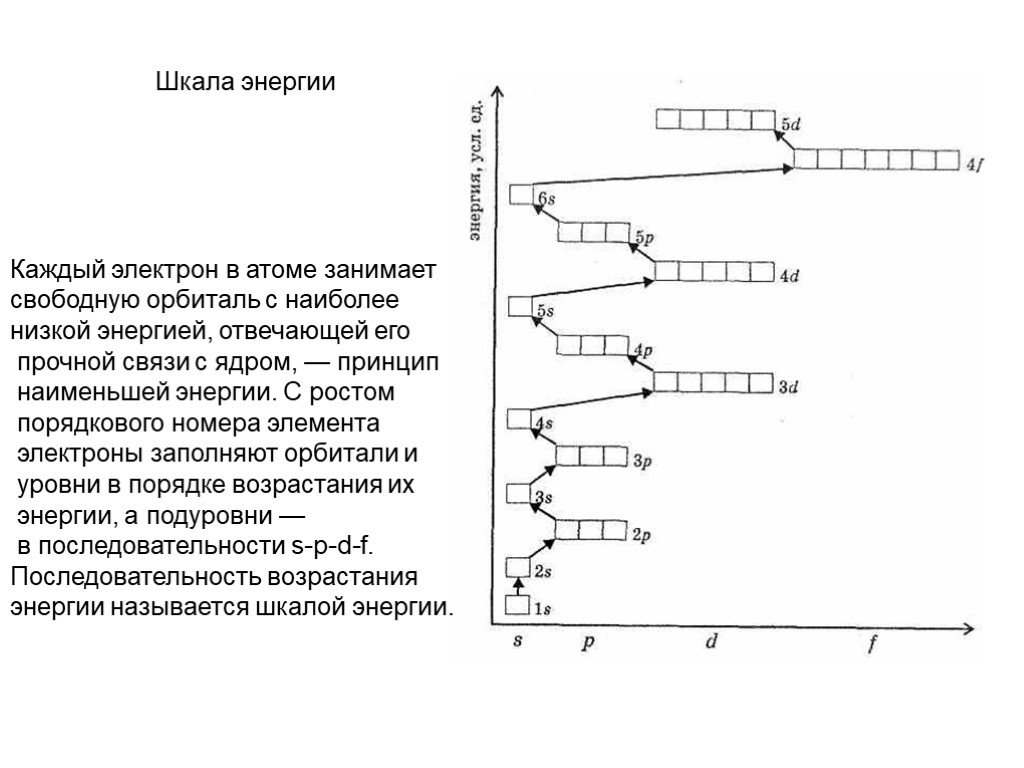
Слайд 26Шкала энергии
Каждый электрон в атоме занимает свободную орбиталь с наиболее низкой энергией, отвечающей его прочной связи с ядром, — принцип наименьшей энергии. С ростом порядкового номера элемента электроны заполняют орбитали и уровни в порядке возрастания их энергии, а подуровни — в последовательности s-p-d-f. Последовательность возрастания энергии называется шкалой энергии.
Слайд 27Домашнее задание
§2, вопросы 4,5,6 §3, вопросы 3,5,6.7