Слайд 1Металлургия титана
Лекция
Слайд 2Титан
Простое вещество титан — лёгкий металл серебристо-белого цвета. Титан отличается высокой механической прочностью, коррозионной стойкостью, жаропрочностью. Теплопроводность (300 K) 21,9 Вт/(м·К) Тпл = 1660 °C или 1933 К Плотностью (4,51 г/см3).
Слайд 3Руда
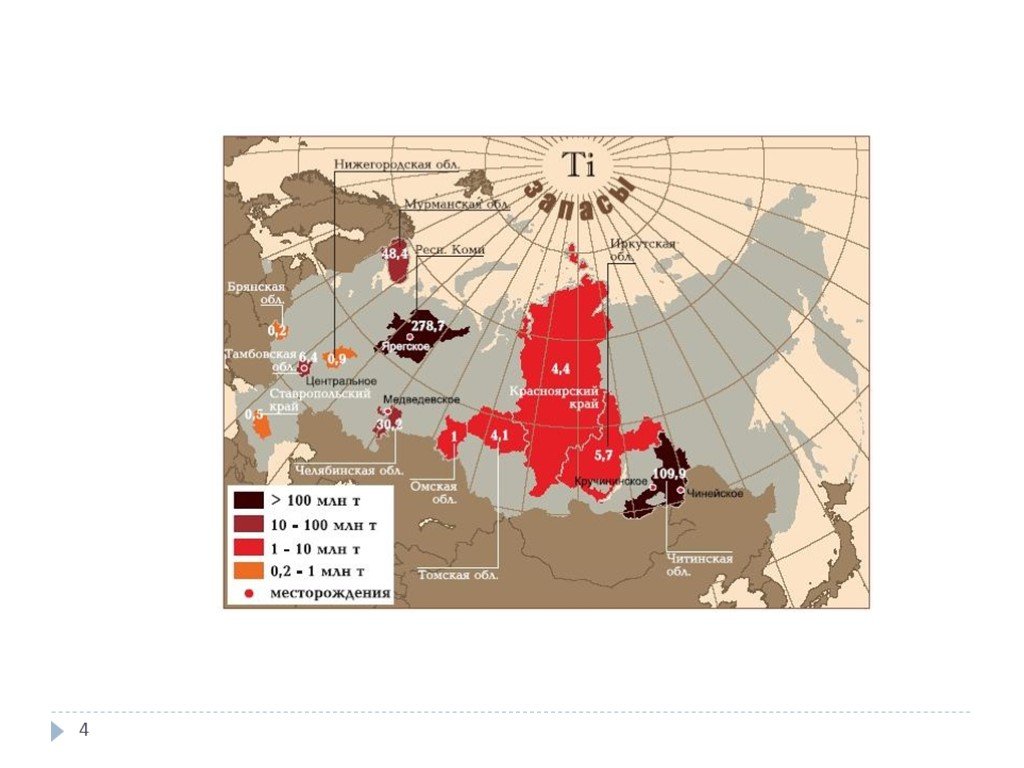
Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре 0,57 % по массе. В земной коре титан почти всегда четырёхвалентен и присутствует только в кислородных соединениях. В свободном виде не встречается. Важнейшие титановые руды: рутил TiO2, ильменит FeTiO3, титаномагнетит FeTiO3 + Fe3O4, перовскит CaTiO3, титанит CaTiOSiO5. Различают коренные руды титана — ильменит-титаномагнетитовые и россыпные — рутил-ильменит-цирконовые. Содержание TiO2 в них меняется от 10 до 60 %. Эти руды легко обогащаются. Россия обладает вторыми в мире, после Китая, запасами титана. Месторождения Урал, Приднепровье.
Слайд 4
Слайд 5Производство
Схема переработки руд зависит от состава. В случае ильменитовых руд присутствуют следующие этапы переработки: Получение титанового шлака восстановительной плавкой Получение тетрахлорида титана хлорированием титановых шлаков Металлотермическое восстановление титана из тетрахлорида Рафинирование титана
Слайд 61. Получение титанового шлака восстановительной плавкой
На этом этапе происходит выделение железа из концентрата. Основной реакцией является: FeO·TiO2 + С = Fe + TiO2 + CO Из восстановленного и науглероживающегося железа образуется чугун, а оксид титана переходит в шлак, который содержит 82—90% TiO2 (титановый шлак).
Слайд 72. Получение тетрахлорида титана хлорированием титановых шлаков
Получение тетрахлорида титана TiCl4 осуществляют воздействием газообразного хлора на оксид титана при температурах 700—900 °С, при этом протекает реакция: TiO2 + 2Cl2 + 2С = TiCl4↑ + 2СО, температура процесса 700-1000 °C. Исходным титаносодержащим сырьем при этом является титановый шлак. Хлоратор – шахтная или шахтная электрическая печь. При хлорировании примеси титанового шлака также переходят в газовую фазу и затем конденсируются вместе с тетрахлоридом титана.

Слайд 8Очистку проводят тетрахлорида комбинированной конденсациях в конденсаторах: 1 конденсатор: вход 500-600 °C, выход 300-350 °C, конденсируется MgCl2, CaCl2, MnCl4, FeCl2. 2 конденсатор: вход 120-180 °C, конденсируется FeCl3, AlCl3. 3 конденсатор оросительный: здесь проводится охлаждение газа жидким распыленным TiCl4. В результате образуется пульпа, она стекает в бак, затем в сгуститель. Из него верхний слив (тетрахлорид титана) направляется на дальнейшую переработку, а нижний слив – (осадок твердых хлоридов в тетрахлориде титана) – направляют в испаритель (шахтная электропечь). Там происходит отгонка тетрахлорида титана от примесей. TiCl4 содержит 1% примесей, их выделяют дистиляционными методами (ректификацией – многократной дистиляцией).

Слайд 93. Металлотермическое восстановление титана из тетрахлорида
TiCl4 (магние- или натриетермия) и TiO2 (алюмотермическое или кальциетермическое восстановление). Восстановление первого соединения предпочтительнее, т.к. Mg и Na не растворимы в титане. При восстановлении алюминием или кальцием в титане остается много примесей (в основном О2) его используют для получения лигатур и ферротитана.
Слайд 104. Рафинирование титана
Для получения титана высокой чистоты применяют так называемый йодидный способ, при котором используется реакция: Ti + 2I2 = Til4 При температуре 100—200 °С реакция протекает в направлении образования Til4, а при температуре 1300—1400 °С— в обратном направлении: Til4 = Ti + 2I2 Получаемый металл содержит 99,9—99,99 % Ti. В настоящее время применяют для очистки титана так же электролиз хлоридов титана в электролите, состоящем из NaCl, KCl или смесей хлоридов с невысокой температурой плавления.
Слайд 11Получение титановых слитков
Для получения ковкого титана в виде слитков губку переплавляют в вакуумной дуговой печи. Расходуемый (плавящийся) электрод получают прессованием губки и титановых отходов. Жидкий титан затвердевает в печи в водоохлаждаемом кристаллизаторе.
Слайд 12Применение
Химической промышленность (реакторы, трубопроводы, насосы, трубопроводная арматура) Военной промышленность (бронежилеты, броня в авиации, корпуса подводных лодок) Промышленные процессы (опреснительных установках, процессах целлюлозы и бумаги) Автомобильная промышленность Сельскохозяйственной промышленность Пищевая промышленность Медицинская промышленность (протезы, остеопротезы, стоматологические и хирургические инструменты, зубные имплантаты и т.д.) Является важнейшим конструкционным материалом в авиа-, ракето-, кораблестроении.

Слайд 13Сплавы
Титан является легирующей добавкой в некоторых марках стали. Нитинол (никель-титан) — сплав, обладающий памятью формы, применяемый в медицине и технике. Алюминиды титана являются очень стойкими к окислению и жаропрочными, что в свою очередь определило их использование в авиации и автомобилестроении в качестве конструкционных материалов. В виде соединений: Белый диоксид титана (TiO2) используется в красках (например, титановые белила), а также при производстве бумаги и пластика. Пищевая добавка E171. Титанорганические соединения применяются в качестве катализатора и отвердителя в химической и лакокрасочной промышленности. Неорганические соединения титана применяются в химической электронной, стекловолоконной промышленности в качестве добавки или покрытий. Диборид титана — важный компонент сверхтвёрдых материалов для обработки металлов. Нитрид титана применяется для покрытия инструментов. Титанат бария BaTiO3, титанат свинца PbTiO3 и ряд других титанатов —сегнетоэлектрики.

Слайд 14Диоксид титана
Оксид титана (IV) TiO2 — амфотерный оксид четырёхвалентного титана. Является основным продуктом титановой индустрии (на производство чистого титана идёт лишь около 5 % титановой руды). В чистом виде в природе встречается в виде минералов рутила, анатаза и брукита, причём основную часть составляет рутил. Известен как диоксид титана, двуокись титана, титановые белила, пищевой краситель E171
Слайд 15Существуют три основных метода получения диоксида титана из его тетрахлорида: гидролиз водных растворов тетрахлорида титана (с последующей термообработкой осадка) парофазный гидролиз тетрахлорида титана (основан на взаимодействии паров тетрахлорида титана с парами воды)при 400 °C. термообработка тетрахлорида (сжигание в токе кислорода). Процесс обычно ведётся при температуре 900—1000 °C
Слайд 16Основные применения диоксида титана:
Производство лакокрасочных материалов, в частности, титановых белил — 57 % от всего потребления Производство пластмасс — 21 % Производство ламинированной бумаги — 14 %
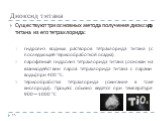
Слайд 17Рынок и цены
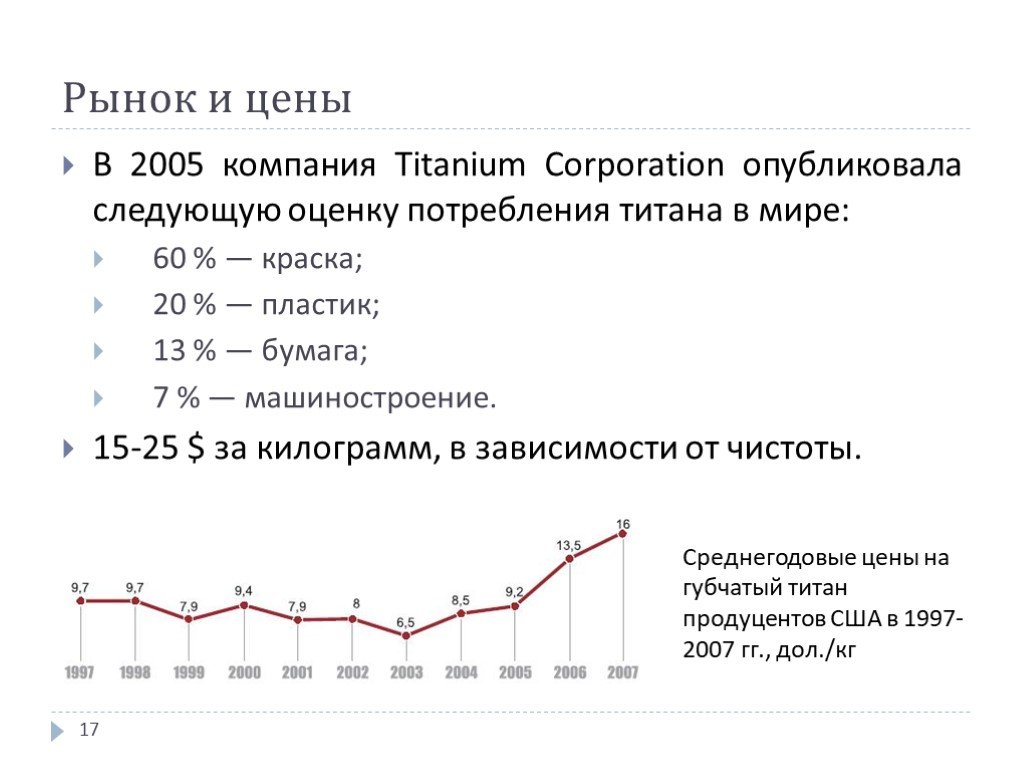
В 2005 компания Titanium Corporation опубликовала следующую оценку потребления титана в мире: 60 % — краска; 20 % — пластик; 13 % — бумага; 7 % — машиностроение. 15-25 $ за килограмм, в зависимости от чистоты.
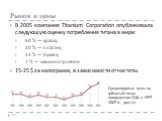
Среднегодовые цены на губчатый титан продуцентов США в 1997-2007 гг., дол./кг
Слайд 18