Слайд 1УЧАСТИЕ МИКРООРГАНИЗМОВ В КРУГОВОРОТЕ АЗОТА
1. Круговорот азота 2. Свободноживущие азотфиксаторы 3. Симбиотическая фиксация азота у бобовых растений 4. Симбиотическая азотфиксация у небобовых растений 5. Химизм фиксации микроорганизмами молекулярного азота
Азот – это вечный источник танталовых мук человечества, вечные терзания голода среди роскошного изобилия (американский биохимик М. Камен)
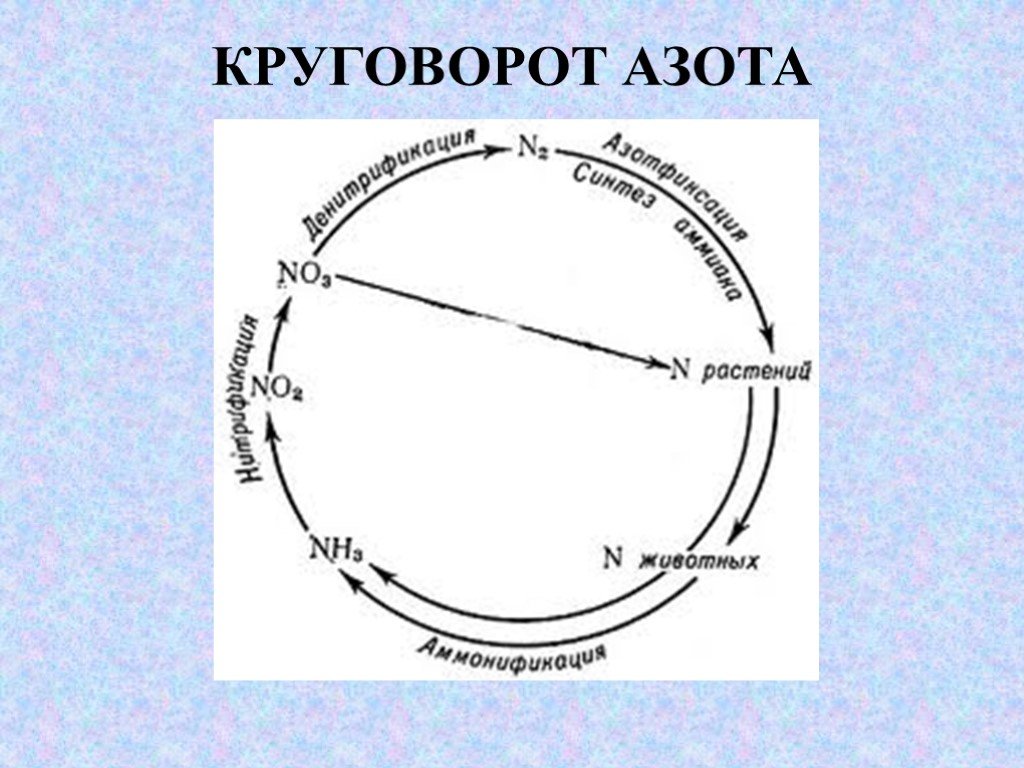
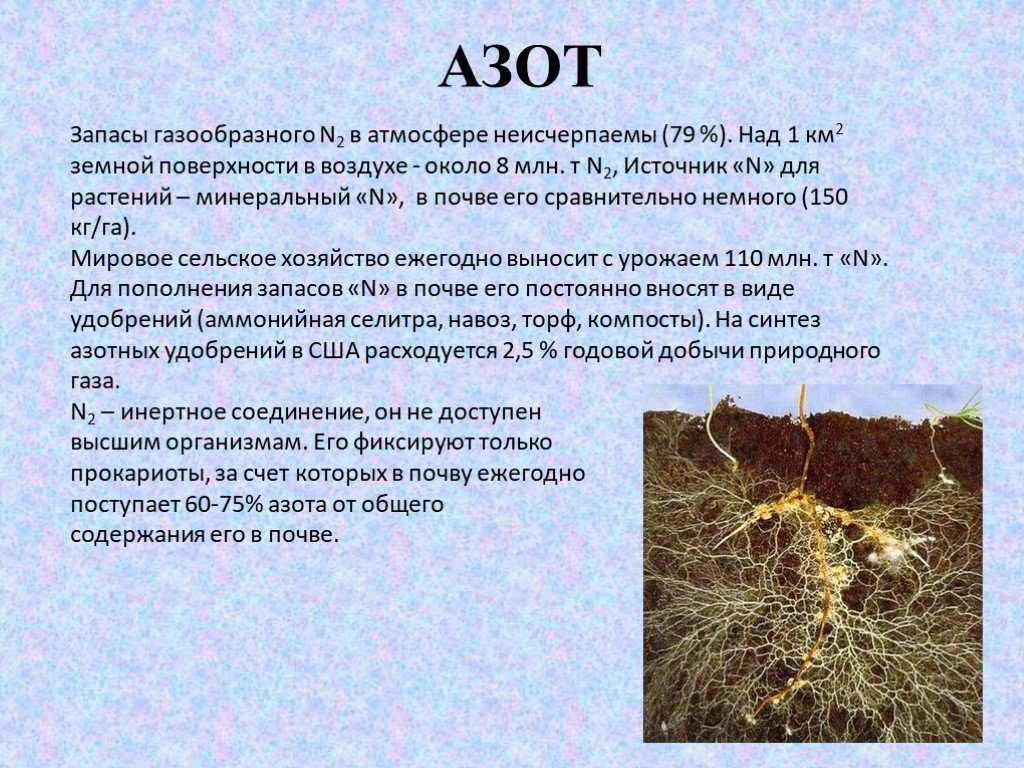
Слайд 3АЗОТ
Запасы газообразного N2 в атмосфере неисчерпаемы (79 %). Над 1 км2 земной поверхности в воздухе - около 8 млн. т N2, Источник «N» для растений – минеральный «N», в почве его сравнительно немного (150 кг/га). Мировое сельское хозяйство ежегодно выносит с урожаем 110 млн. т «N». Для пополнения запасов «N» в почве его постоянно вносят в виде удобрений (аммонийная селитра, навоз, торф, компосты). На синтез азотных удобрений в США расходуется 2,5 % годовой добычи природного газа. N2 – инертное соединение, он не доступен высшим организмам. Его фиксируют только прокариоты, за счет которых в почву ежегодно поступает 60-75% азота от общего содержания его в почве.

Слайд 4ФИКСАЦИЯ АТМОСФЕРНОГО АЗОТА
Фиксировать N2 способны более 30 видов бактерий: клостридии, энтеробактерии, сульфатредукторы, спириллы, актиномицеты, цианобактерии. В природе азотфиксация происходит биологическим и небиологическим путями (газовые разряды, работа двигателей внутреннего сгорания - 0,5 % фиксированного «N», в то время как общая продукция биологической фиксации «N» – 300 млн. т в год.
Слайд 5ОТКРЫТИЕ АЗОТФИКСАТОРОВ
Впервые обогащение субстратов «N» в результате деятельности свободноживущих микроорганизмов показал французский ученый Жоден (1882). М. Бертло (1885) подтвердил это. М. Бейеринк (1901) открыл Azotobacter chroococcum (семейство Azotobacteriaceae).
М. Бейеринк (1851-1931, Голландия)
Пьер–Эжен Марселен Бертло (1827-1907, Франция)
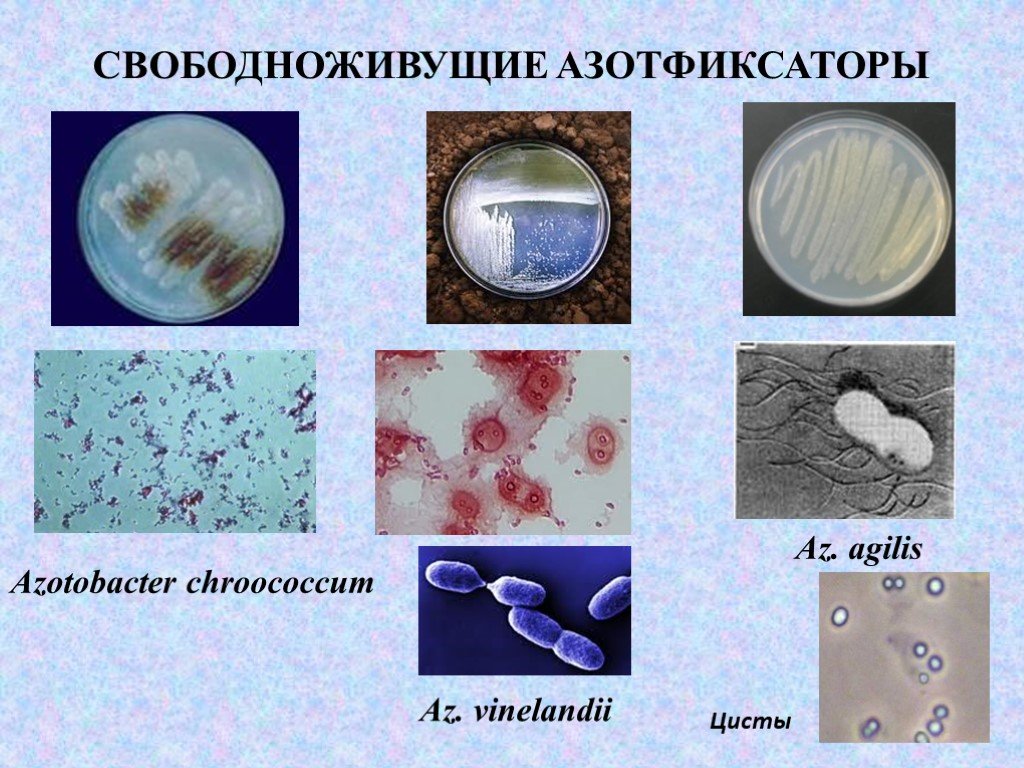
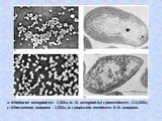
Слайд 6СВОБОДНОЖИВУЩИЕ АЗОТФИКСАТОРЫ
Azotobacter chroococcum Az. vinelandii Az. agilis Цuсты
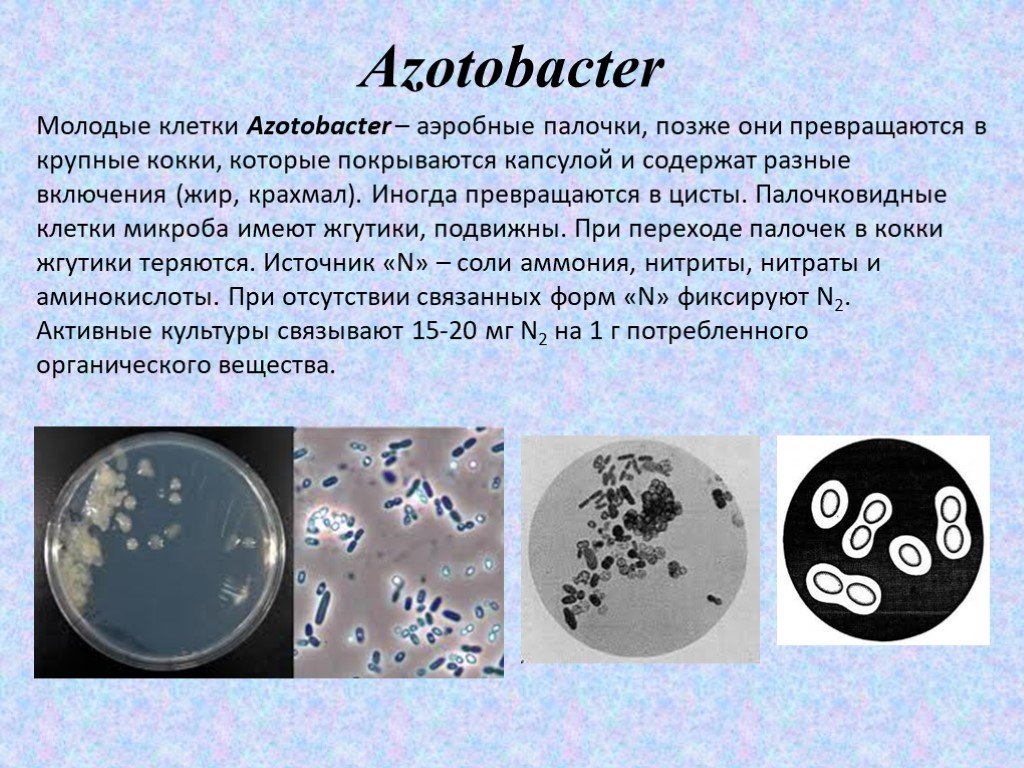
Слайд 7Azotobacter
Молодые клетки Azotobacter – аэробные палочки, позже они превращаются в крупные кокки, которые покрываются капсулой и содержат разные включения (жир, крахмал). Иногда превращаются в цисты. Палочковидные клетки микроба имеют жгутики, подвижны. При переходе палочек в кокки жгутики теряются. Источник «N» – соли аммония, нитриты, нитраты и аминокислоты. При отсутствии связанных форм «N» фиксируют N2. Активные культуры связывают 15-20 мг N2 на 1 г потребленного органического вещества.

Слайд 8Пищевые потребности Azotobacter
Azotobacter использует огромный набор органических соединений – моно- и дисахариды, некоторые полисахариды (декстрин, крахмал), спирты, органические кислоты, в том числе ароматические. Проявляет высокую потребность в органических веществах, поэтому он в больших количествах встречается в нейтральных влажных почвах, богатых органикой, особенно весной. Летом в засуху клетки отмирают. Для роста нужен фосфор, кальций, молибден, его используют в качестве биологического индикатора на наличие этих элементов в почве.

Слайд 9Beijerinckia
К семейству Azotobacteriaceae относится род Beijerinckia. Она отличается кислотоустойчивостью (рН около 3), кальцифобностью. Впервые выделена из кислых почв рисовых полей Индии Р. Старки и П. Де (1939). Ее сначала назвали Azotobacter indicum. Клетки Beijerinckia палочковидной, овальной или круглой формы. Некоторые виды подвижны, другие неподвижны. Иногда образуют капсулы. Цисты и эндоспоры отсутствуют. На безазотной среде с глюкозой дают выпуклые, блестящие, нередко складчатые слизистые колонии, которые при старении окрашиваются в красноватый или темно-коричневый цвет.

Слайд 10Пищевые потребности Beijerinckia
В отличие от Azotobacter, Beijerinckia не усваивает ароматические соединения и хуже ассимилирует органические кислоты. При развитии на углеводах в среде накапливаются уксусная и другие органические кислоты. Beijerinckia менее требовательна по сравнению с Azotobacter к фосфору, менее чувствительна к повышенной концентрации солей «Fe» и «Al», нуждается в меньшем количестве молибдена. Распространена в кислых почвах субтропиков и тропиков, реже встречается в почвах умеренной зоны. В окультуренных кислых почвах юга содержится больше клеток Beijerinckia, чем в целинных. Целинные луговые почвы богаче Beijerinckia, чем лесные.
Слайд 11Derxia - медленно растущие палочки, обладающие в определенной стадии развития жгутиком. Колонии пленочные или слизистые, при старении желтовато-коричневые. Derxia обнаружена в почвах тропиков, как и бактерии рода Azomonas, также близкие к азотобактеру.
Derxia gummosa Azomonas agilis
Слайд 12Klebsiella (семейство Enterobacteriaceae) – Г–, факультативно- анаэробные палочки подвижные перитрихи. Они выносят низкое значение рН, встречаются в лесных подзолистых почвах, а в зоне умеренного климата – под травянистой растительностью. К зотфиксаторам относятся род Erwinia, некоторые расы Pseudomonas fluorescens (в почвах северной зоны), вибрионы спириллы (Azospirillum lipoferum и Az. brasilense), Arthrobacter
Klebsiella sрp. Pseudomonas fluorescens Azospirillum lipoferum

Слайд 13АНАЭРОБНЫЕ АЗОТФИКСАТОРЫ
Clostridium pasteurianum (С.Н. Виноградский, 1893) – анаэробная спорообразующая палочка. Молодые клетки перитрихи, старые образуют споры. В присутствии О2 Cl. pasteurianum может развиваться только при наличии в среде аэробных бактерий, поглощающих О2, малочувствителен к реакции среды (рН от 4,5-5,5 – 8-9). Споры Cl. pasteurianum выдерживают нагревание до 96° С в течение нескольких минут. Источник азотного питания – соли аммония, азотной кислоты и содержащие Cl. pasteurianum – слабоактивный азотфиксатор: связывает от 1 до 3 мг, иногда до 10-12 мг «N» на 1 г сброженного сахара. Способны фиксировать N2 Cl. butyricum, Cl. acetobutylicum, Cl. pectinovorum, Cl. felsineum. Анаэробные азотфиксаторы – Bacillus polymyxа и некоторые олиготрофные бактерии.
Bacillus polymyxа Clostridium pasteurianum
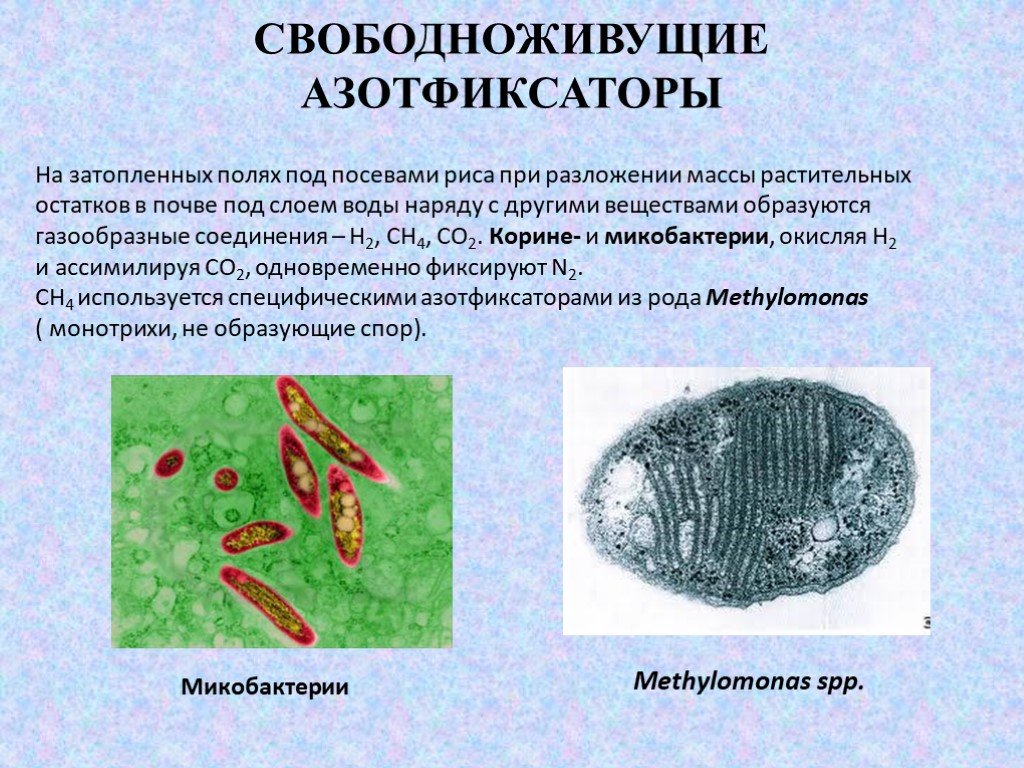
Слайд 14На затопленных полях под посевами риса при разложении массы растительных остатков в почве под слоем воды наряду с другими веществами образуются газообразные соединения – Н2, СН4, СО2. Корине- и микобактерии, окисляя Н2 и ассимилируя СО2, одновременно фиксируют N2. СН4 используется специфическими азотфиксаторами из рода Methylomonas ( монотрихи, не образующие спор).
Methylomonas sрp. Микобактерии
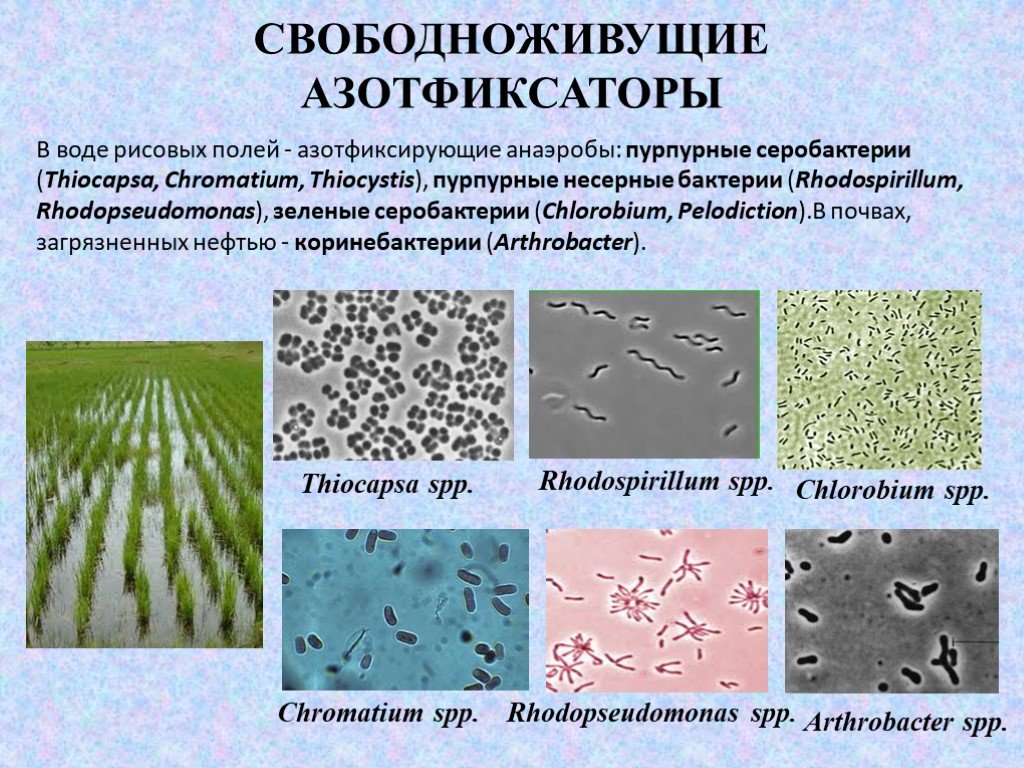
Слайд 15В воде рисовых полей - азотфиксирующие анаэробы: пурпурные серобактерии (Thiocapsa, Chromatium, Thiocystis), пурпурные несерные бактерии (Rhodospirillum, Rhodopseudomonas), зеленые серобактерии (Chlorobium, Pelodiction).В почвах, загрязненных нефтью - коринебактерии (Arthrobacter).
Thiocapsa sрp. Chromatium sрp. Rhodospirillum sрp. Chlorobium sрp. Arthrobacter sрр. Rhodopseudomonas sрр.
Слайд 16ЦИАНОБАКТЕРИИ - АЗОТФИКСАТОРЫ
Активные азотфиксаторы – аэробные цианобактерии: Anabaena, Nostoc, Cylindrospermum, Calothris, Tolypothrix и Scytonema. Распространены во всех почвенно-климатических зонах, но предпочитают нейтральную рН, поэтому их больше в южных нейтральных почвах. Многие цианобактерии живут в симбиозе с растениями, грибами, образуя при этом лишайники. Фиксируют N2 при 0° и -5°С.
Anabaena sрp. Nostoc sрp. Cylindrospermum sрp. Calothris sрp. Tolypothrix sрp. Scytonema sрp.

Слайд 17СИМБИОТИЧЕСКАЯ ФИКСАЦИЯ N2 У БОБОВЫХ РАСТЕНИЙ
Греческие и римские мыслители (100-150 лет до н. э.): бобовые растения повышают плодородие почвы Первые эксперименты в этом направлении – Ж.-Б. Буссенго (1838). М.С. Воронин (1866): описание микроскопических телец в тканях клубеньков. Г. Гельригель и Г. Вильфарт (1886-1888): взаимосвязь между бородавчатыми наростами на корнях бобовых растений (корневых клубеньков) и фиксацией растениями N2. В клубеньках обнаружили бактерии. Чистую культуру бактерий выделил М. Бейеринк (1888).
Ж.-Б. Буссенго (1802-1887)
М.С. Воронин (1838-1903)
Герман Гельригель (1831-1895)
М. Бейеринк (1851-1931)

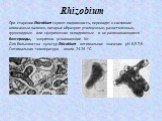
Слайд 18Rhizobium
Между бактериями и растениями устанавливаются симбиотические отношения. Клубеньки образуются лишь у представителей семейства Papilionaceae. К бобовым растениям относится около 10 000 видов, 200 используются в сельском хозяйстве. Клубеньковые бактерии относятся к роду Rhizobium – группа родственных микроорганизмов. Это Г– неспорообразующие аэробные палочки. Имеют жгутики, одни из них – монотрихи, другие – перитрихи.
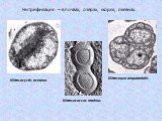
Слайд 19Цикл развития Rhizobium (по В.К. Шильниковой)
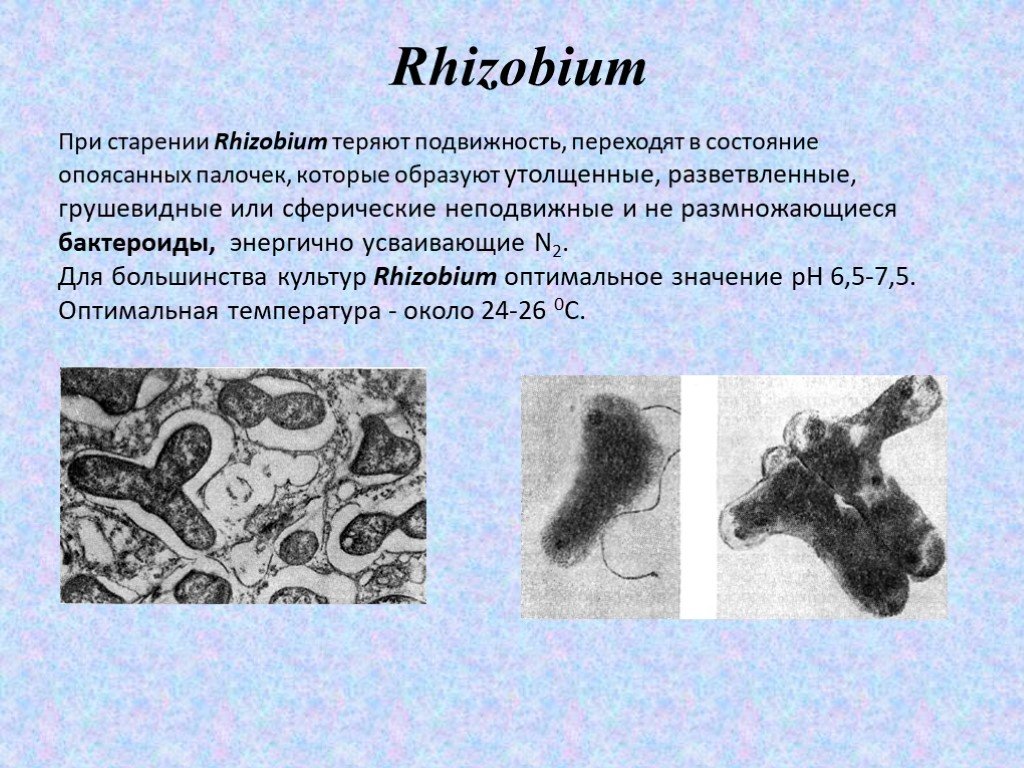
Слайд 20При старении Rhizobium теряют подвижность, переходят в состояние опоясанных палочек, которые образуют утолщенные, разветвленные, грушевидные или сферические неподвижные и не размножающиеся бактероиды, энергично усваивающие N2. Для большинства культур Rhizobium оптимальное значение рН 6,5-7,5. Оптимальная температура - около 24-26 0С.

Слайд 21Избирательность Rhizobium
На плотных средах клубеньковые бактерии обычно образуют бесцветные прозрачные слизистые колонии, иногда с шероховатой поверхностью. Отдельные культуры Rhizobium характеризуются избирательностью (специфичностью) по отношению к растению-хозяину: Rh. leguminosarum – бактерии гороха, вики, кормовых бобов, чечевицы; Rh. phaseoli – фасоли; Rh. japonicum – сои; Rh. vigna – вигны, маша, арахиса; Rh. cicer – нута; Rh. lupine – люпина; Rh. trifolii – клеверов; Rh. meliloti – люцерны, донника, тригонеллы; Rh. simplex– эспарцета; Rh. lotus – лядвенца; Rh. robinii – акации. В некоторых случаях наблюдается сортовая специфичность Rhizobium.

Слайд 22Взаимодействие Rhizobium с растением
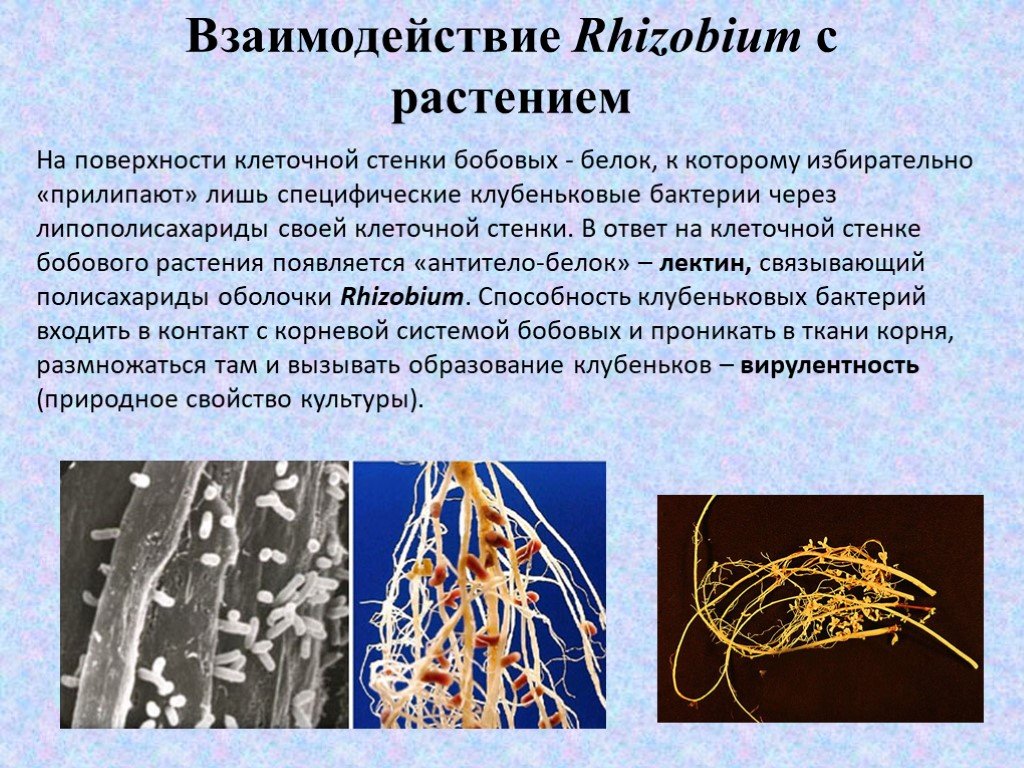
На поверхности клеточной стенки бобовых - белок, к которому избирательно «прилипают» лишь специфические клубеньковые бактерии через липополисахариды своей клеточной стенки. В ответ на клеточной стенке бобового растения появляется «антитело-белок» – лектин, связывающий полисахариды оболочки Rhizobium. Способность клубеньковых бактерий входить в контакт с корневой системой бобовых и проникать в ткани корня, размножаться там и вызывать образование клубеньков – вирулентность (природное свойство культуры).

Слайд 23Активность штаммов Rhizobium
Активность (эффективность) клубеньковых бактерий – способность в симбиозе с бобовыми растениями ассимилировать N2. В почве могут быть штаммы клубеньковых бактерий эффективные, неэффективные и переходные. Активные расы образуют многочисленные розовые клубеньки на главном корне, на боковых их мало. Цвет придает пигмент леггемоглобин (легоглобин). Клубеньки у неактивных рас Rhizobium зеленоватые. В активных бактероидах не накапливается гликоген.
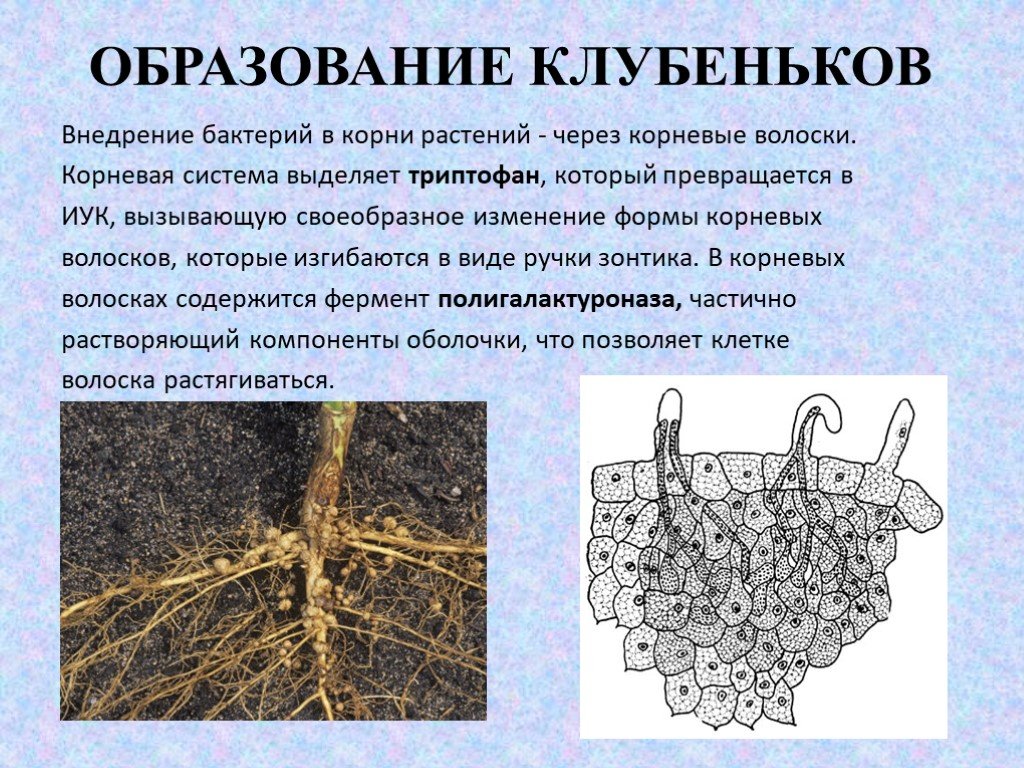
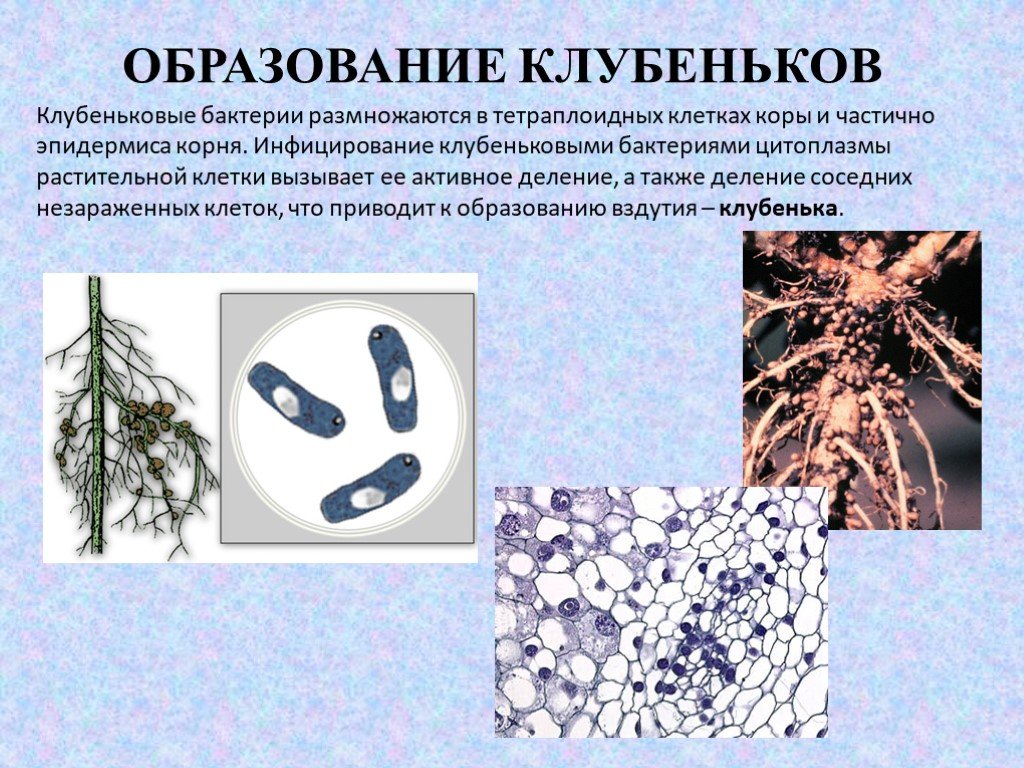
Слайд 24ОБРАЗОВАНИЕ КЛУБЕНЬКОВ
Внедрение бактерий в корни растений - через корневые волоски. Корневая система выделяет триптофан, который превращается в ИУК, вызывающую своеобразное изменение формы корневых волосков, которые изгибаются в виде ручки зонтика. В корневых волосках содержится фермент полигалактуроназа, частично растворяющий компоненты оболочки, что позволяет клетке волоска растягиваться.
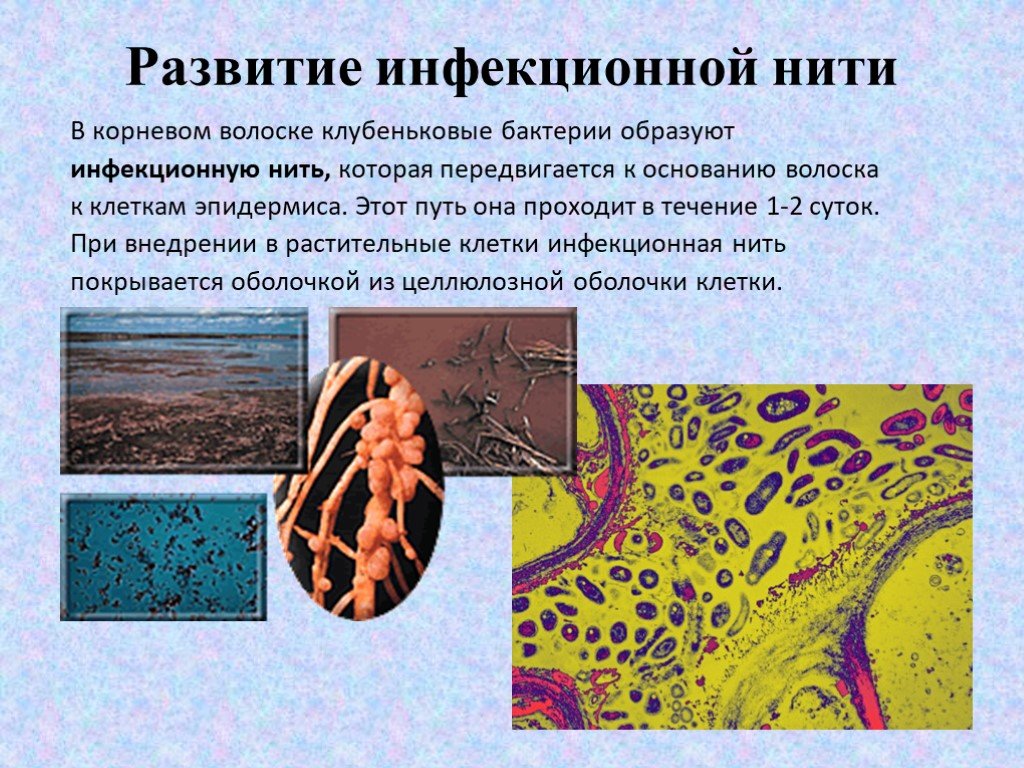
Слайд 25Развитие инфекционной нити
В корневом волоске клубеньковые бактерии образуют инфекционную нить, которая передвигается к основанию волоска к клеткам эпидермиса. Этот путь она проходит в течение 1-2 суток. При внедрении в растительные клетки инфекционная нить покрывается оболочкой из целлюлозной оболочки клетки.
Слайд 26Клубеньковые бактерии размножаются в тетраплоидных клетках коры и частично эпидермиса корня. Инфицирование клубеньковыми бактериями цитоплазмы растительной клетки вызывает ее активное деление, а также деление соседних незараженных клеток, что приводит к образованию вздутия – клубенька.
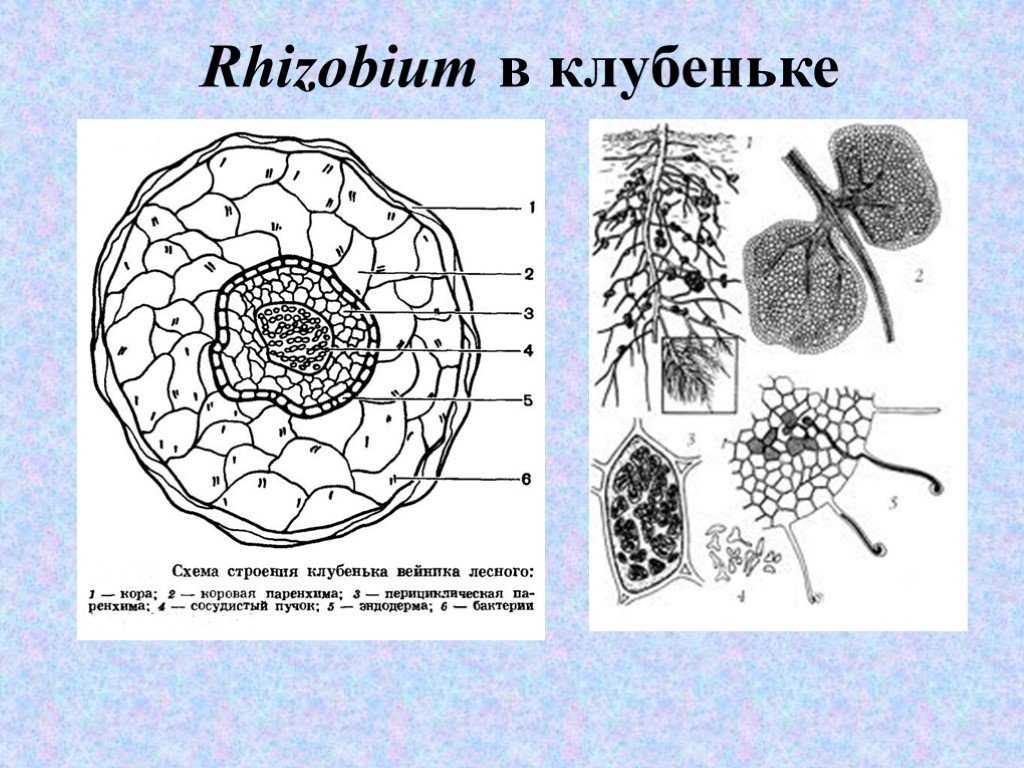
Слайд 27Rhizobium в клубеньке
Слайд 28Развитие клубеньков
В период образования бактероидов митохондрии и пластиды клетки перемещаются к клеточной оболочке и располагаются вдоль нее. В клубеньках появляется леггемоглобин – переносчик О2 к бактероидам клубеньков. Со временем клубеньки дегенерируют и отмирают из-за опробковения клеток сосудистой системы, задерживающего обмен питательными веществами между растением-хозяином и тканями клубеньков. В клетках клубеньков появляются вакуоли. Ядро перестает окрашиваться, а бактероиды лизируются, что происходит в пeриод окончания активной жизни клубеньков, обычно совпадающий с некрозом клубеньков во время окончания цветения растения-хозяина.
Слайд 29КЛУБЕНЬКИ НА КОРНЯХ
У однолетних растений клубеньки однолетние, у многолетних они функционируют в течение ряда лет. К концу сезона бактероидная ткань клубеньков многолетних растений дегенерирует, но клубеньки не отмирают и на следующий год вновь начинают функционировать.
Слайд 30Взаимоотношения между бобовыми растениями и клубеньковыми бактериями
Взаимоотношения между бобовыми растениями и клубеньковыми бактериями создаются при действии комплекса факторов (оптимальные аэрация, температура, рН; присутствие в доступной форме фосфора, калия, микроэлементов и т. д.). В нейтральных почвах (черноземах) бактерии размножаются лучше, чем в кислых. Окультуривание почв, особенно связанное с внесением органических удобрений, улучшает условия для размножения клубеньковых бактерий. В ризосфере, на клубеньках и на поверхности растений всегда имеются фаги клубеньковых бактерий. В нейтральных и слабокислых почвах фаги более многочисленны.
Слайд 31Sesbania rostrata
У тропического бобового Sesbania rostrata клубеньки образуются не только на корнях, но и на стебле и в условиях влажного и жаркого климата активно фиксируют N2.
Слайд 32СИМБИОТИЧЕСКАЯ АЗОТФИКСАЦИЯ У НЕБОБОВЫХ РАСТЕНИЙ
Клубеньки обнаружены у 200 видов из 17 родов древесных, кустарниковых и травянистых растений разных систематических групп. У деревьев и кустарников клубеньки образуются аэробными актиномицетами Frankia. Клубеньки у покрытосеменных деревьев и кустарников – многолетние и крупные. Они формируются на боковых корнях и бывают двух типов – коралловые сферические (у ольхи и облепихи) и с прорастающими через дольки клубенька корнями, направленными вверх (у восковника) - «актинориза». Клубеньки могут быть у злаковых, осоковых, лютиковых.
Frankia sрp.
Слайд 33ЛИСТОВЫЕ КЛУБЕНЬКИ
У ряда южных растений обнаружены листовые клубеньки. Из клубеньков кустарников Pavetta и Psychotria выделяются азотфиксирующие бактерии Klebsiella rubacearum. В Шри-Ланка листья Pavetta используют в качестве зеленого удобрения.
Pavetta indica Pavetta gardeniofolia Psychotria poeppigiana
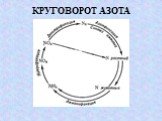
Слайд 34УЧАСТИЕ МИКРООРГАНИЗМОВ В КРУГОВОРОТЕ ВЕЩЕСТВ В ПРИРОДЕ
Нитрификация Иммобилизация азота Денитрификация
Слайд 35ОБРАЗОВАНИЕ НИТРАТОВ
NH3 + кислоты → аммонийные соли. NH3 → в атмосферу. NH3 окисляется до азотистой и азотной кислот (нитрификация). До середины XIX в. образование нитратов – химическая реакция окисления NH3 О2, почва – химический катализатор. Л. Пастер: образование нитратов – микробиологический процесс. Первые экспериментальные доказательства: Т. Шлезинг и А. Мюнц (1879).
Слайд 36НИТРИФИКАЦИЯ
С.Н. Виноградский (1890-1892) - чистые культуры нитрификаторов, которые не растут на обычных питательных средах с органическими веществами. Они – хемолитоавтотрофы. 2 группы нитрификаторов: 1-я – окисление NH3 до НNО2 (1-я фаза нитрификации), 2-я окисляет НNО2 до НNО3 – 2-я фаза нитрификации.
С.Н. Виноградский (1856-1953)
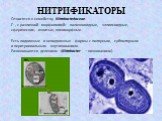
Слайд 37НИТРИФИКАТОРЫ
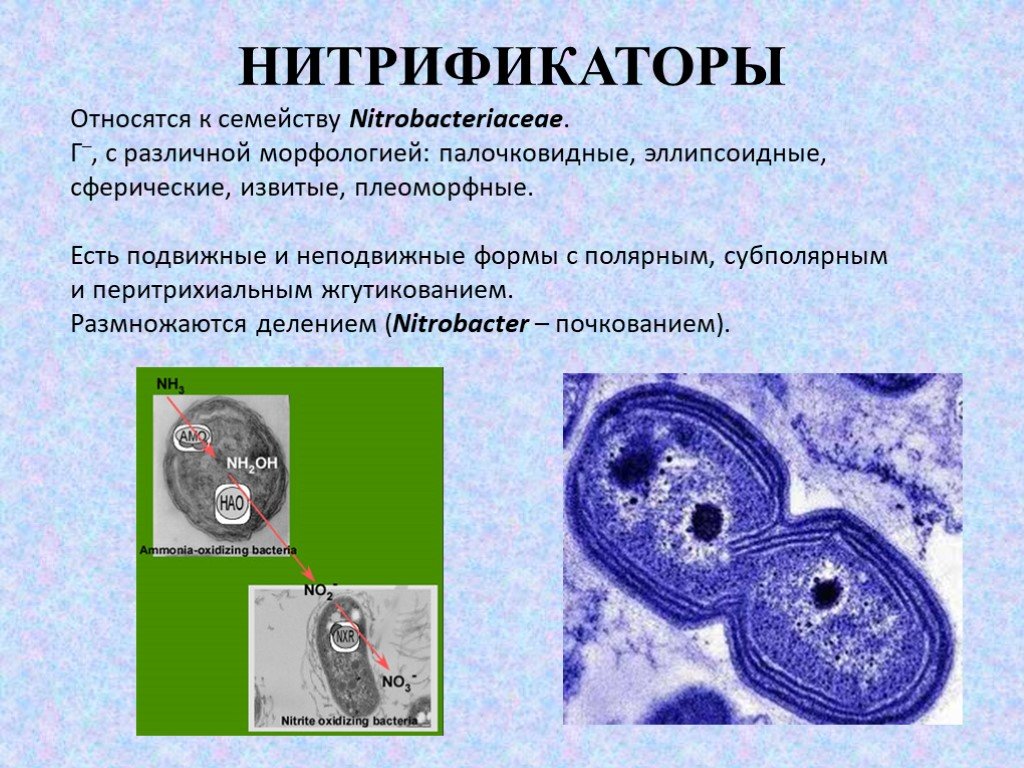
Относятся к семейству Nitrobacteriaceae. Г–, с различной морфологией: палочковидные, эллипсоидные, сферические, извитые, плеоморфные. Есть подвижные и неподвижные формы с полярным, субполярным и перитрихиальным жгутикованием. Размножаются делением (Nitrobacter – почкованием).
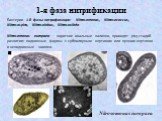
Слайд 381-я фаза нитрификации
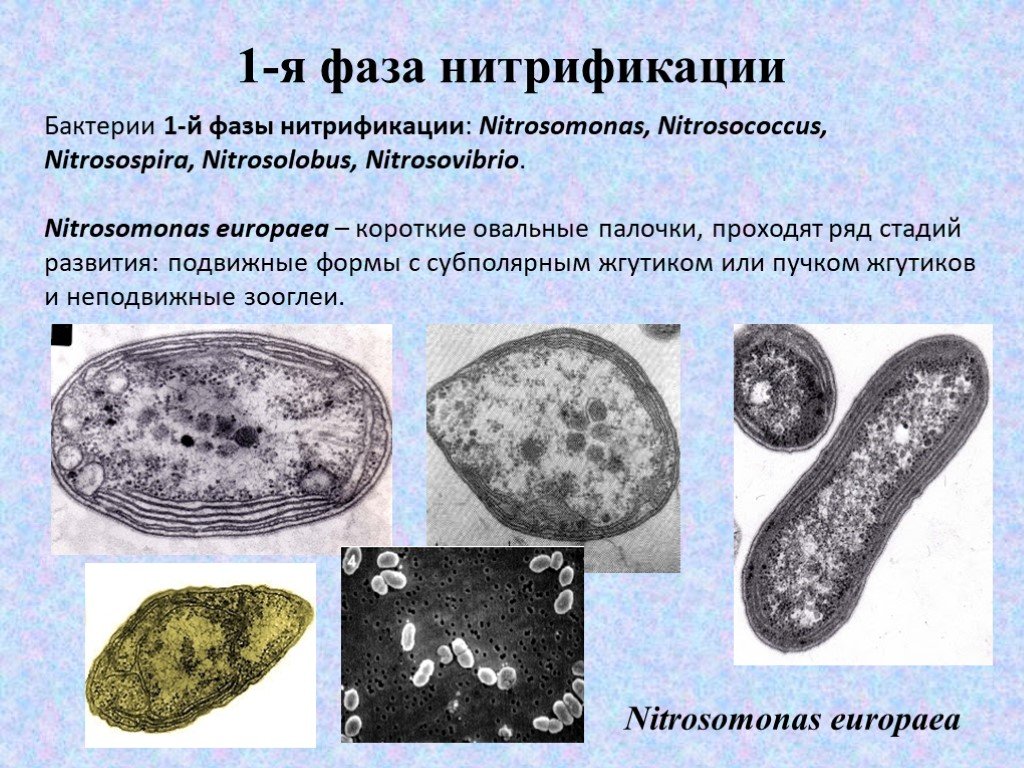
Бактерии 1-й фазы нитрификации: Nitrosomonas, Nitrosococcus, Nitrosospira, Nitrosolobus, Nitrosovibrio. Nitrosomonas europaea – короткие овальные палочки, проходят ряд стадий развития: подвижные формы с субполярным жгутиком или пучком жгутиков и неподвижные зооглеи.
Nitrosomonas europaea
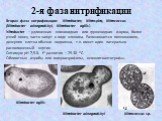
Слайд 392-я фаза нитрификации
Nitrobacter winogradskyi
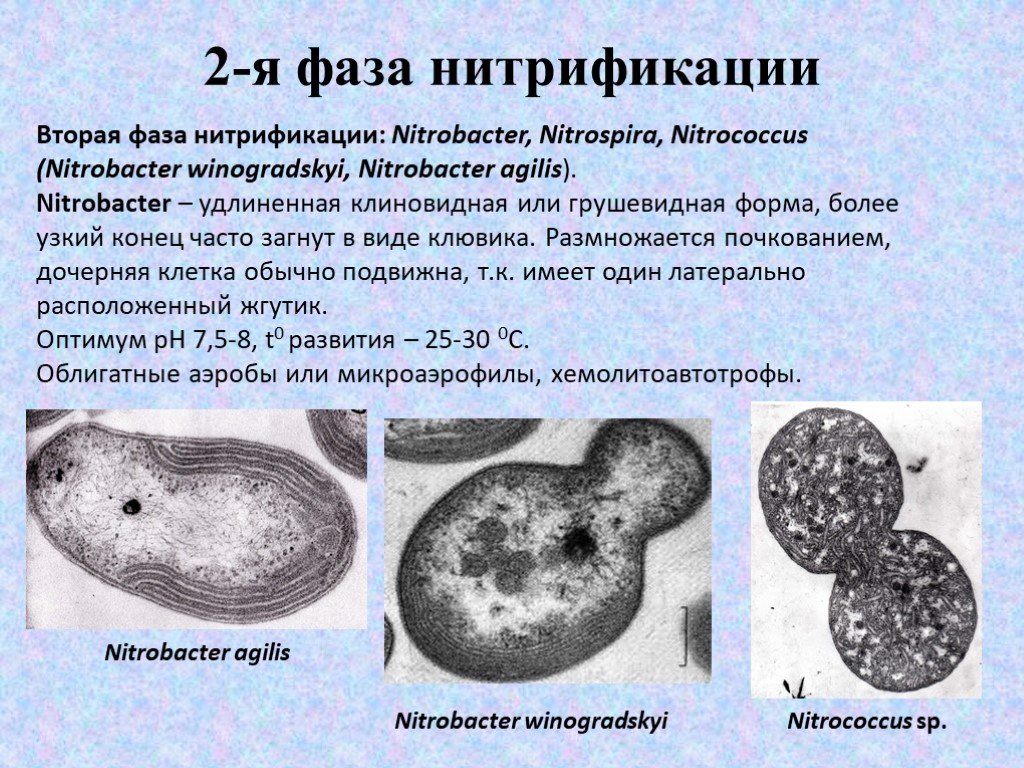
Вторая фаза нитрификации: Nitrobacter, Nitrospira, Nitrococcus (Nitrobacter winogradskyi, Nitrobacter agilis). Nitrobacter – удлиненная клиновидная или грушевидная форма, более узкий конец часто загнут в виде клювика. Размножается почкованием, дочерняя клетка обычно подвижна, т.к. имеет один латерально расположенный жгутик. Оптимум рН 7,5-8, t0 развития – 25-30 0С. Облигатные аэробы или микроаэрофилы, хемолитоавтотрофы.
Nitrobacter agilis Nitrococcus sp.
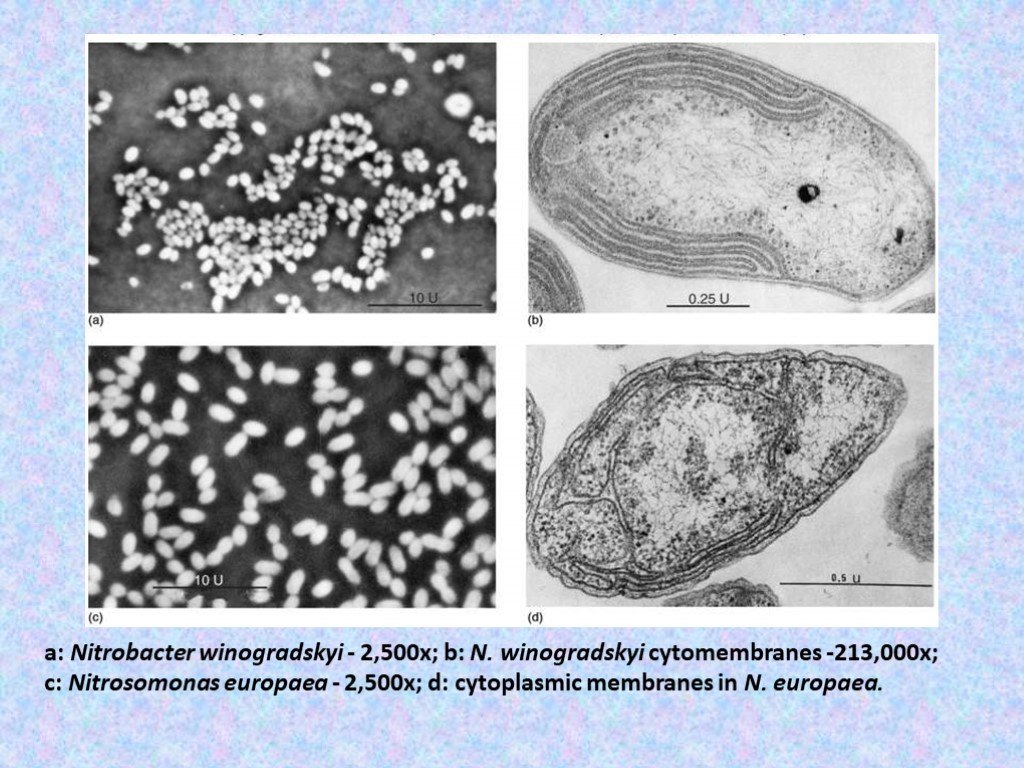
Слайд 40a: Nitrobacter winogradskyi - 2,500x; b: N. winogradskyi cytomembranes -213,000x; c: Nitrosomonas europaea - 2,500x; d: cytoplasmic membranes in N. еuropaea.
Слайд 41NH3 → NH2ОН (гидроксиламин) → NOH (нитроксил), либо ONOOH (пероксинитрит) → NO2- → NO3- Нитроксил и гидроксиламин могут димеризоваться в гипонитрит или превращаться в N2О. Нитрификация – на ЦПМ и внутрицитоплазматических мембранах. Фиксация СО2 нитрификаторами – через цикл Кальвина, в результате образуются углеводы, белки, НК, жиры. Нитрификаторы способны переключаться с автотрофного на гетеротрофное питание.
Слайд 42Этапность нитрификации – характерный пример метабиоза. Накопление нитратов – в прямой зависимости от плодородия почвы. Чем богаче почва, тем больше НNО3 она может накапливать. Интенсивность нитрификации можно использовать для характеристики агрономических свойств почвы.
Слайд 43ИСПОЛЬЗОВАНИЕ НИТРАТОВ РАСТЕНИЯМИ
NH4+ поглощается почвой, нитраты легко вымываются из нее и восстанавливаются до N2 → обедняется азотный запас почвы → существенное снижение коэффициента использования нитратов растениями. В растительном организме нитраты при их использовании для синтеза должны быть восстановлены, на что тратится энергия, NH4+ используется непосредственно.
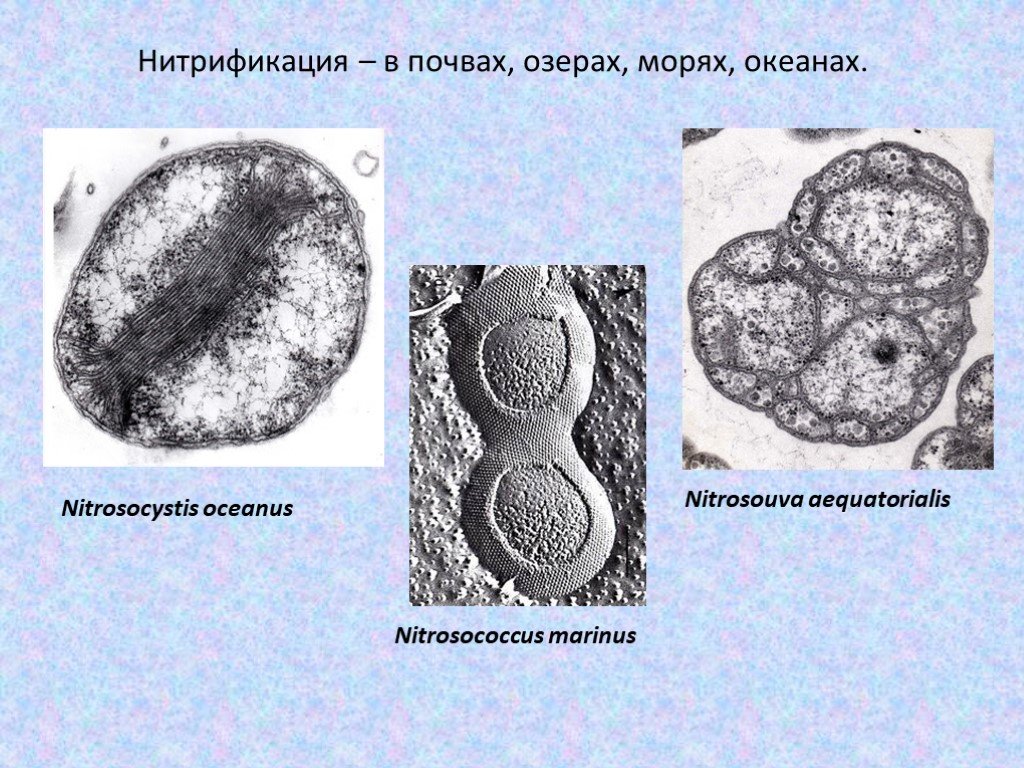
Слайд 44Нитрификация – в почвах, озерах, морях, океанах.
Nitrosocystis oceanus Nitrosococcus marinus Nitrosouva aequatorialis
Слайд 45ГЕТЕРОТРОФНАЯ НИТРИФИКАЦИЯ
Pseudomonas, Arthrobacter, Corynebacterium, Nocardia и грибы из родов Fusarium, Aspergillus, Penicillium, Cladosporium. Гетеротрофная нитрификация – в основном в атипичных условиях (при высоком содержании органических С- и N-соединений в щелочной почве). Гетеротрофные микроорганизмы могут вызывать образование и накопление токсинов; веществ, обладающих канцерогенным и мутагенным действием, а также соединений с химиотерапевтическим действием.
Слайд 46ПРЕВРАЩЕНИЯ НИТРАТОВ
они могут быть использованы высшими растениями; могут вымываться в водоемы; закрепляться в клетках микроорганизмов, которые используют нитраты в качестве источника азота; восстанавливаться микроорганизмами до N2 и NH3.
Слайд 47ИММОБИЛИЗАЦИЯ АЗОТА
Почвенные минеральные формы «N» потребляются микробами ими и переводятся в белок цитоплазмы – иммобилизация азота. Наблюдается при внесении в почву значительной массы соломы → использование «N» растениями заметно снижается → уменьшение урожая. Иммобилизация – процесс обратный минерализации. Биологически закрепленный «N» после отмирания микроорганизмов превращается в NH3.
Слайд 48СООТНОШЕНИЕ C:N
Превращение азотсодержащих соединений по пути минерализации или иммобилизации полностью определяется соотношением «N» и «С» в органическом веществе, вносимом в почву. Если субстрат имеет узкое соотношение С к N, то при его разложении накапливается NH3, т.к. микроорганизмам не хватает углеродсодержащих соединений для ассимиляции «N». Сушеная кровь животных при распаде дает много NH3 (С : N = 4,2: 1). В соломе зерновых культур С : N = 100 : 1, при внесении ее в почву – «биологическое закрепление» минерального «N».

Слайд 49СКОРОСТЬ ИММОБИЛИЗАЦИИ
Связана и с типом углеродсодержащего соединения (глюкоза вызывает более быстрое закрепление «N», чем целлюлоза или лигнин). Органические соединения с соотношением С к N = 20-25 : 1 и меньшим способствуют накоплению минеральных форм «N» в почве, а вещества с более широким соотношением этих элементов вызывают иммобилизацию азотных запасов. В среднем на каждые 100 г разложенного органического вещества (имеющего 50 г «С») микроорганизмы потребляют 2 г «N».

Слайд 50Иммобилизация для агротехники
Удобрение почвы под зерновые культуры растительными остатками, бедными «N», нежелательно → ухудшение азотного питания растений. Соломистые удобрения можно вносить в почву лишь с добавлением азотных удобрений. Осенью иммобилизация полезна, т.к. нитраты и NH3 связываются и не теряются в результате выщелачивания зимой. Весной «N», связанный в микробной клетке, ы частично минерализуется и превращается в NH3 и нитраты, которые затем могут быть использованы растениями. Таким образом, сезон года определяет полезность или вредность иммобилизации. Бобовые растения, фиксирующие в симбиозе с бактериями N2, не испытывают депрессии от внесения соломистых удобрений.

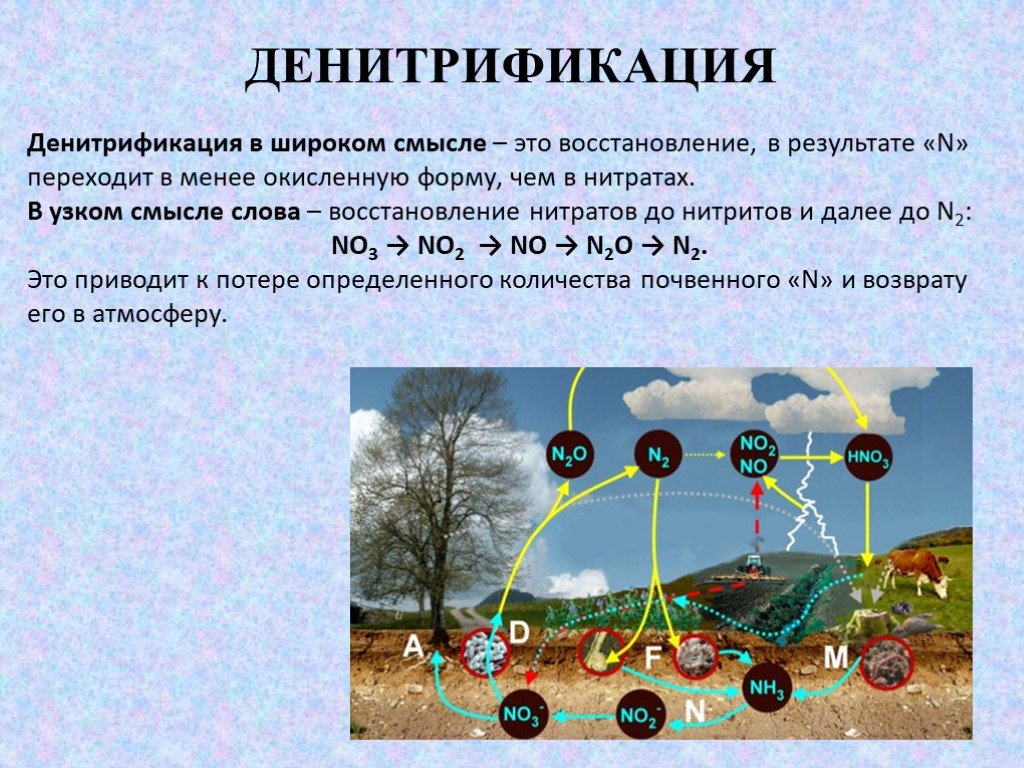
Слайд 51ДЕНИТРИФИКАЦИЯ
Денитрификация в широком смысле – это восстановление, в результате «N» переходит в менее окисленную форму, чем в нитратах. В узком смысле слова – восстановление нитратов до нитритов и далее до N2: NO3 → NO2 → NO → N2O → N2. Это приводит к потере определенного количества почвенного «N» и возврату его в атмосферу.
Слайд 52Пути денитрификациИ
2 ферментные системы денитрификации: 1) цитохромная(диссимиляционная), 2) флавопротеидная (ассимиляционная) → Пути восстановления нитратов: ассимиляционный (неспецифический) и диссимиляционный (специфический). Ассимиляционная денитрификация (нитратредукция) → образование в цитоплазме NН3, который ассимилируется организмом и включается в метаболизм. Диссимиляционная денитрификация – на мембранах для получения энергии, ее конечный продукт – N2.
Achromobacter sp.
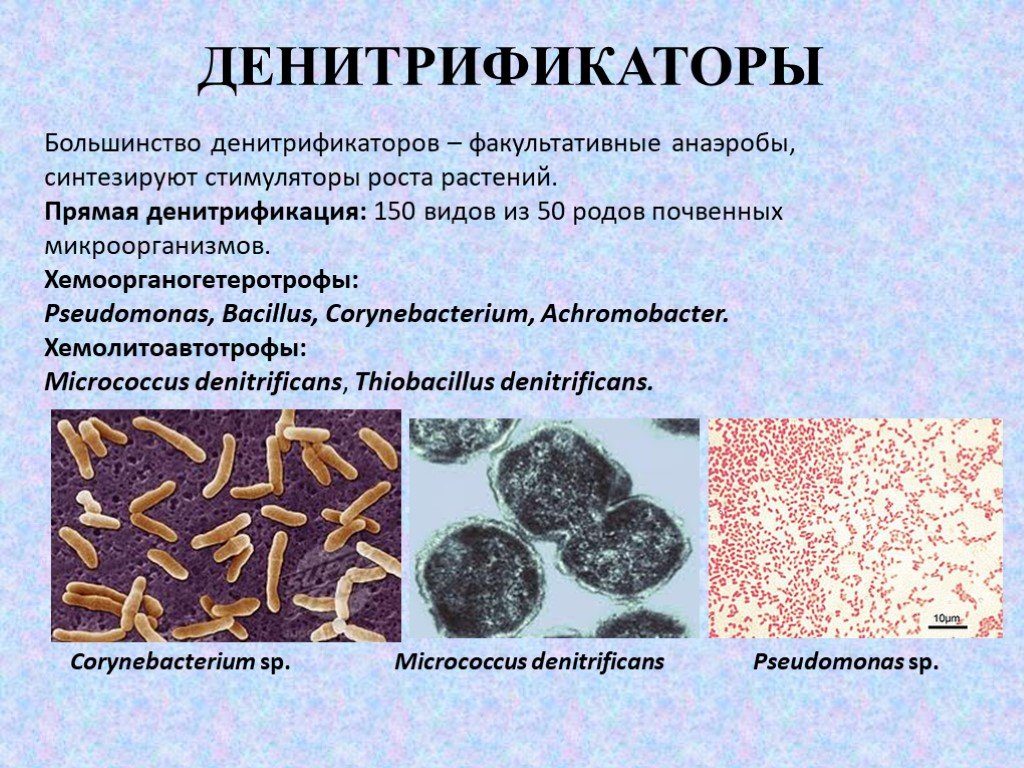
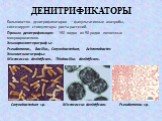
Слайд 53ДЕНИТРИФИКАТОРЫ
Большинство денитрификаторов – факультативные анаэробы, синтезируют стимуляторы роста растений. Прямая денитрификация: 150 видов из 50 родов почвенных микроорганизмов. Хемоорганогетеротрофы: Pseudomonas, Bacillus, Corynebacterium, Achromobacter. Хемолитоавтотрофы: Micrococcus denitrificans, Thiobacillus denitrificans.
Corynebacterium sp. Pseudomonas sp. Micrococcus denitrificans
Слайд 54Thiobacillus denitrificans
5S + 6KNO3 + 2Н2О = 3N2 + K2SO4 + 4KHS04 Усваивает СО2 воздуха. В отсутствие органических соединений она окисляет серу до H2SO4 за счет О2 нитратов. Полученную энергию использует для синтеза органических соединений из СО2.
Слайд 55Значение денитрификаЦИИ
Широко распространена в пресных и соленых водоемах, в различных типах почв. Основной ущерб сельскому хозяйству – диссимиляционная денитрификация → снижение запасов азота в почве и в водоемах. В результате денитрификации в атмосферу ежегодно поступает свыше 300 млн. т азота. Особенно активно денитрификация протекает в ризосфере растений, на тяжелых, сильно переувлажненных почвах, при слабой аэрации, наличии достаточного количества органических соединений Потери азотных удобрений, вносимых в почву, в результате денитрификации – от 5 до 10%. Для борьбы с денитрификацией - рыхление почвы в целях создания аэробных условий жизни денитрифицирующим бактериям..

Слайд 56КОСВЕННАЯ ДЕНИТРИФИКАЦИЯ
Косвенная денитрификация – чисто химический процесс, реакция восстановления, происходящая при взаимодействии нитритов с аминосоединениями, которые образуются в процессе жизнедеятельности различных микроорганизмов: HNO2 + R-CHNH2COOH → RCHOH-СООН + N2 + H2O. Микроорганизмам в этой реакции принадлежит косвенная роль: они образуют исходные продукты реакции – нитриты и аминосоединения. Косвенная денитрификация – только в кислой среде и ее значение невелико, т.к. окультуренные почвы не кислые. Более распространена в природе прямая денитрификация.
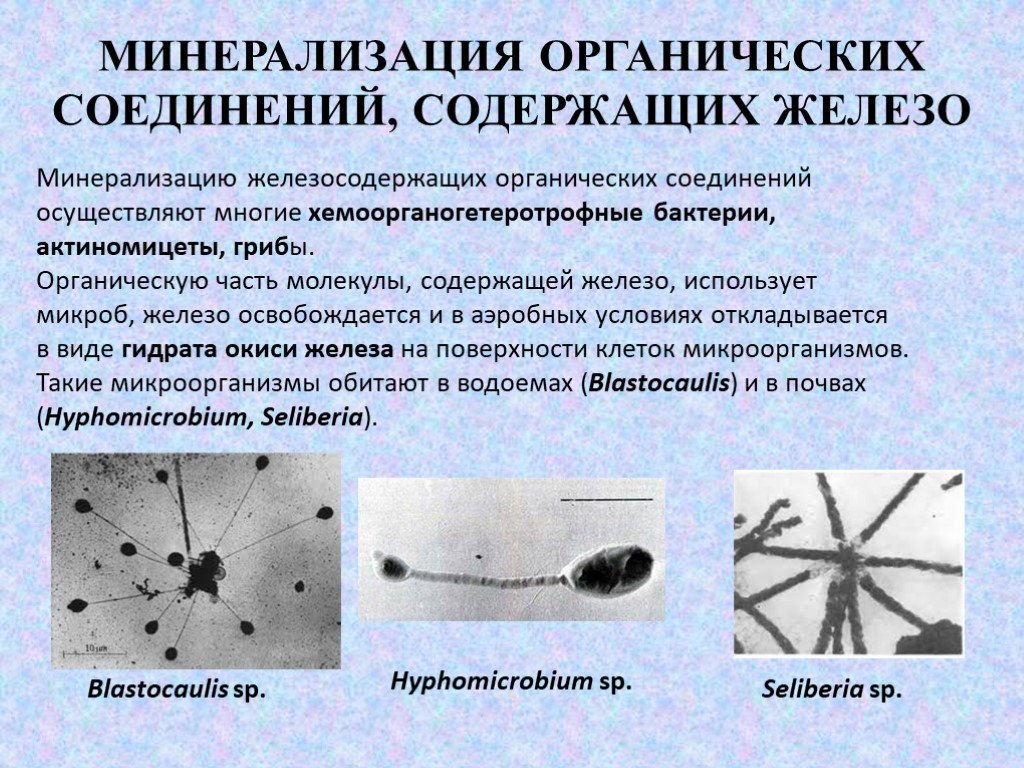
Слайд 57МИНЕРАЛИЗАЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ, СОДЕРЖАЩИХ ЖЕЛЕЗО
Железо в небольших количествах необходимо для всех существ. В почве – в виде органических и неорганических соединений. Растения усваивают неорганические растворимые соединения железа. Органические вещества, содержащие железо (каталаза, пероксидаза, цитохромы, железопорфириновые соединения), разлагаются микроорганизмами.
Слайд 58Минерализацию железосодержащих органических соединений осуществляют многие хемоорганогетеротрофные бактерии, актиномицеты, грибы. Органическую часть молекулы, содержащей железо, использует микроб, железо освобождается и в аэробных условиях откладывается в виде гидрата окиси железа на поверхности клеток микроорганизмов. Такие микроорганизмы обитают в водоемах (Blastocaulis) и в почвах (Hyphomicrobium, Seliberia).
Blastocaulis sp. Seliberia sр. Hyphomicrobium sр.
Слайд 59ЖЕЛЕЗОБАКТЕРИИ
Железобактерии, окисляющие неорганические соединения железа в болотах, ручьях, железистых источниках, озерах, дренажных трубах и других водоемах с образованием охристых осадков: нитчатые бактерии (Leptothrix, Crenothrix), Gallionella, Metallogenium.
Crenothrix sр.
Слайд 60Leptothrix
Leptothrix – нитчатые хемоорганогетеротрофные железобактерии, образующие цепочки клеток. Их боковая поверхность выделяет Fe(OH)3, который образует цилиндрический чехол, покрывающий всю цепочку. По мере утолщения чехла ограничивается доступ к клеткам закисного железа, О2 и СО2 → бактерии покидают старые чехлы, медленно выходя наружу, затем одеваются новыми чехлами. Пустые чехлы, скапливаясь, образуют охристые осадки в водоемах: 4Fе2(СО3)3 + 6Н2О + О2 = 4Fe(OH)3 + 4СО2 Leptothrix ochracea свободно плавает в воде, не прикрепляясь к субстрату, размножается поперечным делением клеток.
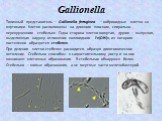
Слайд 61Gallionella
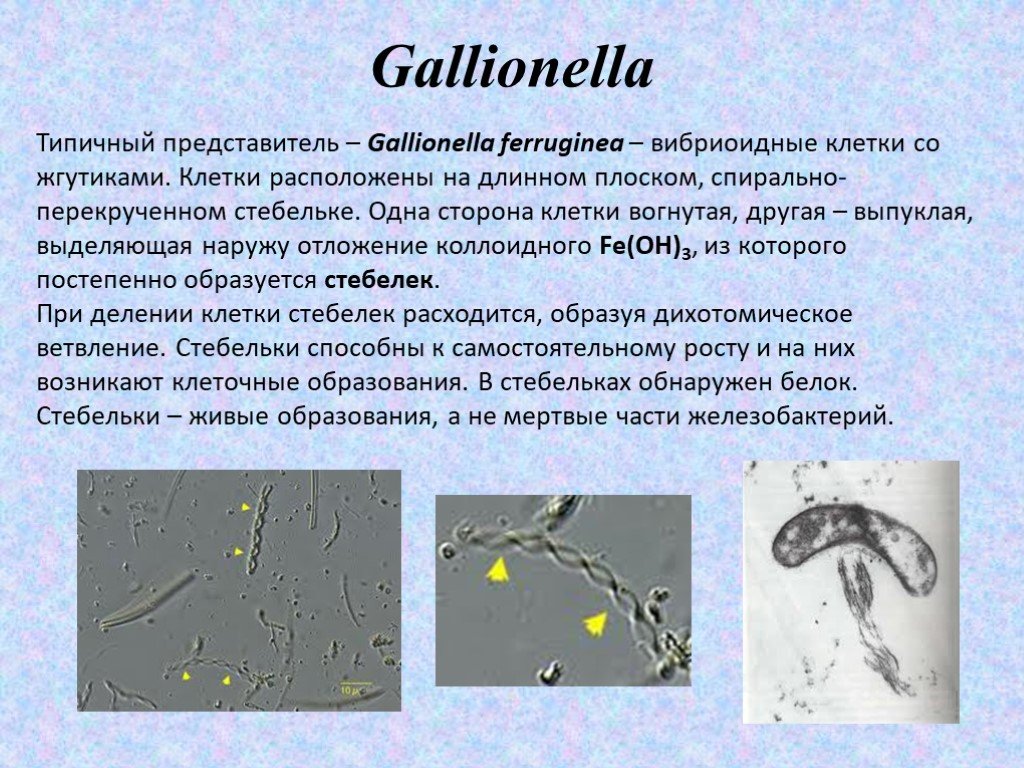
Типичный представитель – Gallionella ferruginea – вибриоидные клетки со жгутиками. Клетки расположены на длинном плоском, спирально-перекрученном стебельке. Одна сторона клетки вогнутая, другая – выпуклая, выделяющая наружу отложение коллоидного Fe(OH)3, из которого постепенно образуется стебелек. При делении клетки стебелек расходится, образуя дихотомическое ветвление. Стебельки способны к самостоятельному росту и на них возникают клеточные образования. В стебельках обнаружен белок. Стебельки – живые образования, а не мертвые части железобактерий.
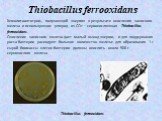
Слайд 62Thiobacillus ferrooxidans
Хемолитоавтотроф, получающий энергию в результате окисления закисного железа и использующие углерод из СО2 – сероокисляющая Thiobacillus ferrooxidans. Окисление закисного железа дает малый выход энергии, и для поддержания роста бактерии расходуют большое количество железа: для образования 1 г сырой биомассы клеток бактерии должны окислить около 500 г сернокислого железа.
Слайд 63