Слайд 1Минералогия
Краткий курс семинарских занятий
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ» Геологический факультет Кафедра минералогии, петрографии и геохимии
Слайд 2Тип простых веществ
Слайд 3В самородном состоянии в земной коре устанавливается свыше 30 химических элементов, главным образом металлов. Сюда же относятся ряд газов и редко встречающиеся элементы в жидком состоянии (ртуть, некоторые амальгамы).
Общее весовое значение самородных элементов в земной коре не превышает 0,1% всей массы земной коры). Из этого количества на долю азота приходится около 0,04%, кислорода - 0,01-0,02%. Все остальные элементы, встречающиеся в самородном виде, составляют не больше 0,05%. Из них в наибольших относительных количествах представлены: водород, аргон, гелий, углерод, сера, золото, элементы платиновой группы, медь и висмут.
Выделяют: Класс самородных металлов Класс самородных неметаллов Класс полуметаллов Кристаллизуются в 3х типах структур: Координационный Слоистый Цепочечно-кольцевой

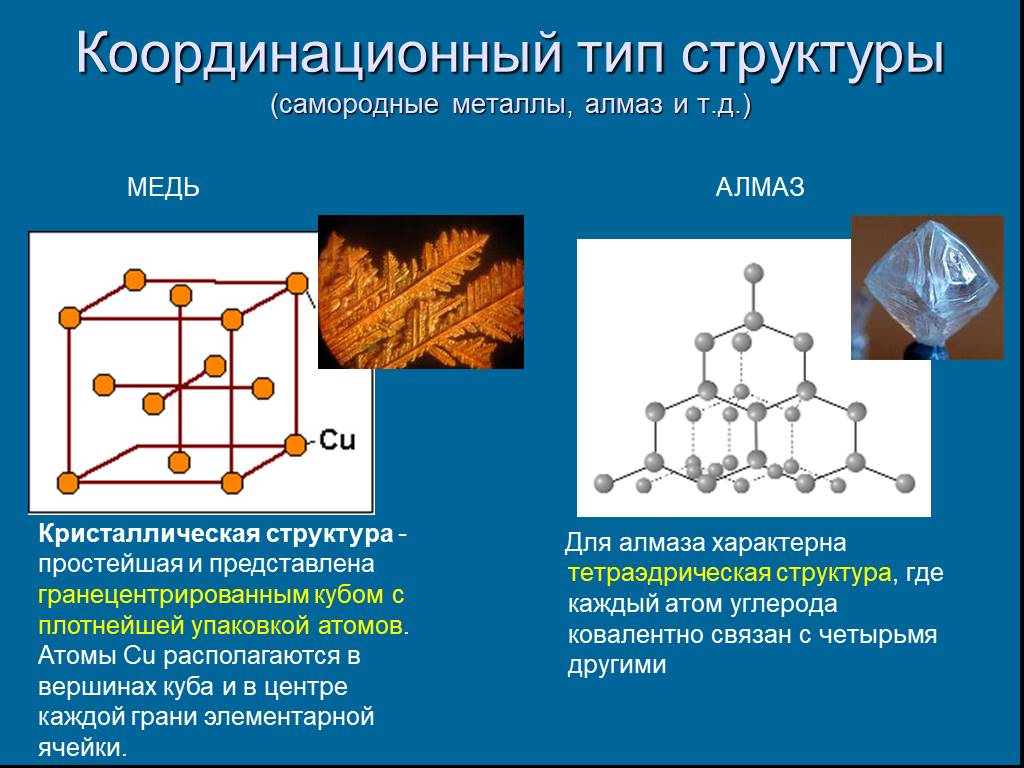
Слайд 4Для алмаза характерна тетраэдрическая структура, где каждый атом углерода ковалентно связан с четырьмя другими
Координационный тип структуры (самородные металлы, алмаз и т.д.)
АЛМАЗ МЕДЬ
Кристаллическая структура - простейшая и представлена гранецентрированным кубом с плотнейшей упаковкой атомов. Атомы Сu располагаются в вершинах куба и в центре каждой грани элементарной ячейки.
Слайд 5Слоистый тип структуры (графит)
Ионы углерода в графите лежат листами, представленными плоскими гексагональными сетками. Каждый ион в плоской сетке окружен тремя соседними ионами на расстоянии 1,42Å (в алмазе 1,54Å), расстояние же между плоскими сетками 3,40Å, т. е. в два раза больше. Отсюда становится понятным ряд свойств графита: его значительно меньший удельный вес по сравнению с алмазом, чрезвычайно легкая расщепляемость на тонкие чешуйки, резко выраженная оптическая анизотропия

Слайд 6Цепочечно-кольцевой тип структуры (сера)
Ромбическая сера обладает редкой для неорганических соединений молекулярной, и притом очень сложной, решеткой. В кристаллической структуре каждый атом серы с двух сторон имеет сферы, пересекающиеся со сферами соседних атомов, причем цепочки, состоящие из 8 атомов, замкнуты в виде зигзагообразно "сморщенного" кольца. Отсюда видно, что молекула серы S8. Расстояние между
Вид сверху и сбоку восьмиатомного кольца (молекулы) серы
атомами S-S равно 2,12 Å. Элементарная ячейка сложена 16 такими электрически нейтральными молекулами (кольцами), очень слабо связанными друг с другом вандерваальсовской связью.
Слайд 7Тип сульфиды, сульфосоли и им подобные соединения
Слайд 8К рассматриваемому разделу относятся следующие соединения металлов: Сернистые (сульфиды и сульфосоли), селенистые, теллуристые, мышьяковистые сурьмянистые Соединения с S играют существенную роль в составе многочисленных месторождений металлических полезных ископаемых. Общее весовое количество сернистых соединений, по приблизительному подсчету В. И. Вернадского, составляет максимум 0,15% (к весу земной коры) Главенствующее значение в этих соединениях имеет Fe. Сернистые соединения всех остальных элементов, не считая сероводорода, в весовом отношении в земной коре составляют ничтожный процент (около 0,001%). Типичные соединения с серой образуют: Zn, Pb, Сu, Ag, Sb, Bi, Ni, Co, Mo и Hg.

Слайд 9Общее количество химических элементов, дающих в том или ином виде соединения с серой, достигает 40. Главнейшие из них следующие: Н, V, Мn, Fe, Ni, Со, Сu, Zn, (Ga), Ge, As, Mo, Ru, (Rh), (Pd), Ag, Cd, (In), Sn, Sb (Re), (Os), (Ir), Pt, Hg, Tl, Pb и Bi. В скобках показаны элементы, не дающие самостоятельных сернистых соединений, а встречающиеся лишь в виде изоморфных примесей. Селенистые соединения (селениды) известны для: Н, Сu, Ag, Hg, Pb и Bi. Кроме того, селен нередко присутствует в сернистых соединениях в виде изоморфной примеси к сере. Теллуристые соединения (теллуриды) по сравнению с селенидами пользуются в природе более широким распространением: Сu, Ag, Au, Hg, Pb, Bi, Ni, Pt. Все они образуют самостоятельные минералы. Мышьяковистые простые соединения (арсениды) установлены для: Fe, Ni, Со и Pt. Более широко распространены сложные соединения в виде сульфосолей-сульфоарсенитов, главным образом для следующих металлов: Сu, Ag и Pb. Сурьмянистые простые соединения (антимониды) известны лишь для Ni. Зато часто устанавливаются сложные соединения - сульфоантимониты Сu, Ag и Pb. Висмутистые простые соединения в природе не известны. Наблюдаются лишь сульфовисмутиты Сu, Ag и Pb.
![Класс моносульфиды (низшие) – производные H2S Класс дисульфиды (персульфиды или высшие) - производные H2S2 Класс сульфосоли – производные тиокислот (тиомышьяковистой H3[AsS3], тиосурьмянистой H3[SbS3] и тиовисмутистой H3[BiS3] ). Свойства Характерен широкий изоморфизм между элементами Наличие структ Класс моносульфиды (низшие) – производные H2S Класс дисульфиды (персульфиды или высшие) - производные H2S2 Класс сульфосоли – производные тиокислот (тиомышьяковистой H3[AsS3], тиосурьмянистой H3[SbS3] и тиовисмутистой H3[BiS3] ). Свойства Характерен широкий изоморфизм между элементами Наличие структ](https://prezentacii.org/upload/cloud/19/03/131681/images/thumbs/screen10.jpg)
Слайд 10Класс моносульфиды (низшие) – производные H2S Класс дисульфиды (персульфиды или высшие) - производные H2S2 Класс сульфосоли – производные тиокислот (тиомышьяковистой H3[AsS3], тиосурьмянистой H3[SbS3] и тиовисмутистой H3[BiS3] )
Свойства Характерен широкий изоморфизм между элементами Наличие структур распада твердых растворов Большое количество типов структур: Координационная - Дефектная - Островная Ленточная Слоистая

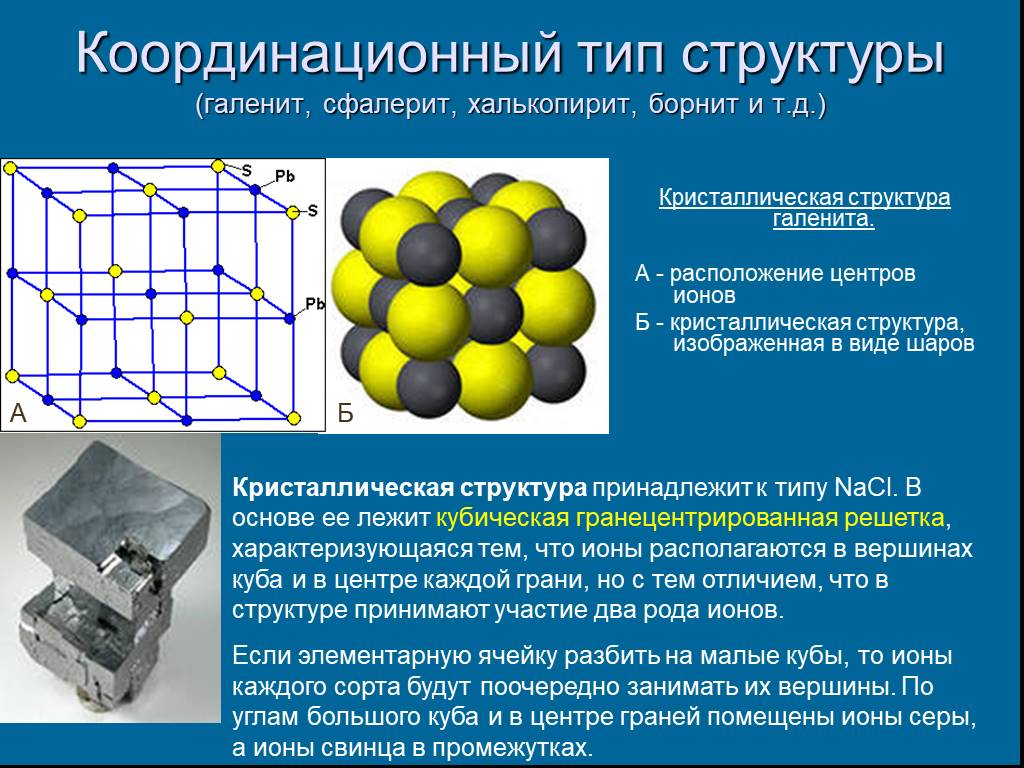
Слайд 11Координационный тип структуры (галенит, сфалерит, халькопирит, борнит и т.д.)
Кристаллическая структура галенита. А - расположение центров ионов Б - кристаллическая структура, изображенная в виде шаров
Кристаллическая структура принадлежит к типу NaCl. В основе ее лежит кубическая гранецентрированная решетка, характеризующаяся тем, что ионы располагаются в вершинах куба и в центре каждой грани, но с тем отличием, что в структуре принимают участие два рода ионов. Если элементарную ячейку разбить на малые кубы, то ионы каждого сорта будут поочередно занимать их вершины. По углам большого куба и в центре граней помещены ионы серы, а ионы свинца в промежутках.
А Б

Слайд 12«Дефектный» тип структуры (пирротин)
Кристаллическая структура имеет плотнейшую гексагональную упаковку из атомов S. Структура дефектна, т.к. не все октаэдрические пустоты заняты Fe, в силу чего часть Fe2+ перешла в Fe3+. Структурный дефицит Fe в пирротине различен: даёт составы от Fe0,875S (Fe7S8) до FeS (стехиометрический состав FeS — троилит). В зависимости от дефицита Fe меняются параметры и симметрия кристаллической ячейки, и при x~ 0,11 и ниже (до 0,2) пирротин из гексагональной модификации переходит в моноклинную.
Магнитные свойства меняются в зависимости от состава: гексагональные (бедные S) пирротины — парамагнитны, моноклинные (богатые S) — ферромагнитны. Отдельные минералы пирротина обладают особой магнитной анизотропией — парамагнетизмом в одном направлении и ферромагнетизмом в другом, перпендикулярном первому.
![Островной тип структуры (пирит, марказит, кобальтин, арсенопирит и т.д.). В основе лежит кубическая гранецентрированная решетка, в которой ионы серы, располагаясь парами, сильно сближены между собой с образованием анионной группы [S2]2-. ПИРИТ МАРКАЗИТ. В структуре ромбической модификации FeS2 - те Островной тип структуры (пирит, марказит, кобальтин, арсенопирит и т.д.). В основе лежит кубическая гранецентрированная решетка, в которой ионы серы, располагаясь парами, сильно сближены между собой с образованием анионной группы [S2]2-. ПИРИТ МАРКАЗИТ. В структуре ромбической модификации FeS2 - те](https://prezentacii.org/upload/cloud/19/03/131681/images/thumbs/screen13.jpg)
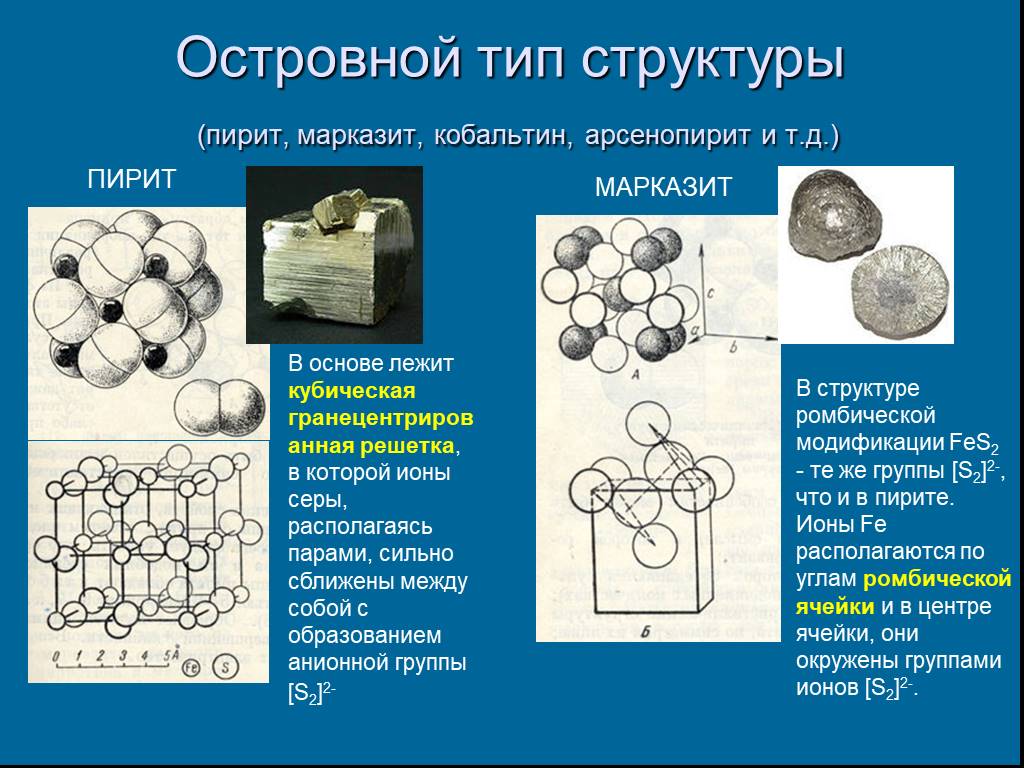
Слайд 13Островной тип структуры (пирит, марказит, кобальтин, арсенопирит и т.д.)
В основе лежит кубическая гранецентрированная решетка, в которой ионы серы, располагаясь парами, сильно сближены между собой с образованием анионной группы [S2]2-
ПИРИТ МАРКАЗИТ
В структуре ромбической модификации FeS2 - те же группы [S2]2-, что и в пирите. Ионы Fe располагаются по углам ромбической ячейки и в центре ячейки, они окружены группами ионов [S2]2-.
Слайд 14Ленточный (цепочечный) тип структуры (антимонит, буланжерит, киноварь и т.д.)
Слайд 15Слоистый тип структуры (молибденит, аурипигмент и т.д.)
Листы ионов Мо располагаются между двумя листами ионов S. Ионы в листах соединены сильными связями, но силы сцепления между "тройными" листами резко ослаблены, чем и обусловлена совершенная спайность кристаллов. Нагляднее можно представить в виде чередующихся тригональных слоев призм с ионами Мо в центрах с пустыми слоями из октаэдров.
МОЛИБДЕНИТ
Слайд 16Тип кислородных соединений
Это соединения катионов с кислородом (О2-) или гидроокислом ([ОН]1-), а также различными радикалами ([SO4]2-, [CO]32-, [PO4]33- и т.д.), в состав которых входит кислород.
Слайд 17Класс окислов и гидроокислов
Среднее весовое содержание кислорода в земной коре составляет 49,13% В простейшие соединения с кислородом в том или ином виде входит около 40 элементов Общее весовое количество свободных окислов в литосфере (за исключением гидросферы и атмосферы) составляет около 17%. Из них на долю одного только кремнезема SiO2 приходится 12,6%. Окислы и гидроокислы железа составляют 3,9%. Из остальных наибольшее значение имеют окислы и гидроокислы Al, Mn, Ti и Cr. Все относящиеся к настоящему разделу минералы принято делить на: безводные окислы гидроокислы или окислы, содержащие гидроксил и водородные ионы.
Выделяют: Подкласс простых окислов MemOn Подкласс сложных окислов Me’mMe’’xOn Подкласс гидроокислов Mem(OH)n

Слайд 18Для класса оксидов и гидроксидов характерно: Изоморфизм (В группе шпинели широко представлены изоморфные смеси. В качестве трехвалентных металлов, замещающих друг друга, принимают участие: Fe3+, Аl3+,Сr3+ и Мn3+, а в качестве двухвалентных - главным образом Mg2+, Fe2+, иногда Zn2+, Mn2+ и изредка, обычно в небольших количествах, Ni2+ и Со2+ Полиморфизм (модификации SiO2 (тридимит, кристобалит, китит, коусит, стишовит) и TiO2 (рутил, анатаз, брукит) Твердые растворы первого рода (магнетит-гематит, магнетит-ильменит) Происхождение: Эндогенное (магматическое, гидротермальное, скарновое и т.д.) – 50% Экзогенное – 40% Метаморфическое – около 10%

Слайд 19В кристаллических структурах этих соединений катионы всегда находятся в окружении анионов кислорода (или гидроксила).
Главнейшие катионы и их координационные числа в природных окислах
А - тетраэдр, поставленный на ребро; вершины его являются центрами ионов кислорода в тетраэдрической группе SiО4 (Б), внутри которой располагается ион Si4+
Особенности кристаллического строения

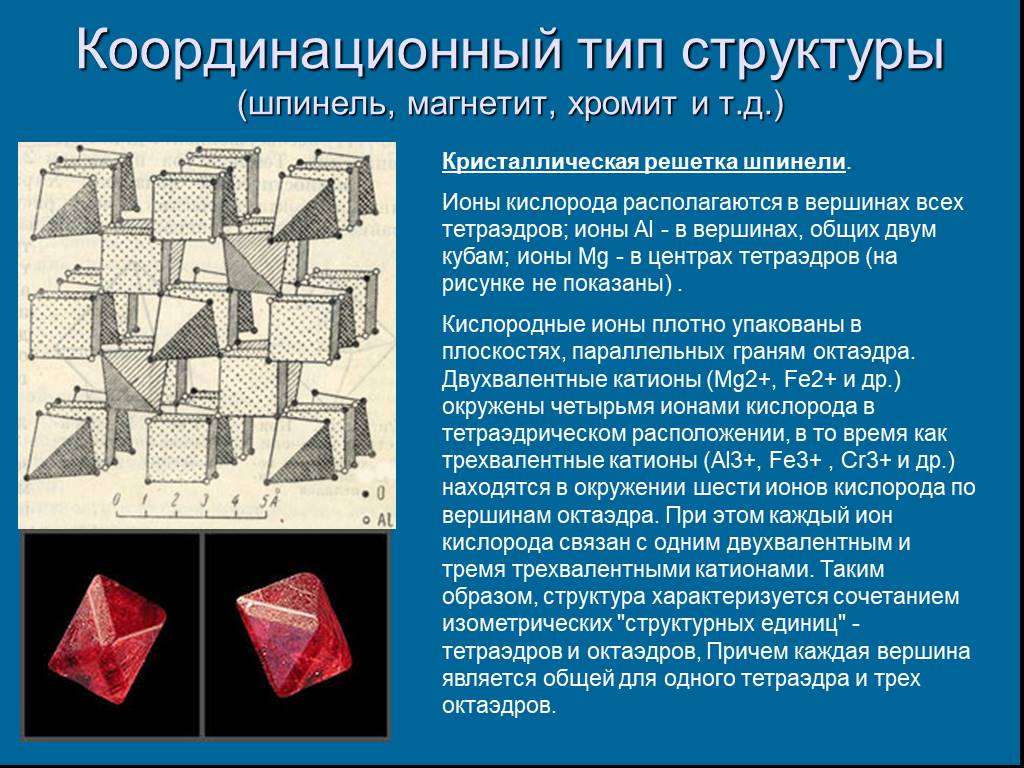
Слайд 20Координационный тип структуры (шпинель, магнетит, хромит и т.д.)
Кристаллическая решетка шпинели. Ионы кислорода располагаются в вершинах всех тетраэдров; ионы Аl - в вершинах, общих двум кубам; ионы Mg - в центрах тетраэдров (на рисунке не показаны) . Кислородные ионы плотно упакованы в плоскостях, параллельных граням октаэдра. Двухвалентные катионы (Mg2+, Fe2+ и др.) окружены четырьмя ионами кислорода в тетраэдрическом расположении, в то время как трехвалентные катионы (Al3+, Fe3+ , Сr3+ и др.) находятся в окружении шести ионов кислорода по вершинам октаэдра. При этом каждый ион кислорода связан с одним двухвалентным и тремя трехвалентными катионами. Таким образом, структура характеризуется сочетанием изометрических "структурных единиц" - тетраэдров и октаэдров, Причем каждая вершина является общей для одного тетраэдра и трех октаэдров.

Слайд 21Каркасный тип структуры (кварц)
Так как каждый ион кислорода является общим для двух смежных тетраэдров SiO4, то он всюду располагается между двумя ионами кремния, тогда как каждый ион Si4+ находится в четверной координации ионов кислорода.
Кристаллическая структура кварца, как и других полиморфных модификаций, характеризуется той особенностью, что ион Si4+ всегда находится в четверном окружении ионов O2-, расположенных по вершинам тетраэдра. Каждая вершина такого тетраэдра одновременно служит вершиной другого смежного тетраэдра.
Таким образом, кристаллические решетки этих минералов состоят как бы из каркасов сцепленных друг с другом тетраэдров. Способ сцепления во всех модификациях один и тот же (через вершины тетраэдров), но ориентировка и общая симметрия в расположении их различны. В целом упаковка ионов кислорода не плотная: в каркасах имеются "пустотки" между тетраэдрами. В низкотемпературных модификациях они обладают малыми размерами, а в высокотемпературных, более "рыхло" построенных модификациях они крупнее. В прямой зависимости от этого находятся и удельные веса, а также показатели преломления.

Слайд 22Полиморфные модификации SiO2
Структуры и кристаллы некоторых полиморфных модификаций кремнезема. а—кварц тригональный и гексагональный; 6—тридимит; в — коэсит.
Четыре главные формы: кварц, тридимит, кристобалит и коэсит. Наиболее высоко барическая модификация кремнезема — стишовит, образующийся при ударах метеоритов о земную поверхность. Также существует также гидратированный кремнезем — опал SiO2 . nH2O.
Кривые упругости паров различных модификаций показаны схематически. При каждой данной температуре более устойчива та модификация, у которой упругость пара меньше (т. е. кривая ближе к оси ординат)
Установлен следующий ряд энантиотропных превращений: α-кварц →← β-кварц →← β-тридимит→← α-кристобалит →← расплав. 573 °С 870 °С 1470 °С 1713 °С
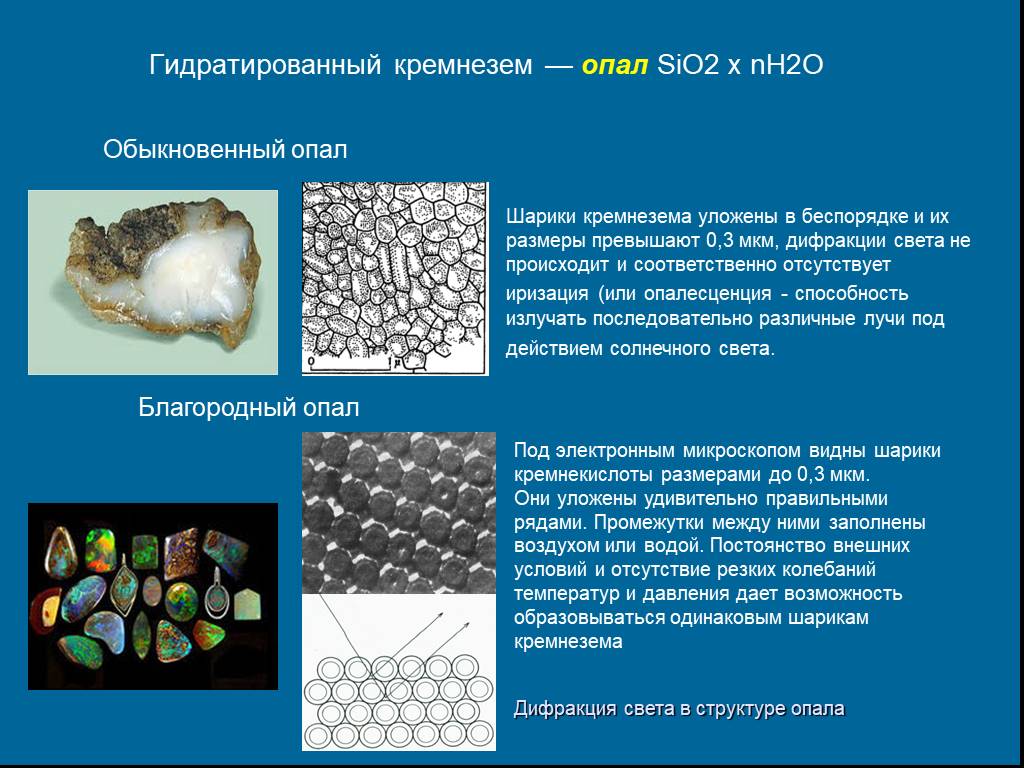
Слайд 23Гидратированный кремнезем — опал SiO2 х nH2O
Шарики кремнезема уложены в беспорядке и их размеры превышают 0,3 мкм, дифракции света не происходит и соответственно отсутствует иризация (или опалесценция - способность излучать последовательно различные лучи под действием солнечного света.
Обыкновенный опал
Под электронным микроскопом видны шарики кремнекислоты размерами до 0,3 мкм. Они уложены удивительно правильными рядами. Промежутки между ними заполнены воздухом или водой. Постоянство внешних условий и отсутствие резких колебаний температур и давления дает возможность образовываться одинаковым шарикам кремнезема
Дифракция света в структуре опала
Благородный опал

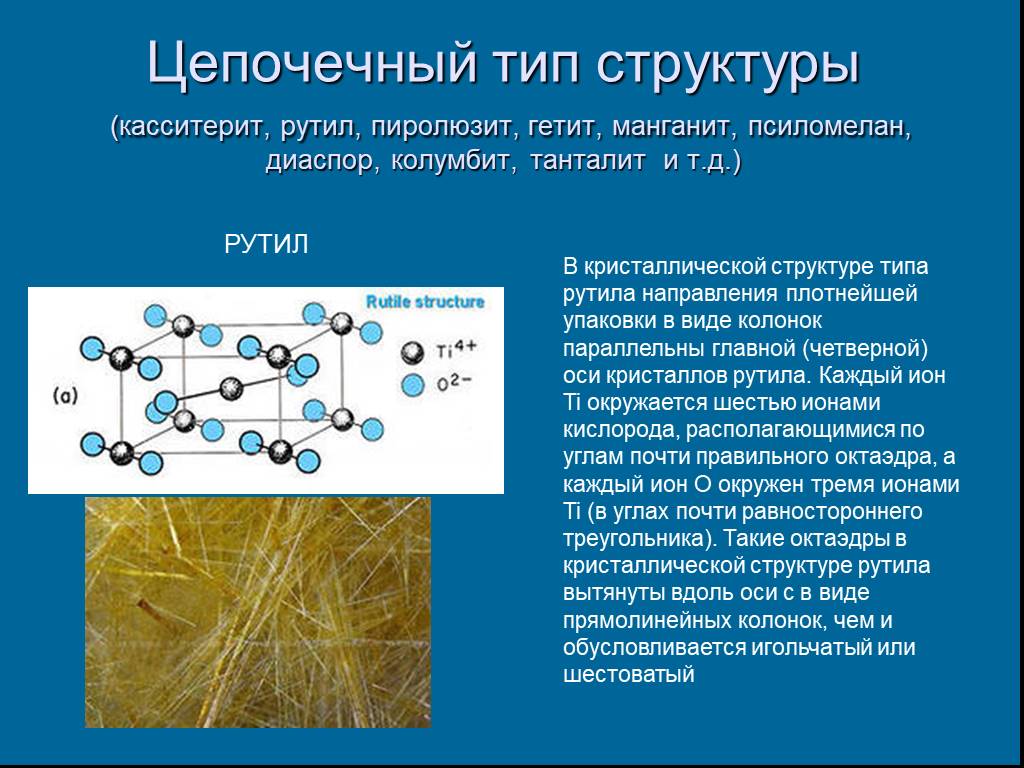
Слайд 24Цепочечный тип структуры (касситерит, рутил, пиролюзит, гетит, манганит, псиломелан, диаспор, колумбит, танталит и т.д.)
РУТИЛ
В кристаллической структуре типа рутила направления плотнейшей упаковки в виде колонок параллельны главной (четверной) оси кристаллов рутила. Каждый ион Ti окружается шестью ионами кислорода, располагающимися по углам почти правильного октаэдра, а каждый ион О окружен тремя ионами Ti (в углах почти равностороннего треугольника). Такие октаэдры в кристаллической структуре рутила вытянуты вдоль оси с в виде прямолинейных колонок, чем и обусловливается игольчатый или шестоватый
![Слоистый тип структуры (лепидокрокит, бемит, гидраргиллит, брусит и т.д.). В качестве аниона участвует дипольная гидроксильная группа [ОН]1- с радиусом иона 1,40 Å. В кристаллической структуре эти группы уложены по принципу плотнейшей гексагональной упаковки. Каждый слой состоит из двух плоских лист Слоистый тип структуры (лепидокрокит, бемит, гидраргиллит, брусит и т.д.). В качестве аниона участвует дипольная гидроксильная группа [ОН]1- с радиусом иона 1,40 Å. В кристаллической структуре эти группы уложены по принципу плотнейшей гексагональной упаковки. Каждый слой состоит из двух плоских лист](https://prezentacii.org/upload/cloud/19/03/131681/images/thumbs/screen25.jpg)
Слайд 25Слоистый тип структуры (лепидокрокит, бемит, гидраргиллит, брусит и т.д.)
В качестве аниона участвует дипольная гидроксильная группа [ОН]1- с радиусом иона 1,40 Å. В кристаллической структуре эти группы уложены по принципу плотнейшей гексагональной упаковки. Каждый слой состоит из двух плоских листов, сложенных ионами гидроксила параллельно плоскости (0001). Между этими листами лежит лист из катионов Mg2+. Последние занимают все октаэдрические пустоты между двумя листами ОН, т. е. каждый ион Mg располагается между шестью гидроксильными анионами, будучи связан с тремя ионами [ОН]1- одного листа и тремя ионами [ОН]1-другого листа.
БРУСИТ
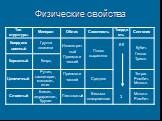
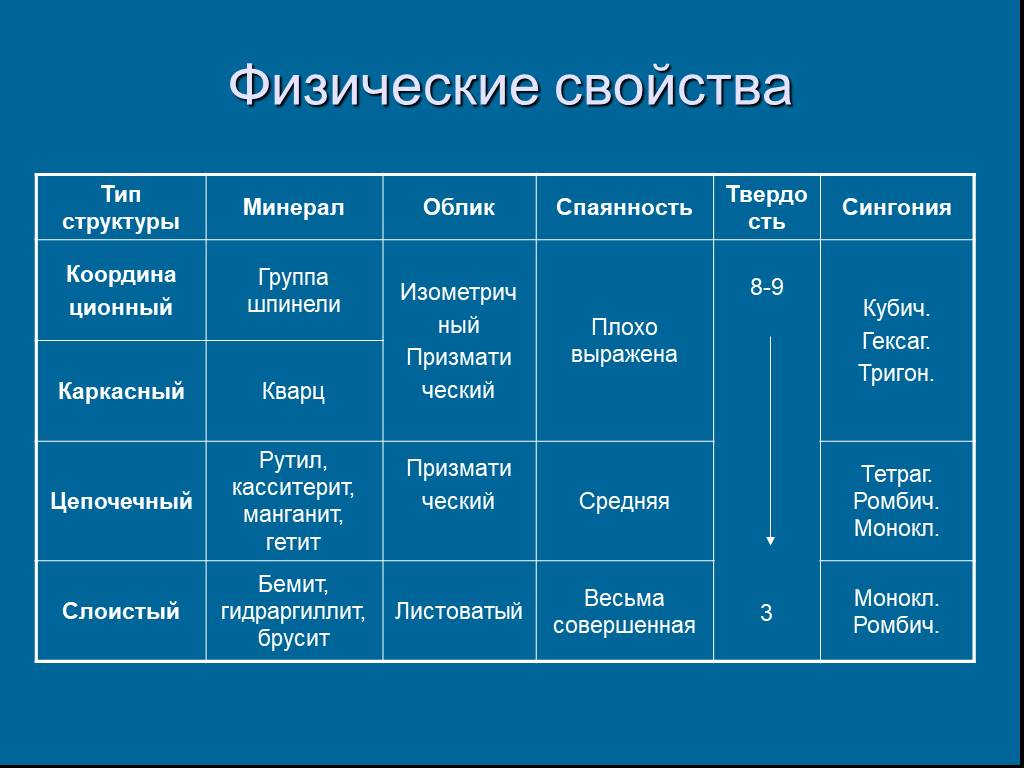
Слайд 26Физические свойства



















































![Класс моносульфиды (низшие) – производные H2S Класс дисульфиды (персульфиды или высшие) - производные H2S2 Класс сульфосоли – производные тиокислот (тиомышьяковистой H3[AsS3], тиосурьмянистой H3[SbS3] и тиовисмутистой H3[BiS3] ). Свойства Характерен широкий изоморфизм между элементами Наличие структ Класс моносульфиды (низшие) – производные H2S Класс дисульфиды (персульфиды или высшие) - производные H2S2 Класс сульфосоли – производные тиокислот (тиомышьяковистой H3[AsS3], тиосурьмянистой H3[SbS3] и тиовисмутистой H3[BiS3] ). Свойства Характерен широкий изоморфизм между элементами Наличие структ](https://prezentacii.org/upload/cloud/19/03/131681/images/thumbs/screen10.jpg)


![Островной тип структуры (пирит, марказит, кобальтин, арсенопирит и т.д.). В основе лежит кубическая гранецентрированная решетка, в которой ионы серы, располагаясь парами, сильно сближены между собой с образованием анионной группы [S2]2-. ПИРИТ МАРКАЗИТ. В структуре ромбической модификации FeS2 - те Островной тип структуры (пирит, марказит, кобальтин, арсенопирит и т.д.). В основе лежит кубическая гранецентрированная решетка, в которой ионы серы, располагаясь парами, сильно сближены между собой с образованием анионной группы [S2]2-. ПИРИТ МАРКАЗИТ. В структуре ромбической модификации FeS2 - те](https://prezentacii.org/upload/cloud/19/03/131681/images/thumbs/screen13.jpg)


![Тип кислородных соединений. Это соединения катионов с кислородом (О2-) или гидроокислом ([ОН]1-), а также различными радикалами ([SO4]2-, [CO]32-, [PO4]33- и т.д.), в состав которых входит кислород. Тип кислородных соединений. Это соединения катионов с кислородом (О2-) или гидроокислом ([ОН]1-), а также различными радикалами ([SO4]2-, [CO]32-, [PO4]33- и т.д.), в состав которых входит кислород.](https://prezentacii.org/upload/cloud/19/03/131681/images/thumbs/screen16.jpg)








![Слоистый тип структуры (лепидокрокит, бемит, гидраргиллит, брусит и т.д.). В качестве аниона участвует дипольная гидроксильная группа [ОН]1- с радиусом иона 1,40 Å. В кристаллической структуре эти группы уложены по принципу плотнейшей гексагональной упаковки. Каждый слой состоит из двух плоских лист Слоистый тип структуры (лепидокрокит, бемит, гидраргиллит, брусит и т.д.). В качестве аниона участвует дипольная гидроксильная группа [ОН]1- с радиусом иона 1,40 Å. В кристаллической структуре эти группы уложены по принципу плотнейшей гексагональной упаковки. Каждый слой состоит из двух плоских лист](https://prezentacii.org/upload/cloud/19/03/131681/images/thumbs/screen25.jpg)