Слайд 1как вода становится льдом, как рождаются снежинки почему лёд скользкий как “работают” антифризы
14 октября 2006 года
Слайд 2вспоминаем то, что было: кость - композиционный материал что такое твёрдость эластичность и закон Гука что такое прочность почему кости внутри полые почему горы на Земле не выше 10 км
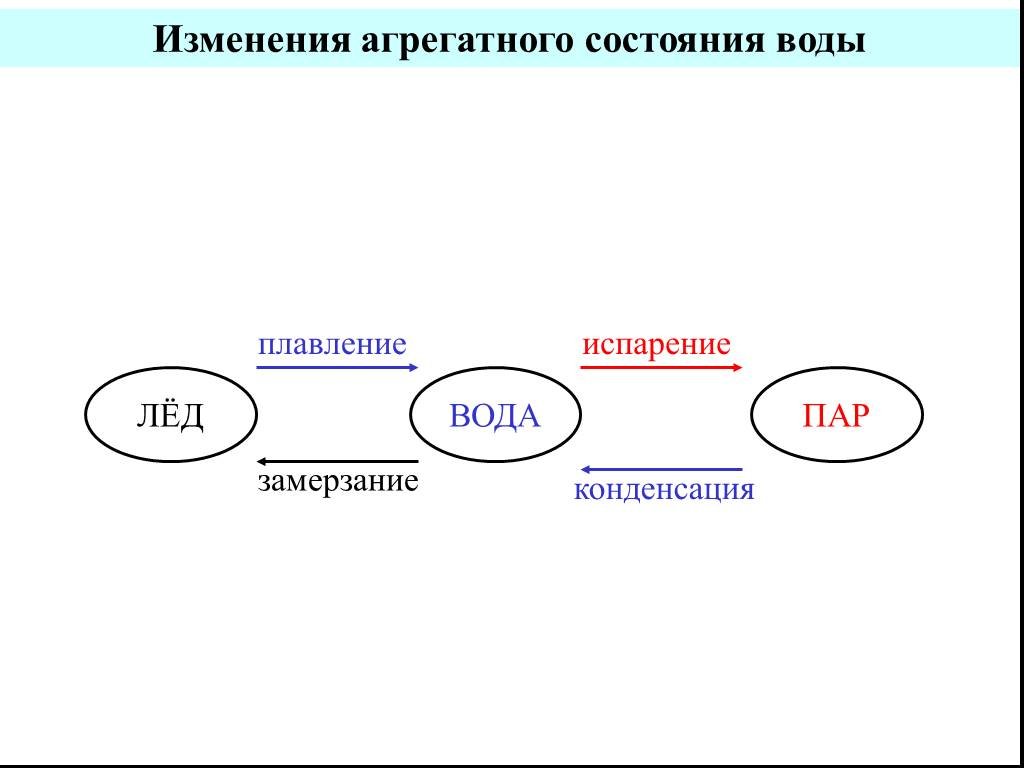
Слайд 3Изменения агрегатного состояния воды
ЛЁД ВОДА ПАР
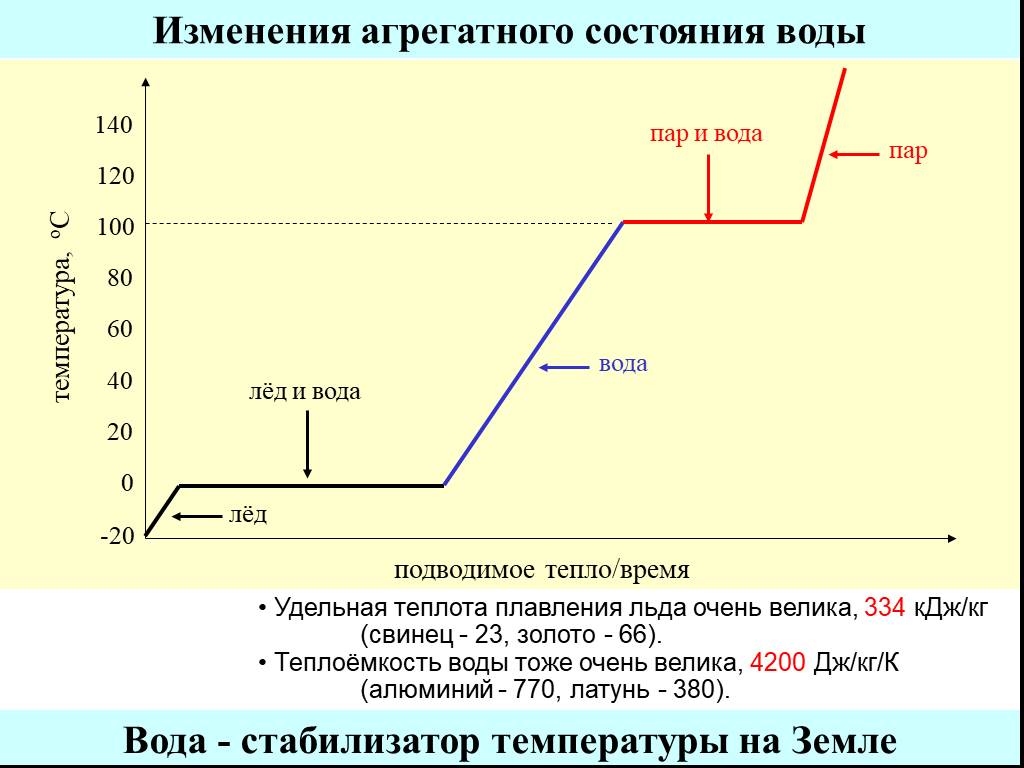
Слайд 4Удельная теплота плавления льда очень велика, 334 кДж/кг (свинец - 23, золото - 66). Теплоёмкость воды тоже очень велика, 4200 Дж/кг/К (алюминий - 770, латунь - 380).
Вода - стабилизатор температуры на Земле

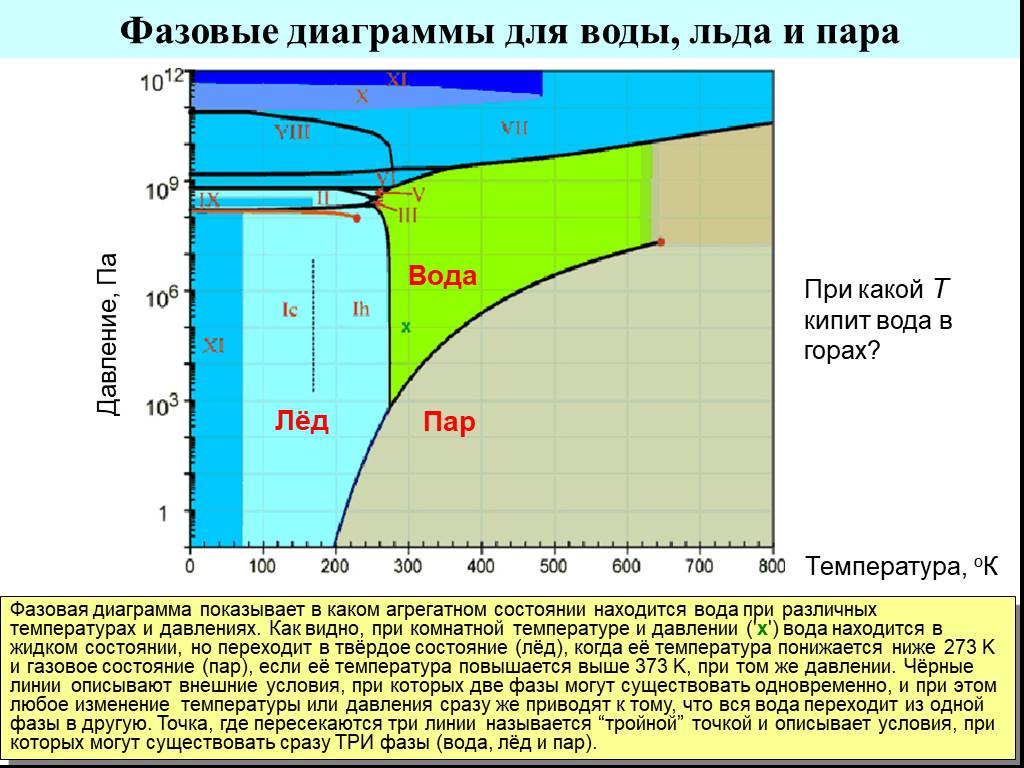
Слайд 5Фазовые диаграммы для воды, льда и пара
Фазовая диаграмма показывает в каком агрегатном состоянии находится вода при различных температурах и давлениях. Как видно, при комнатной температуре и давлении ('x') вода находится в жидком состоянии, но переходит в твёрдое состояние (лёд), когда её температура понижается ниже 273 K и газовое состояние (пар), если её температура повышается выше 373 K, при том же давлении. Чёрные линии описывают внешние условия, при которых две фазы могут существовать одновременно, и при этом любое изменение температуры или давления сразу же приводят к тому, что вся вода переходит из одной фазы в другую. Точка, где пересекаются три линии называется “тройной” точкой и описывает условия, при которых могут существовать сразу ТРИ фазы (вода, лёд и пар).
Температура, оК Давление, Па Вода Пар Лёд
При какой Т кипит вода в горах?

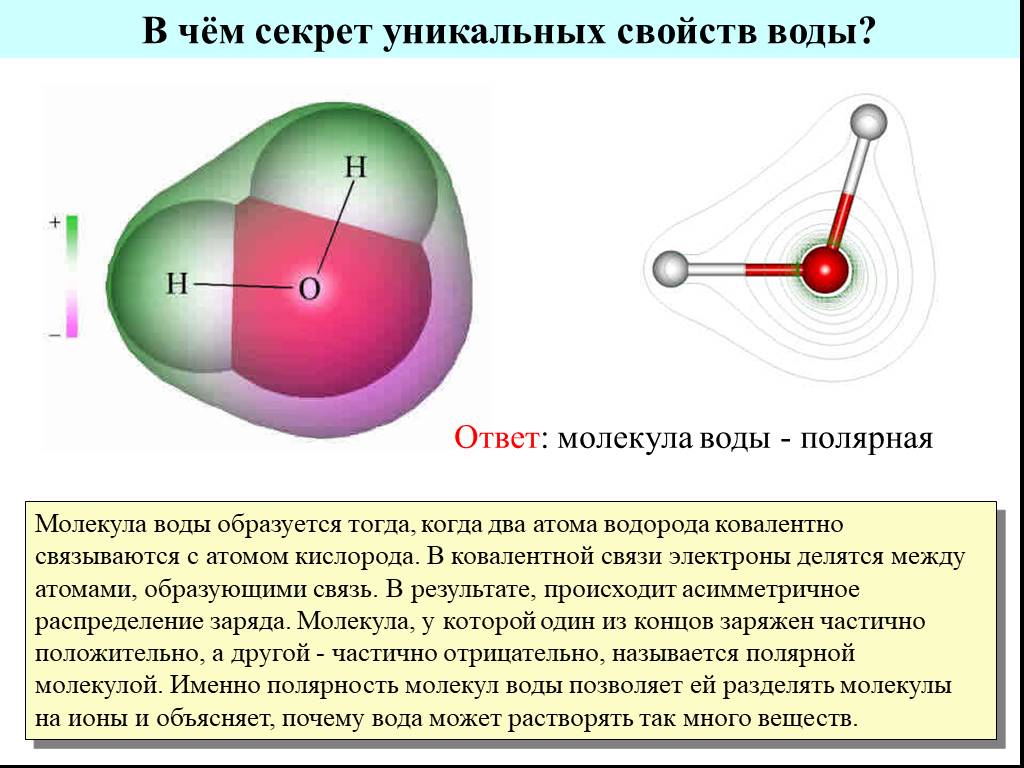
Слайд 6В чём секрет уникальных свойств воды?
Ответ: молекула воды - полярная
Молекула воды образуется тогда, когда два атома водорода ковалентно связываются с атомом кислорода. В ковалентной связи электроны делятся между атомами, образующими связь. В результате, происходит асимметричное распределение заряда. Молекула, у которой один из концов заряжен частично положительно, а другой - частично отрицательно, называется полярной молекулой. Именно полярность молекул воды позволяет ей разделять молекулы на ионы и объясняет, почему вода может растворять так много веществ.
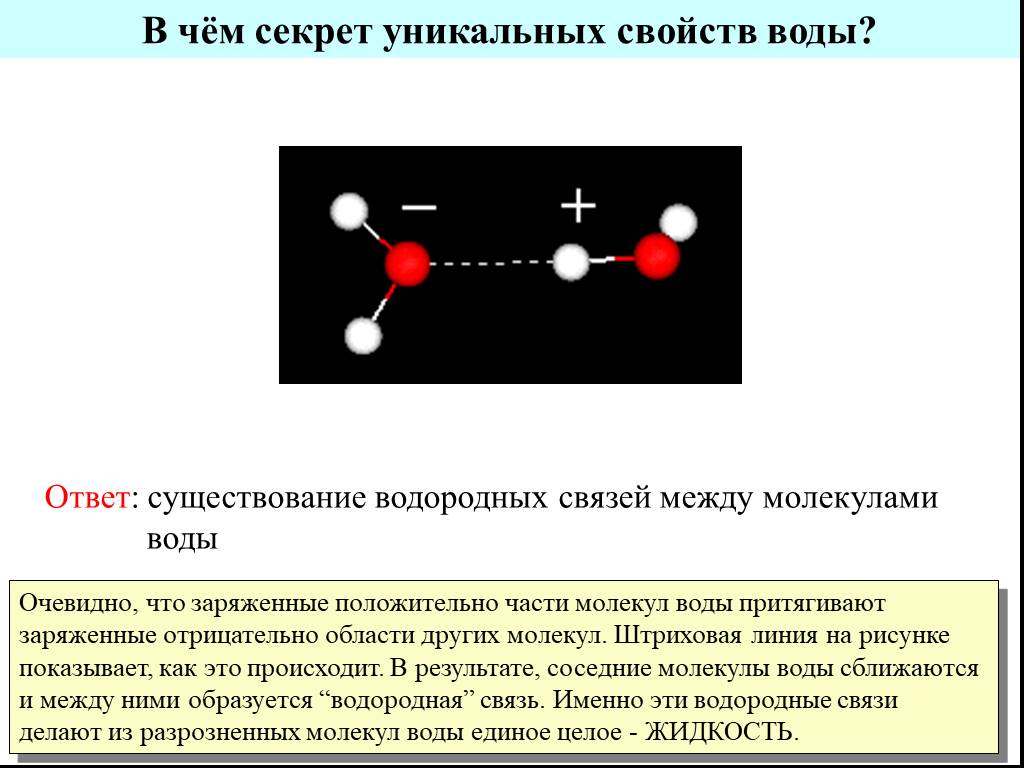
Слайд 7Ответ: существование водородных связей между молекулами воды
Очевидно, что заряженные положительно части молекул воды притягивают заряженные отрицательно области других молекул. Штриховая линия на рисунке показывает, как это происходит. В результате, соседние молекулы воды сближаются и между ними образуется “водородная” связь. Именно эти водородные связи делают из разрозненных молекул воды единое целое - ЖИДКОСТЬ.
Слайд 8Водородные связи намного слабее ковалентных и поэтому структура связей между молекулами воды очень изменчива, делая невозможным выделить какую-либо “типичную” форму этой структуры. Поэтому же вода может течь!
Почему вода течёт?
Слайд 9По сравнению с водой, кристаллическая структура льда выглядит очень упорядоченной
лёд вода
В жидкой воде каждый атом водорода связан в среднем с 3,4 соседних молекул воды. У льда каждый атом водорода связан всегда с 4 другими молекулами. Посмотрите на рисунки. Обратите внимание на пустые пространства внутри структуры молекул льда. Поэтому плотность льда составляет всего 931 кг/м3, по сравнению с 1000 кг м3 для воды. Что это значит для сохранения жизни на Земле зимой? На поверхности Земли очень много льда. Если весь лёд на Земле растопить, то уровень мирового океана повысится на 70 м. Масса льда, хранящегося в виде ледников в горах и полярных районах Земли стабилизирует погоду на планете, определяя земной климат. Как?

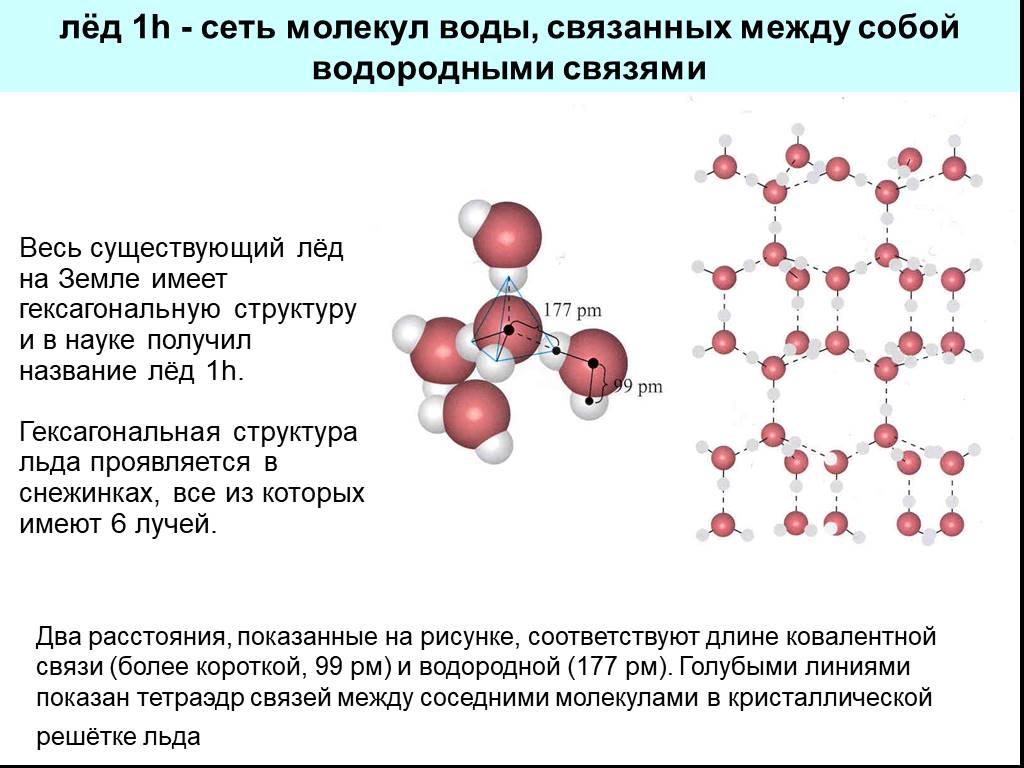
Слайд 10Два расстояния, показанные на рисунке, соответствуют длине ковалентной связи (более короткой, 99 рм) и водородной (177 рм). Голубыми линиями показан тетраэдр связей между соседними молекулами в кристаллической решётке льда
лёд 1h - сеть молекул воды, связанных между собой водородными связями
Весь существующий лёд на Земле имеет гексагональную структуру и в науке получил название лёд 1h. Гексагональная структура льда проявляется в снежинках, все из которых имеют 6 лучей.
Слайд 11Различные виды снежинок
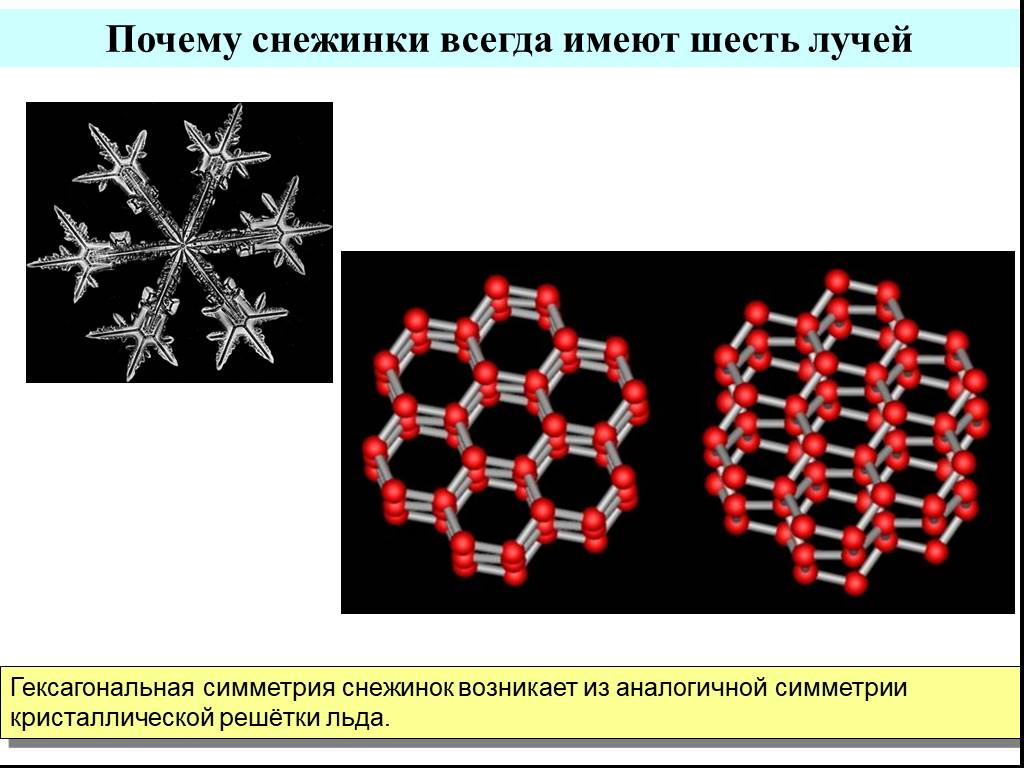
Слайд 12Почему снежинки всегда имеют шесть лучей
Гексагональная симметрия снежинок возникает из аналогичной симметрии кристаллической решётки льда.
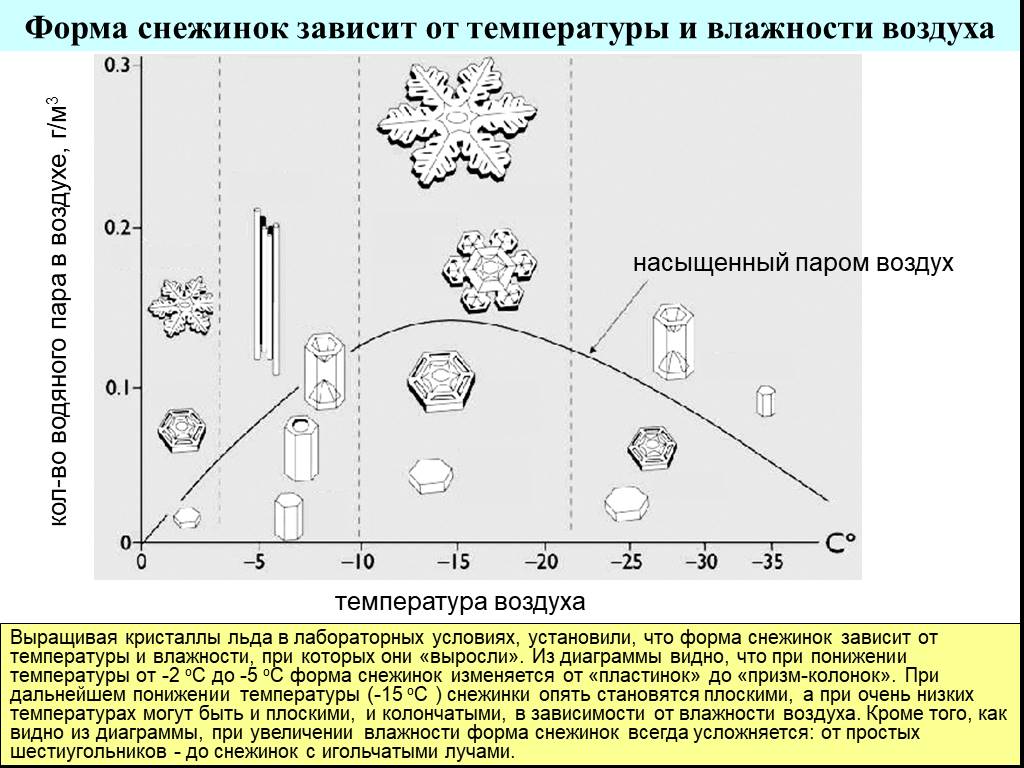
Слайд 13Форма снежинок зависит от температуры и влажности воздуха
Выращивая кристаллы льда в лабораторных условиях, установили, что форма снежинок зависит от температуры и влажности, при которых они «выросли». Из диаграммы видно, что при понижении температуры от -2 оС до -5 оС форма снежинок изменяется от «пластинок» до «призм-колонок». При дальнейшем понижении температуры (-15 оС ) снежинки опять становятся плоскими, а при очень низких температурах могут быть и плоскими, и колончатыми, в зависимости от влажности воздуха. Кроме того, как видно из диаграммы, при увеличении влажности форма снежинок всегда усложняется: от простых шестиугольников - до снежинок с игольчатыми лучами.
кол-во водяного пара в воздухе, г/м3
насыщенный паром воздух
температура воздуха

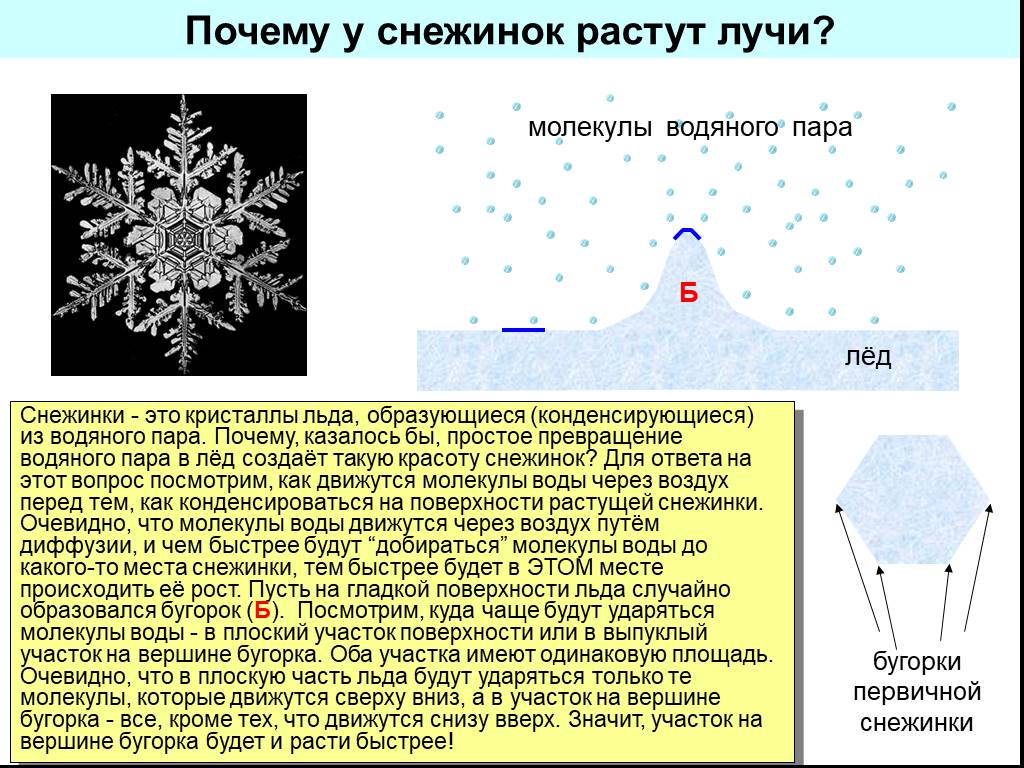
Слайд 14Почему у снежинок растут лучи?
Снежинки - это кристаллы льда, образующиеся (конденсирующиеся) из водяного пара. Почему, казалось бы, простое превращение водяного пара в лёд создаёт такую красоту снежинок? Для ответа на этот вопрос посмотрим, как движутся молекулы воды через воздух перед тем, как конденсироваться на поверхности растущей снежинки. Очевидно, что молекулы воды движутся через воздух путём диффузии, и чем быстрее будут “добираться” молекулы воды до какого-то места снежинки, тем быстрее будет в ЭТОМ месте происходить её рост. Пусть на гладкой поверхности льда случайно образовался бугорок (Б). Посмотрим, куда чаще будут ударяться молекулы воды - в плоский участок поверхности или в выпуклый участок на вершине бугорка. Оба участка имеют одинаковую площадь. Очевидно, что в плоскую часть льда будут ударяться только те молекулы, которые движутся сверху вниз, а в участок на вершине бугорка - все, кроме тех, что движутся снизу вверх. Значит, участок на вершине бугорка будет и расти быстрее!
Б
молекулы водяного пара

Слайд 15Почему нет двух одинаковых снежинок?
Образование ядра кристаллизации вокруг частички пыли рост шестигранной призмы, происходящий очень медленно рост лучей на рёбрах призмы, произошедший в результате увеличения влажности температура воздуха изменяется и на лучах снежинки опять начинают медленно расти маленькие призмы снежинка, опускаясь с небес, проходит через несколько областей с разной температурой и влажностью, приобретая неповторимую форму
Слайд 16Снег - это масса снежинок. При этом, если взглянуть на каждую снежинку, то она окажется довольно прозрачной. Однако, когда луч света падает на поверхность кристалла льда, то часть его отражается, а часть проходит внутрь кристалла, и отразившись от граней этого кристалла и десятка соседних, покидает снежинку. Поэтому снег воспринимается нами, как белый. Таким образом, беспорядочное отражение (рассеяние) света, падающего на снег, делает его белым.
Почему снег белый?

Слайд 17Первым объяснением скользкости льда была гипотеза лорда Кельвина, с которой он выступил около 150 лет тому назад. Он считал, что давление конька на лёд приводит к временному понижению температуры плавления льда, и лёд на очень короткое время преврашается в воду. К сожалению, до сих пор это объяснение можно найти во многих учебниках. Простой взгляд на фазовую диаграмму показывает, что увеличенное давление под коньком может понизить температуру плавления лишь на пару градусов. Поэтому по теории Кельвина можно было бы кататься на коньках только при температуре около нуля. Чтобы объяснить скользкость льда при -10 и -20 градусах в сороковых годах прошлого века предположили, что лёд мог бы плавиться от трения коньков об лёд. Но и это дополнение, не позволяло объяснить, почему даже стоять на льду бывает скользко. Только исследования последних лет показали, что на поверхности льда при любой температуре существует тонкая жидкая плёнка, которая и делает лёд скользким.
Почему лёд скользкий?

Слайд 18Толщина жидкой плёнки растёт с ростом температуры, так как более высокая тепловая энергия молекул вырывает из решёток больше поверхностных слоёв. Наличие примесей тоже мешает поверхностным слоям образовывать кристаллические решётки. Поэтому увеличить толщину жидкой плёнки можно, растворив в ней какие либо примеси, например, обычную соль.
Расположенные на поверхности льда молекулы воды находятся в особых условиях. Силы, заставляющие их находиться в узлах решётки, действуют на них только снизу. Поэтому поверхностным молекулам ничего не стоит «уклониться от советов» молекул, находящихся в решётке, и к такому же решению приходят сразу несколько поверхностных слоёв молекул воды. В результате, на поверхности льда образуется плёнка жидкости, служащая хорошей смазкой при скольжении. Тонкие плёнки жидкости образуются не только на поверхности льда, но и у многих других кристаллов.

Слайд 19Использование простых гранул хлористого натрия для борьбы с наледью на дорогах началось в 1938 году на дорогах США. В 1970 году, для того чтобы хлористый натрий лучше взаимодействовал со льдом, к нему стали добавлять хлористый кальций, который обладает способностью намокать. Поэтому смесь быстрее соединялась со льдом и уничтожала его, превращая в раствор, который уже не был скользким. Сейчас дороги поливают из шланга раствором хлористого натрия. Когда очень холодно, использовать хлористый натрий не имеет смысла, так как он не в состоянии понизить температуру, скажем на 30 градусов.
Как борятся со льдом на дорогах

Слайд 20Когда соль растворяют в воде, температура замерзания раствора понижается прямо-пропорционально концентрации соли и не зависит от её вида, так, что: dT = K • m где dT - понижение температуры замерзания, в градусах, K - коэффициент, имеющий определённое значение для каждого растворителя, и m - моляльность раствора (количество молей соли на кг растворителя, не путать с молярностью)
Понижение температуры замерзания и примеси
Слайд 21Молекулярная формула: C2H6O2 Бесцветная вязкая сладкая жидкость Точка замерзания: -13 C Точка кипения: 196-198 C Удельный вес: 1.113 Смешивается с водой в любых пропорциях
Очень токсичен.
Этилен гликоль является антифризом, так как его точка замерзания понижена на 13 градусов, по сравнению с водой
Автомобильный антифриз = 50 % этилен гликоль + 50 % воды
Слайд 22КРИОБИОЛОГИЯ – дорога в бессмертие
Потребление кислорода животными при понижении температуры на 10 °С падает в 2-3 раза. Многие животные способны выживать, переходя в состояние оцепенения, при температуре жидкого воздуха (-190 °С) или даже жидкого гелия (-269 °C). Однако такой сопротивляемостью по отношению к низким температурам обладают далеко не все организмы. Животные, обитающие в условиях холодного климата, выдерживают длинные холодные зимы, когда их температура может падать гораздо ниже температуры замерзания воды. Одним из способов, который помогает им избегать гибели в таких условиях - переохлаждение.

Слайд 23КРИОБИОЛОГИЯ – дорога в бессмертие переохлаждение
Переохлаждение - снижение температуры жидкости внутри клеток животного ниже температуры ее замерзания без образования кристаллов льда. Образование кристаллов внутри клетки приводит к необратимому разрушению и ее гибели. Вода или солевой раствор, охлаждённая ниже температуры замерзания, замерзает только при наличии центров кристаллизации. При отсутствии чужеродных частиц, служащих, как правило, центрами кристаллизации, чистую воду можно переохладить почти до -40 °С. Но, как только появляется первый кристаллик льда, замерзание всей жидкости идет очень быстро.

Слайд 24Глицерин предохраняет живые организмы от повреждения при замораживании, так как кристаллов не образует. Глицерин в высокой концентрации (несколько десятков мМ) содержится в гемолимфе насекомых, и с этим связывают их способность выживать при низких температурах. У осы к наступлению зимы концентрация глицерина увеличивается до 5 М, и в этот период глицерин составляет около 3 % всего жидкого содержимого этого насекомого. В результате, температура замерзания гемолимфы осы снижается до -17,5 °С.
КРИОБИОЛОГИЯ – дорога в бессмертие Глицерин у насекомых

Слайд 25Эритроциты крови можно много месяцев хранить без повреждения в замороженном состоянии, если предварительно погрузить их в глицерин. Используя глицерин можно предохранить от криоповреждения даже целых животных. Так, хомяков сначала перфузировали небольшим количеством глицерина, после чего их погружали в ледяную воду. Все признаки жизни (дыхание, сердцебиение) у них вскоре исчезали. Далее животных замораживали до температуры -14 °С и они становились совершенно твердыми. Пробыв около часа в таком состоянии, они оттаивали и большая их часть возвращалась к жизни.
КРИОБИОЛОГИЯ – дорога в бессмертие Глицерин - криоконсервант

Слайд 26Рыбы, обитающие в холодных приполярных водах (нототениевые, камбала и др.) обладают уникальной способностью не замерзать, находясь в переохлажденном состоянии, до температуры -2,2 °С. Большинство рыб тропических и умеренных широт в присутствии льда замерзают при охлаждении до -0,8 °С. Оказалось, что некоторые полипептиды и гликопротеины, молекулы которых состоят из множества повторяющихся единиц, способны уже в миллимолярных концентрациях значительно понижать температуру замерзания. Поэтому эти белковые антифризы в 300-500 раз более эффективны, чем NaCl.
Белковые АНТИФРИЗЫ