Конспект урока «исследование уравнения Менделеева-Клапейрона» по физике для 10 класса
Урок-исследование уравнения Менделеева-Клапейрона в 10 кл.
Цели урока:
Образовательные. Показать математическую зависимость между тремя макроскопическими параметрами p,V,T. Научить применять физические законы при решении задач. Научить применять полученные знания как язык науки, имеющий огромные возможности. Воспитательные. Дать возможность почувствовать свой потенциал каждому учащемуся, чтобы показать значимость полученных знаний. Побудить к активной работе мысли. Развивать кругозор учащихся. Развивающие. Формировать умение вести рассказ с помощью опорного конспекта, выражать свои мысли правильным физическим языком. Формировать умение выделять главное, обобщать и связывать имеющиеся знания со знаниями из других областей. Формировать умение наблюдать и анализировать явления, кратко и лаконично отвечать на вопросы. Тип урока: изучение нового материала c элементами исследования, с использованием элементов беседы и методов проблемной ситуации.
Эпиграф к уроку:
Любите физику, друзья,
Без космоса никак нельзя,
Без света не прожить и дня,
Как в древнем мире без огня.
Без физики не только свет,
Компьютер или Интернет,
Мы не могли бы получить,
Давайте физику учить!
Демонстрации: зависимость между объемом, давлением и температурой.
Оборудование: интерактивная доска, компьютер, презентация Power Point.
Ход урока:
I. Проверка домашнего задания. Повторение ранее изученного (фронтальный опрос) О газовых законах. Графические тесты 12г., 13г.
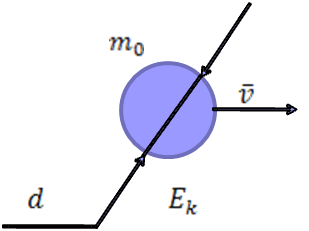
Учитель. Выполним с вами экспериментальную задачу. Определим атмосферное давление в нашем кабинете. Оборудование: термометр, линейка.
Ученик. Термометром можно измерить температуру, линейкой измерить размеры комнаты и вычислить объем. А как установить зависимость между давлением, объемом и температурой? Учитель. И это будет целью нашего урока, вывести физический закон, устанавливающий зависимость между тремя макроскопическими параметрами-p,V,T; научиться использовать закон при решении задач. Учитель. Что такое идеальный газ? Ученик. Идеальным газом называется модель реального газа. Молекулярно-кинетическая теория (МКТ) рассматривает идеальный газ как множество частиц, находящихся в состоянии непрерывного хаотичного движения. Учитель. Назовите условия, при которых газ можно считать идеальным? Ученик. Газ, удовлетворяющий следующим условиям: межмолекулярные взаимодействия отсутствуют; взаимодействия молекул газа происходят только при соударениях, и являются упругими; молекулы газа не имеют объема –материальные точки. Учитель. Что называется концентрацией? Ученик. Концентрация – это число молекул в единице объема. Учитель. Запишите и объясните физический смысл основного уравнения молекулярно-кинетической теории. Ученик. Давление идеального газа обусловлено ударами молекул о стенку сосуда, поэтому с помощью молекулярно-кинетической теории его можно выразить через концентрацию молекул, средние скорости молекул и массу одной молекулы. 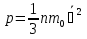 - основное уравнение МКТ (уравнение Клаузиуса), устанавливает связь между микро и макромиром. II.Постановка проблемного вопроса и решение его. Учитель. Какие параметры, характеризующие газ и процессы, проходящие в нем, называются микроскопическими параметрами Ученик. Состояние идеального газа и процессы, проходящие в нем, будут определяться количеством частиц(молекул), из которых состоят газ, и их параметрами, такими как масса, диаметр, скорость, энергия и пр.
- основное уравнение МКТ (уравнение Клаузиуса), устанавливает связь между микро и макромиром. II.Постановка проблемного вопроса и решение его. Учитель. Какие параметры, характеризующие газ и процессы, проходящие в нем, называются микроскопическими параметрами Ученик. Состояние идеального газа и процессы, проходящие в нем, будут определяться количеством частиц(молекул), из которых состоят газ, и их параметрами, такими как масса, диаметр, скорость, энергия и пр.
Такие параметры называются микроскопическими и макропараметрами. Учитель. Какие параметры, характеризующие газ, процессы, проходящие в нем, называются макроскопическими параметрами (макропараметрами)? Ученик. Параметры, характеризующие свойства газа как целого называются макроскопическими или макропараметрами. Учитель. Если состояние газа не меняется, то не меняются и эти параметры. Назовите макропараметры, характеризующие газ? Ученик. 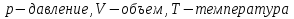 . Учитель. Температуру, объем, давление и некоторые другие параметры принято называть параметрами состояния газа. Выведем уравнение, устанавливающее зависимость между этими параметрами. III.Изучение нового материала.
. Учитель. Температуру, объем, давление и некоторые другие параметры принято называть параметрами состояния газа. Выведем уравнение, устанавливающее зависимость между этими параметрами. III.Изучение нового материала.
1. Из основного уравнения МКТ идеального газа можно получить уравнение состояния идеального газа, связывающее между собой параметры состояния 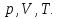 Если исключим из основного уравнения МКТ микроскопические параметры, заменяя их на макроскопические параметры используя известные соотношения, получаем:
Если исключим из основного уравнения МКТ микроскопические параметры, заменяя их на макроскопические параметры используя известные соотношения, получаем:
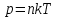
Это соотношение позволяет по двум известным макроскопическим параметрам(давлению и температуре газа) оценить микроскопический параметр(концентрацию). 2. Уравнение Клапейрона. Получим теперь с помощью равенства новое уравнение. Если известно полное число частиц газа N, занимающая объем V, то число частиц в единице объема
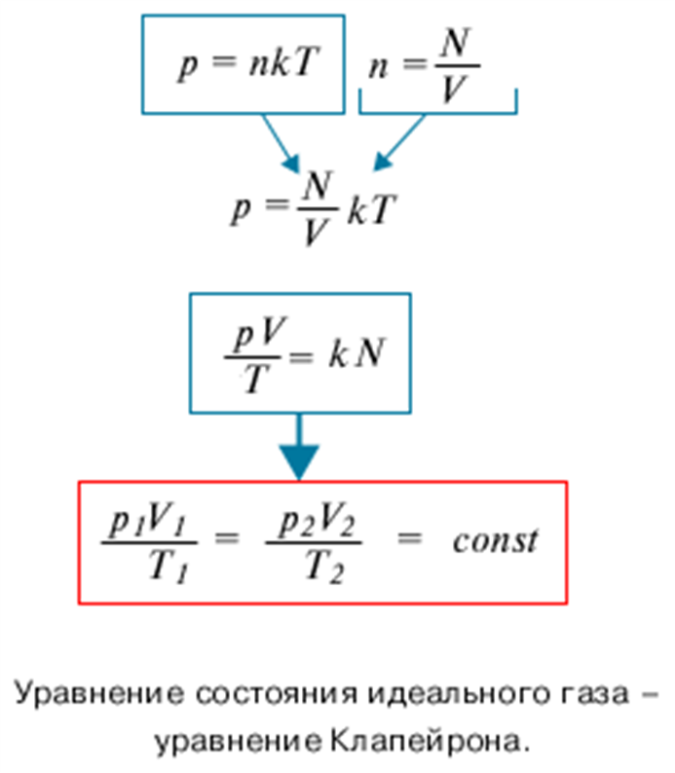

Для постоянной массы идеального газа отношение произведения давления на объем к данной температуре есть величина постоянная.
Выведенное нами уравнение связывает давление, объем и температуру, которые определяют состояние идеального газа, называется уравнением состояния идеального газа – уравнение Клапейрона. Историческая справка о Клапейроне Бенуа Поль Эмиль. Уравнение Менделеева-Клапейрона:
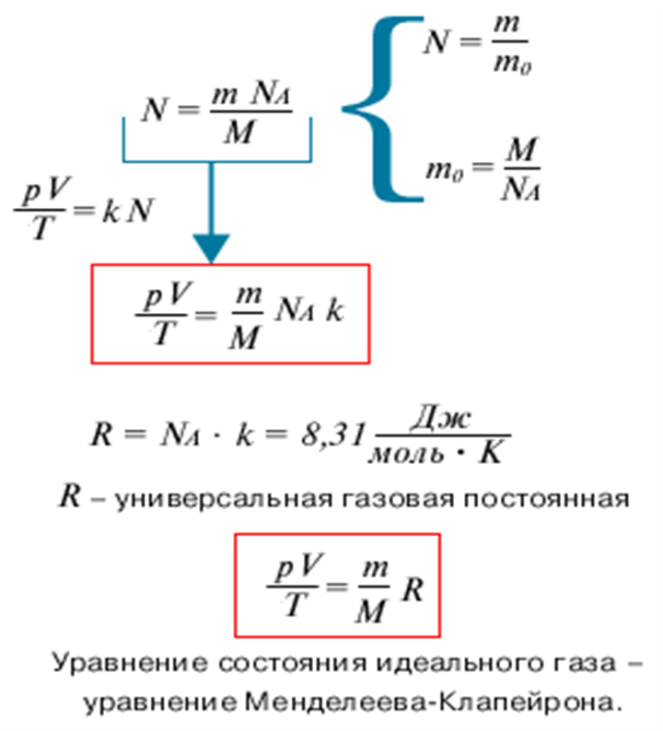
Историческая справка о Менделееве Д.И. IV. Закрепление изученного материала. 1. Беседа с учащимися по вопросам. Учитель. Какие величины характеризуют состояние газа? Ученик. Макропараметры 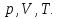 Учитель. Чем отличается уравнение состояния газа от уравнения Менделеева-Клапе1рона? Какое из них полнее по содержанию? Почему? Ученик. Уравнение состояния идеального газа для постоянной массы газа. Уравнение Менделеева-Клапейрона для переменной массы газа. Учитель. Чему равна универсальная газовая постоянная СИ? Ученик.
Учитель. Чем отличается уравнение состояния газа от уравнения Менделеева-Клапе1рона? Какое из них полнее по содержанию? Почему? Ученик. Уравнение состояния идеального газа для постоянной массы газа. Уравнение Менделеева-Клапейрона для переменной массы газа. Учитель. Чему равна универсальная газовая постоянная СИ? Ученик. 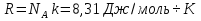 -универсальная газовая постоянная. 2. Решение задач у доски с помощью учителя. 1) Дано:
-универсальная газовая постоянная. 2. Решение задач у доски с помощью учителя. 1) Дано: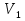 =10л,
=10л, 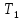 =323K,
=323K, 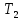 =273K Найти:
=273K Найти: 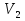 Решение: В данном случае, используя уравнение состояния газа
Решение: В данном случае, используя уравнение состояния газа 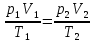
Учтем, что изменение объема газа с понижением температуры происходит при постоянном давлении(имеет место изобарный процесс), следовательно, 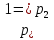 и
и 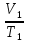 =
=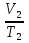 . Отсюда
. Отсюда 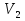 =
=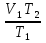 .
.
Вычисления: 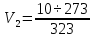 ≈
≈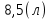 Ответ:
Ответ: 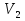 ≈8,5л.
≈8,5л.
2) Дано: m=6,4кг, t=20°С, p=15,68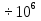 Па. Дополнительные данные: R=8,
Па. Дополнительные данные: R=8,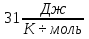 , молярная масса кислорода M=
, молярная масса кислорода M=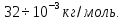 Найти: V T=(273+20)К=293К Решение. Согласно уравнению Менделеева-Клапейрона
Найти: V T=(273+20)К=293К Решение. Согласно уравнению Менделеева-Клапейрона 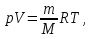 откуда
откуда 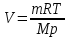 . Вычисления:
. Вычисления:
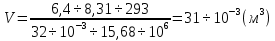
Ответ: 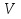 =
=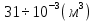 =31л.
=31л.
V. Итоги урока
Домашнее задание: §4.6, Упр.9(7,11,12,13)
| m ,кг | М,кг/моль | P, Па | V,м3 | Т, К | |
| 1вариант | 8 | 4*10-3 | 2*105 | 16,6 | ? |
| 2вариант | 0,02 | 2*10-3 | 8,3*105 | ? | 200 |
| 3вариант | 64 | 32*10-3 | ? | 24,9 | 300 |
| 4вариант | 7 | ? | 105 | 8,3 | 400 |
| 5вариант | ? | 44*10-3 | 107 | 0,0249 | 300 |
1. Процессы изменения состояния газа, представленные на графиках:

А) 1- изотермический процесс; 2- изохорный.
В) 1-изохорный; 2-изобарный.
С) 1 и 2-изотермические.
D) 1-изобарный; 2-изотермический.
E)1 и 2-изохорные.
2. Изохорные процессы представлены на графиках:
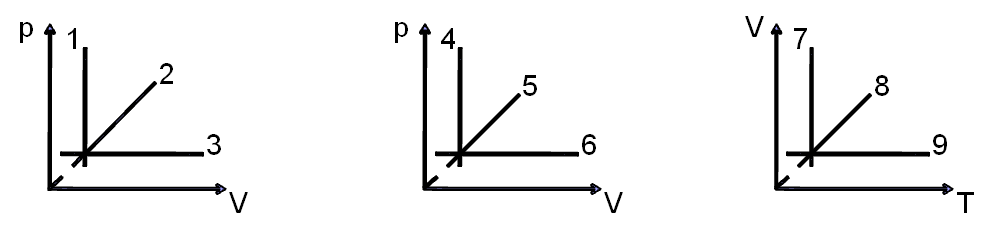
А)2,4,9.
В)3,6,9.
С)3,6,8.
D)1,5,9.
3.Изобара идеального газа представлена на графике:
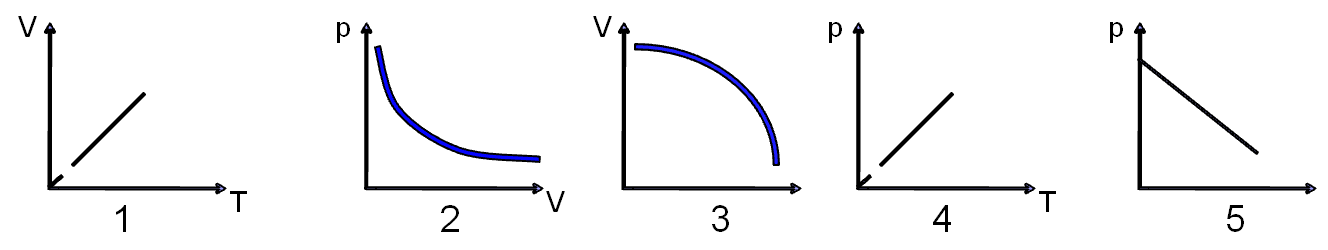
А)5
B)2
D)4
E)1

Здесь представлен конспект к уроку на тему «исследование уравнения Менделеева-Клапейрона», который Вы можете бесплатно скачать на нашем сайте. Предмет конспекта: Физика (10 класс). Также здесь Вы можете найти дополнительные учебные материалы и презентации по данной теме, используя которые, Вы сможете еще больше заинтересовать аудиторию и преподнести еще больше полезной информации.

