Слайд 1Элементы IV группы главной подгруппы периодической системы элементов таблицы Менделеева
Выполнила студентка группы х-116 Осипова Вера Руководитель: к.х.н., доц. НХ и ХТ Перегудов Ю.С. Кафедра неорганической химии и химической технологии
Воронежский Государственный Университет Инженерных Технологий
Слайд 2Подгруппа углерода, в которую входят углерод, кремний, германий, олово и свинец, является главной подгруппой 4 группы Периодической системы.
Дмитрий Иванович Менделеев
Слайд 3С 2s22p2 Si 3s23p23d0 Ge 3d104s24p24d0 Sn 4d105s25p25d0 Pb 4f145d106s26p26d0
Начиная с кремния, р-элементы IV группы имеют вакантные d-орбитали. Это определяет возможность образования связей по донорно-акцепторному механизму и приводит к увеличению валентности в координационных соединениях до VI. Ввиду отсутствия d-подуровня у атома углерода его валентность в соединениях не может быть более IV, и углерод, в отличие от Si, Ge, Sn и Pb, не способен образовывать комплексные соединения.
Слайд 4Углерод и кремний являются типичными неметаллами, а олово и свинец – типичными металлами. Германий занимает промежуточное положение.
Слайд 5Степень окисления
все элементы имеют характерные степени окисления 4, +2, +4. Как и у всех элементов главных подгрупп периодической системы, при движении сверху вниз устойчивость соединений «крайних» степеней окисления (4 и +4) уменьшается, а степени окисления +2 увеличивается.
Слайд 6Общая характеристика подгруппы
Атомный радиус сверху вниз возрастает Температура плавления и кипения убывает Энергия ионизации убывает Металлические свойства увеличиваются Основные свойства увеличиваются
Слайд 8Физические свойства
Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода образовывать химические связи разного типа.

Слайд 9Известны четыре кристаллические модификации углерода: графит, алмаз, карбин и лонсдейлит. Графит - серо-чёрная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическим блеском, обладает электропроводимостью. Сгорает при 700С в присутствии кислорода. Встречается в природе; получается искусственно. При высокой температуре, давлении и присутствии катализатора (марганец Mn, хром Cr, платиновые металлы) графит превращается в алмаз. Алмаз - минерал, имеющий желтоватый, белый, серый, зеленоватый, реже голубой и черный цвет. Не проводит электрический ток, плохо проводит тепло.. Алмаз - это самое твердое вещество из всех известных. Температура плавления выше 3500 С. Химически стоек. Сгорает при 870С в присутствии кислорода. При 1800С в отсутствие кислорода превращается в графит. Прозрачные кристаллы; после обработки - бриллианты. Добывают из россыпей и коренных месторождений. Карбин получен искусственно. Он представляет собой мелкокристаллический порошок чёрного цвета (плотность = 2 г/см). Построен из длинных цепочек атомов С, уложенных параллельно друг другу. Лонсдейлит найден в метеоритах и получен искусственно; его структура и свойства окончательно не установлены.

Слайд 10Химические свойства
Химические свойства углерода обычно рассматриваются на примере графита или углей, поскольку алмаз химически неактивен. Углерод малоактивное вещество и в реакции вступает при нагревании или поджигании, что связано с затратами энергии для разрушения кристаллической решетки.

Слайд 111. Взаимодействие с водородом происходит при высокой температуре и наличии катализатора. Ni C + 2H2 = CH4 2. Взаимодействие с кислородом. При сгорании углей образуется диоксид углерода (СО2).. C + O2 = CO2 С + СО2 = 2СО (угарный газ) 3. Углерод непосредственно взаимодействует только с фтором. Соединения с хлором, бромом, йодом получают косвенным путем. С + 2F2 = CF4 4. Углерод при нагревании соединяется с серой и азотом. C + 2S = CS2 (сероуглерод) 2C + N2 = (CN) 2 - дициан Сероуглерод является хорошим растворителем жиров, смол, лаков. 5. При высокой температуре углерод образует с металлами или их оксидами карбиды. 2C + Ca = CaC2 2Na + 2C = Na2C2 4Al + 3C = Al4C3 C + 3Fe = Fe3C CaO + 3C = CaC2 + CO2 Al2O3+ 9C = Al4C3 + 6CO

Слайд 126. При нагревании углерод окисляется азотной и конц. серной кислотами, хотя на холоду устойчив к действию этих и других кислот. C + 2H2SO4(конц.) = CO2 + 2SO2 + 2H2O 3C + 4HNO3(разб.) = 3CO2 + 4NO + 2H2O 7. Уголь при нагревании проявляет сильные восстановительные свойства, что используется в металлургии. Восстановителем является как сам углерод, так и,образующийся при сгорании угля,монооксид углерода. Fe3O4 + 2C = 3Fe + 2CO2 2ZnO + C = 2Zn + CO2 MnO2 + C = Mn + CO2 BaSO4 + 2C = BaS + 2CO2 SiO2+ C = Si + CO2 Ca3(PO4) 2+ 10C + 6SiO2 = P4 + 6CaSiO3+ 10CO 8. При высокой температуре (1000o C) уголь разлагает воду: С + H2O = CO + H2

Слайд 13Углерод в организме
Углерод - важнейший биогенный элемент, составляющий основу жизни на Земле, структурная единица огромного числа органических соединений, участвующих в построении организмов и обеспечении их жизнедеятельности (биополимеры, а также многочисленные низкомолекулярные биологически активные вещества - витамины, гормоны, медиаторы и др.). Значительная часть необходимой организмам энергии образуется в клетках за счёт окисления углерода. Возникновение жизни на Земле рассматривается в современной науке как сложный процесс эволюции углеродистых соединений.
Слайд 14Нахождение в природе
В природе углерод встречается в виде: алмаза карбина графита в соединениях – в виде каменного и бурого углей и нефти. Входит в состав природных карбонатов: известняка, мрамора, мела CaCO3, доломита CaCO3 *MgCO3. Является важной составной частью органических веществ.

Слайд 15Применение
Графит используется в карандашной промышленности. Также его используют в качестве смазки при особо высоких или низких температурах. Алмаз. Алмазным напылением обладают шлифовальные насадки бормашин. Кроме этого, ограненные алмазы — бриллианты используются в качестве драгоценных камней в ювелирных украшениях. Благодаря редкости, высоким декоративным качествам и стечению исторических обстоятельств, бриллиант неизменно является самым дорогим драгоценным камнем. Исключительно высокая теплопроводность алмаза (до 2000 Вт/м·К) делает его перспективным материалом для полупроводниковой техники в качестве подложек для процессоров. Но относительно высокая цена (около 50 долларов/грамм) и сложность обработки алмаза ограничивают его применение в этой области. В фармакологии и медицине широко используются различные соединения углерода — производные угольной кислоты и карбоновых кислот, различные гетероциклы, полимеры и другие соединения. Так, карболен(активированный уголь), применяется для абсорбции и выведения из организма различных токсинов; графит (в виде мазей) — для лечения кожных заболеваний; радиоактивные изотопы углерода — для научных исследований (радиоуглеродный анализ).

Слайд 17получение
Основным способом получения кремния является восстановление из диоксида кремния, а наиболее чистый кремний - восстановлением SiCl4. SiO2 + 2C = Si + 2CO 3SiO2 + 4Al = 3Si + 2Al2O3 SiO2 + 2Mg = Si + 2MgO SiCl4 + 2Zn = Si + 2ZnCl2
Слайд 18Кремний - широко распространённый элемент в природе. В земной коре его 27.6%. Технология получения его отличается от технологии получения германия. Исходное сырьё в виде двуокиси кремния широко распространено в природе. Из кремнезёма в дуговых электрических печах путём восстановления его углеродом кокса получают кремний чистотой до 97%. Кристаллический кремний - темно-серое вещество с металлическим блеском.

Слайд 19Кремний довольно инертное вещество и его химическая активность проявляется преимущественно при высоких температурах. 1.Кремний взаимодействует с кислородом при 400-500 С, а с водородом - при 3000 оC Si + O2 = SiO2 Si + 2H2 = SiH4 (cилан) 2. Кремний взаимодействует с фтором при обычной температуре, а с остальными галогенами при нагревании. Si + 2F2 = SiF4 Si + 2Cl2= SiCl4 Si + 2Br2 = SiBr4 Галогениды кремния гидролизуются водой с образованием кремневой кислоты или диоксида кремния (если гидролиз идет при нагревании). SiСl4 + 3H2O = H2SiO3 + 4HCl SiCl4 + 2H2O = 4HCl + SiO2 3. Взаимодействие с другими неметаллами также идет при нагревании: Si + 2S = SiS2 3Si + 2N2 = Si3N4 Si + C = SiC

Слайд 204. При нагревании кремния с металлами образуются силициды. Силициды разлагаются водой и кислотами с образованием силана (основной способ получения силана). Силан горит и разлагается щелочью. 2Ca + Si = Ca2Si 2Mg + Si = Mg2Si Сa2Si + 4HCl = 2CaCl2 + SiH4 Сa2Si + 4H2O = 2Ca(OH) 2+ SiH4 SiH4 + 2О2 = SiO2 + 2H2O SiH4 + 2NaOH + H2O = Na2SiO3 + 4H2 5. Кислоты, кроме плавиковой, на кремний не действуют, в щелочах кремний растворяется с выделением водорода. Si + 4HF = SiF4 + 2H2 Si + 2NaOH + H2O = Na2SiO3 + 2H2 6. При нагревании кремний разлагает воду. Si + 2H2O = SiO2 + 2H2

Слайд 21Кремний после кислорода — самый распространенный элемент в земной коре. В отличие от углерода в свободном состоянии кремний в природе не встречается. Наиболее распространенными его соединениями являются оксид кремния (IV) SiO2 и соли кремниевых кислот — силикаты. Они образуют оболочку земной коры. Соединения кремния содержатся в организмах растений и животных. состав некоторых природных силикатов: полевой шпат К2О× Аl2O3× 6SiO2, асбест 3MgО× 2SiO2× 2H2O, cлюда К2О× 3Аl2O3× 6SiO2× 2H2O, каолинит 3Аl2O3× 2SiO2× 2H2O. Силикаты, содержащие в своем составе также оксид алюминия, называются алюмосиликатами- полевой шпат, каолинит и слюда. Граниты и гнейсы — состоят из кристалликов кварца, полевого шпата и слюды.

Слайд 22применение
Технический кремний находит следующие применения: сырьё для металлургических производств: компонент сплава (бронзы, силумин); раскислитель (при выплавке чугуна); модификатор свойств металлов или легирующий элемент (например, добавка определённого количества кремния при производстве трансформаторных сталей, сырьё для производства более чистого поликристаллического кремния и очищенного металлургического кремния (в литературе «umg-Si»); сырьё для производства кремнийорганических материалов, силанов; иногда кремний технической чистоты и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях; для производства солнечных батарей.
Слайд 23Германий, олово, свинец
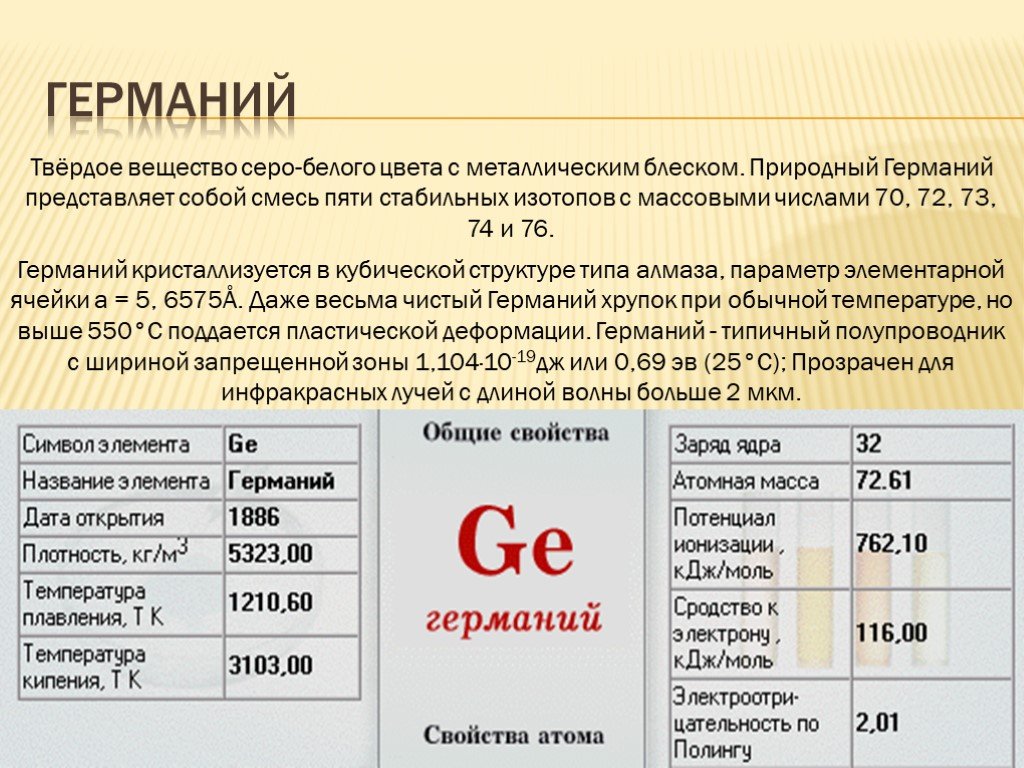
Слайд 24германий
Твёрдое вещество серо-белого цвета с металлическим блеском. Природный Германий представляет собой смесь пяти стабильных изотопов с массовыми числами 70, 72, 73, 74 и 76.
Германий кристаллизуется в кубической структуре типа алмаза, параметр элементарной ячейки а = 5, 6575Å. Даже весьма чистый Германий хрупок при обычной температуре, но выше 550°С поддается пластической деформации. Германий - типичный полупроводник с шириной запрещенной зоны 1,104·10-19дж или 0,69 эв (25°С); Прозрачен для инфракрасных лучей с длиной волны больше 2 мкм.
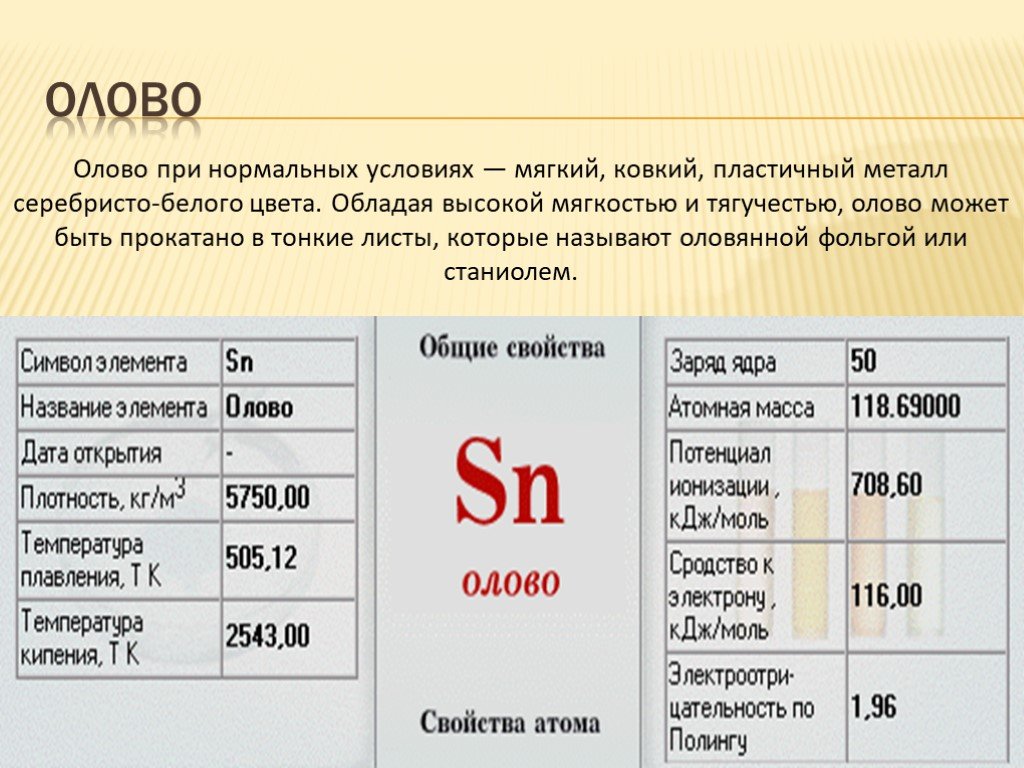
Слайд 25олово
Олово при нормальных условиях — мягкий, ковкий, пластичный металл серебристо-белого цвета. Обладая высокой мягкостью и тягучестью, олово может быть прокатано в тонкие листы, которые называют оловянной фольгой или станиолем.
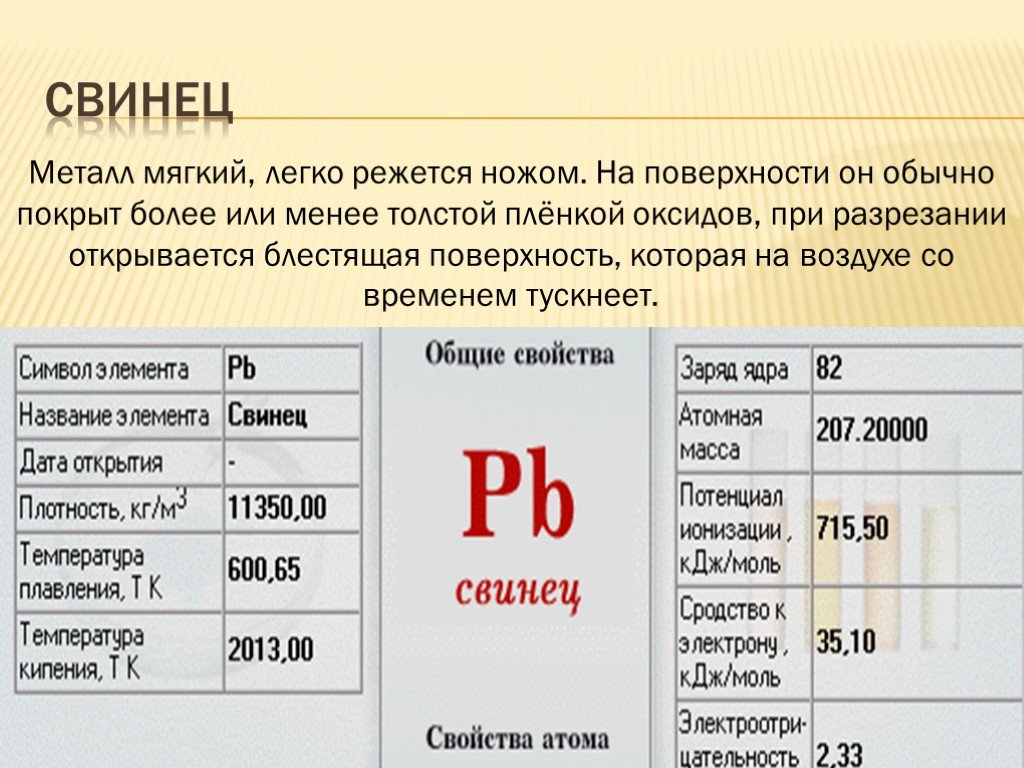
Слайд 26свинец
Металл мягкий, легко режется ножом. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет.

Слайд 27ГЕРМАНИЙ встречается в виде примеси к полиметаллическим, никелевым, вольфрамовым рудам, а также в силикатах. В результате сложных и трудоёмких операций по обогащению руды и её концентрированию германий выделяют в виде оксида GeO2, который восстанавливают водородом при 600 °С до простого вещества: GeO2+ 2H2= Ge + 2H2O.Очистка и выращивание монокристалов германия производится методом зонной плавки( метод очистки твёрдых веществ, основанный на различной растворимости примесей в твердой и жидкой фазах). СВИНЕЦ. Основной источник – сульфидные полиметаллические руды, содержащие от 1 до 5% свинца. Руду концентрируют до содержания свинца 40 – 75%, затем подвергают обжигу: 2PbS + 3O2 = 2PbO + 2SO2 и восстанавливают свинец коксом и оксидом углерода(II) ОЛОВО. Промышленное получение целесообразно, если содержание его в россыпях 0,01% , в рудах 0,1%; обычно же десятые и единицы процентов. Олову в рудах часто сопутствуют W, Zr, Cs, Rb, редкоземельные элементы, Та, Nb и другие ценные металлы. Первичное сырье обогащают: россыпи - преимущественно гравитацией, руды - также флотогравитацией или флотацией.

Слайд 28СВИНЕЦ. Содержание в земной коре 1,6·10-3% по массе. Самородный свинец встречается редко. В природе известно 180 минералов свинца. Основные — галенит PbS и продукты его химических превращений — англезит PbSO4 и церуссит PbCO3. Реже встречаются пироморфит PbCl2·3Pb32, миметит PbCl2·3Pb32, крокоит PbCrO4, вульфенит PbMoO4, штольцит PbWO4. В свинцовых рудах часто находятся также другие металлы — медь, цинк, кадмий, серебро, золото, висмут и др. ОЛОВО— редкий рассеянный элемент, по распространенности в земной коре олово занимает 47-е место. Кларковое содержание олова в земной коре составляет, по разным данным, от 2·10−4 до 8·10−3 % по массе. Основной минерал олова — касситерит (оловянный камень) SnO2, содержащий до 78,8 % олова. Гораздо реже в природе встречается станнин (оловянный колчедан) — Cu2FeSnS4 (27,5 % Sn). ГЕРМАНИЙ. Общее содержание в земной коре7×10−4% по массе, то есть больше, чем, например, сурьмы, серебра, висмута. Однако собственные минералы германия встречаются исключительно редко. Почти все они представляют собой сульфосоли: германит Cu2(Cu, Fe, Ge, Zn)2 (S, As)4, аргиродит Ag8GeS6, конфильдит Ag8(Sn, Ce) S6 и др. Кроме того, германий присутствует почти во всех силикатах, в некоторых месторождениях каменного угля и нефти.

Слайд 29При нагревании реагируют с кислородом, серой, хлором, не реагируют с водородом, углеродом, азотом. 2Pb + O2 = 2PbO; Ge + 2S = GeS2; Sn + 2Cl2 = SnCl4 Германий и олово с водой не взаимодействуют.Свинец медленно растворяется в воде: 2Pb + O2 + 2H2O = 2Pb(OH)2 . В ряду активности Ge стоит между Cu и Ag, т.е. после водорода, а Sn и Pb до водорода. Олово взаимодействуя с разбавленными кислотами вяло вытесняет водород: Sn + H2SO4 (pазб) = SnSO4 + H2 Sn + 2HCl = SnCl2 + H2 Все три элемента взаимодействуют со щелочами (германий в присутствии окислителя): Sn + 2NaOH + 2H2O = Na2[Sn(OH)4] + H2 Ge + 2NaOH + 2H2O2 = Na2[Ge(OH)6]

Слайд 30С кислородом Ge, Sn, Pb дают два ряда оксидов и гидроксидов (валентности II и IV). SnO + 2HCl = SnCl2 + H2O SnO + 2NaOH = Na2SnO2 + H2O Гидроксиды (II) получают взаимодействием соли со щелочью: SnCl2 + 2NaOH = Sn(OH)2 ↓ + 2NaCl. При избытке щелочи гидроксиды, выпавшие в осадок растворяются: Sn(OH)2 + 2NaOH = Na2[Sn(OH)4] Оксид свинца PbO2 можно получить по реакции: Pb(CH3COO)2 + CaOCl2 + H2O = PbO2↓ + CaCl2 + 2CH3COOH Все три оксида проявляют амфотерные свойства, но кислотная функция у них выражена сильнее, чем у оксидов в низшей степени окисления. Существует смешанный оксид свинца Pb3O4 – свинцовый сурик, нерастворимый в воде порошок красивого ярко-оранжевого цвета. При взаимодействии этого оксида с разбавленной азотной кислотой образуются двухвалентный нитрат свинца и диоксид свинца: Pb3O4 + 4HNO3 = PbO2 ↓ + 2Pb(NO3)2 + 2H2O Гидроксиды (IV) можно получить при действии на соли четырехвалентных металлов щелочью: SnCl4 + 2NaOH = Sn(OH)4 ↓ + 2NaCl Гидроксиды (IV) амфотерны: Sn(OH)4 + H2SO4 = Sn(SO4)2 + H2O Sn(OH)4 + 2NaOH = Na2[Sn(OH6)]

Слайд 31Оловянная чума
Есть у олова свойство, которое называют «оловянной чумой». Металл «простужается» на морозе уже при -13°С и начинает постепенно разрушаться. При температуре -33 °С свойство прогрессирует с невероятной быстротой — оловянные изделия превращаются в серый порошок. Именно из-за оловянной чумы до нас не дошли известнейшие коллекции оловянных солдатиков из прошлого. Почему сейчас не случаются подобные истории? Только по одной причине: оловянную чуму научились «лечить». Выяснена ее физико-химическая природа, установлено, как влияют на восприимчивость металла к «чуме» те или иные добавки. Оказалось, что алюминий и цинк способствуют этому процессу, а висмут, свинец и сурьма, напротив, противодействуют ему.

Слайд 32Применение германия
полупроводниковая техника,используется для изготовления диодов, триодов, кристаллических детекторов и силовых выпрямителей. в дозиметрических приборах и приборах, измеряющих напряженность постоянных и переменных магнитных полей. инфракрасная техника, в частности производство детекторов инфракрасного излучения, работающих в области 8-14 мкм. стекла на основе GeO2
Слайд 33Применение олова
безопасное, нетоксичное, коррозионностойкое покрытие в чистом виде или в сплавах с другими металлами изготовления тары пищевых продуктов известный сплав — пьютер — используется для изготовления посуды. используется для создания сверхпроводящих проводов на основе интерметаллического соединения Nb3Sn. двуокись олова — очень эффективный абразивный материал, применяемый при «доводке» поверхности оптического стекла.

Слайд 34оловоорганические стекла надежно защищают от рентгеновского облучения, полимерными свинец- и оловоорганическими красками покрывают подводные части кораблей, чтобы на них не нарастали моллюски. в химических источниках тока в качестве анодного материала перспективно использование олова в свинцово-оловянном аккумуляторе олово имеет непосредственное отношение к рождению мелодичных звуков в самых различных колоколах, поскольку оно входит в состав медных сплавов, применяемых для их отливки. защита древесины от гниения, уничтожение насекомых-вредителей и многое другое.

Слайд 35Применение свинца
в производстве свинцовых аккумуляторов. свинец сильно поглощает γ-лучи и рентгеновские лучи, благодаря чему его применяют как материал для защиты от их действия (контейнеры для хранения радиоактивных веществ, аппаратура рентгеновских кабинетов и других). изготовление оболочек электрических кабелей, защищающих их от коррозии и механических повреждений. оксид Свинца РbО вводят в хрусталь и оптическое стекло для получения материалов с большим показателем преломления