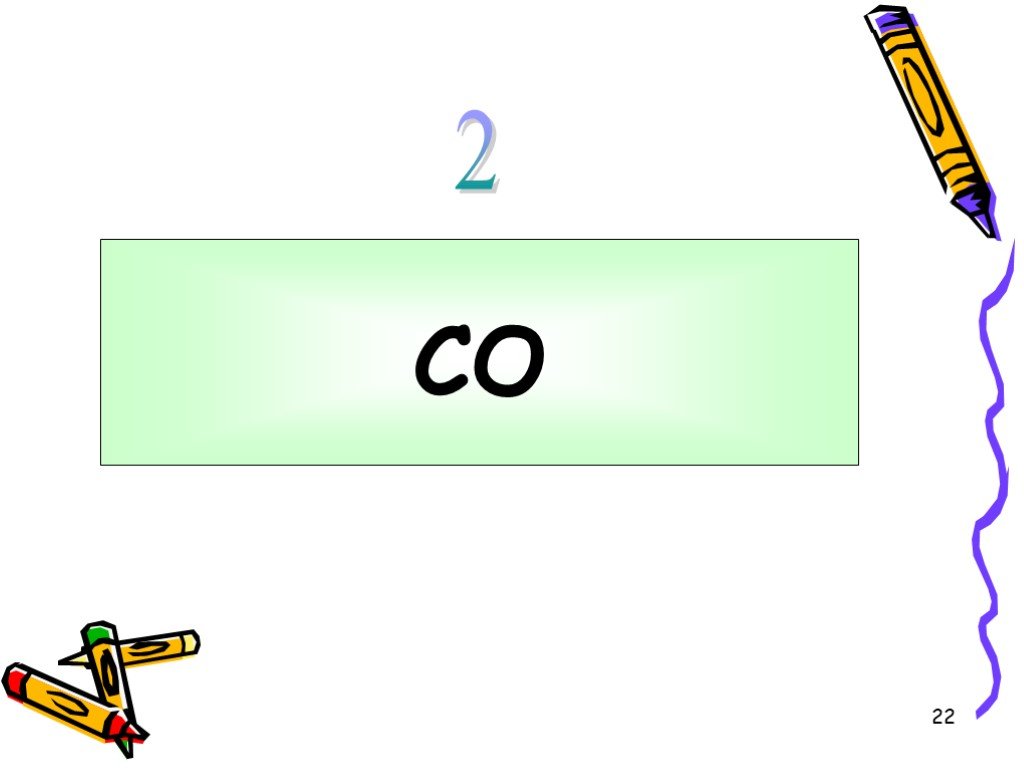Презентация "Оксиды углерода" (9 класс) по химии – проект, доклад
Презентацию на тему "Оксиды углерода" (9 класс) можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 30 слайд(ов).
Слайды презентации
Список похожих презентаций
Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ
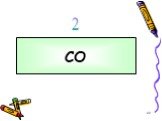
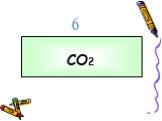
В 300 мг 20% раствора HNO3 растворили 10 мл аммиака. Определить массу полученной соли. Задача:. CO2 углекислый газ Без цвета Без запаха В воде растворяется ...Оксиды углерода
Оксиды углерода (II) и (IV). Тема: Содержание. Входной тест Строение молекул Физические свойства Физиологическое воздействие Получение Химические ...Оксиды, их применение
Один из распространенных оксидов – диоксид углерода CO2 – содержится в составе вулканических газов. В природе. Газ, необходимый растениям для фотосинтеза. ...Оксиды, их классификация
Это газ, необходимый растениям для фотосинтеза. Это газ, выделяемый нами при выдохе. Что это за газ? … на рукомойнике моём Позеленела медь, Но так ...Оксиды азота
Содержание. Виды оксидов азота. Оксид азота(I). Оксид азота(II). Оксид азота(III). Оксид азота(IV). Азотный ангидрид. Виды оксидов азота. N2O NO N2O3 ...Оксиды
Важнейшие классы неорганических веществ. Al(OH)3 MgO FeO Cu(OH)2 H2CO3 HNO3 H2 SO4 Ca(OH)2 Na2SO4 Al(NO3)3 СaCO3 K3PO4 H2SiO3. Распределить вещества ...Оксиды
Ребята, у нас с вами сегодня не просто урок, а научно-исследовательская лаборатория, а вы не ученики, а лаборанты-исследователи, которые должны самостоятельно ...Углерод, соединения углерода
Цель занятия: обобщение, систематизация и углубление знаний по теме «Углерод и его соединения». Вопросник:. Элементы, содержащиеся в живых организмах. ...Круговорот углерода
КРУГОВОРОТ УГЛЕРОДА. Зависит как от биохимических, так и от физических процессов. АТМОСФЕРНЫЙ УГЛЕКИСЛЫЙ ГАЗ. Наиболее доступный источник углерода, ...Классификация неорганических веществ. Оксиды
ОКСИДЫ. Оксиды- бинарные соединения с кислородом в степени окисления (-2). Общая формула оксидов: ЭmOn где m число атомов элемента Э, а n – число ...Кислородные соединения углерода
Взаимопроверка. Отметка: 10 правильных ответов – «5» 8-9 правильных ответов – «4» 5-7 правильных ответов – «3» Менее 5 – «2». Урок химии в 9 классе ...Кислородные соединения углерода
Угарный газ (СО)содержится в выхлопных газах автомобилей. Воздух, окутывающий Землю, содержит около 3 млрд. т. СО2. План изучения веществ. Состав ...Кислородные соединения углерода
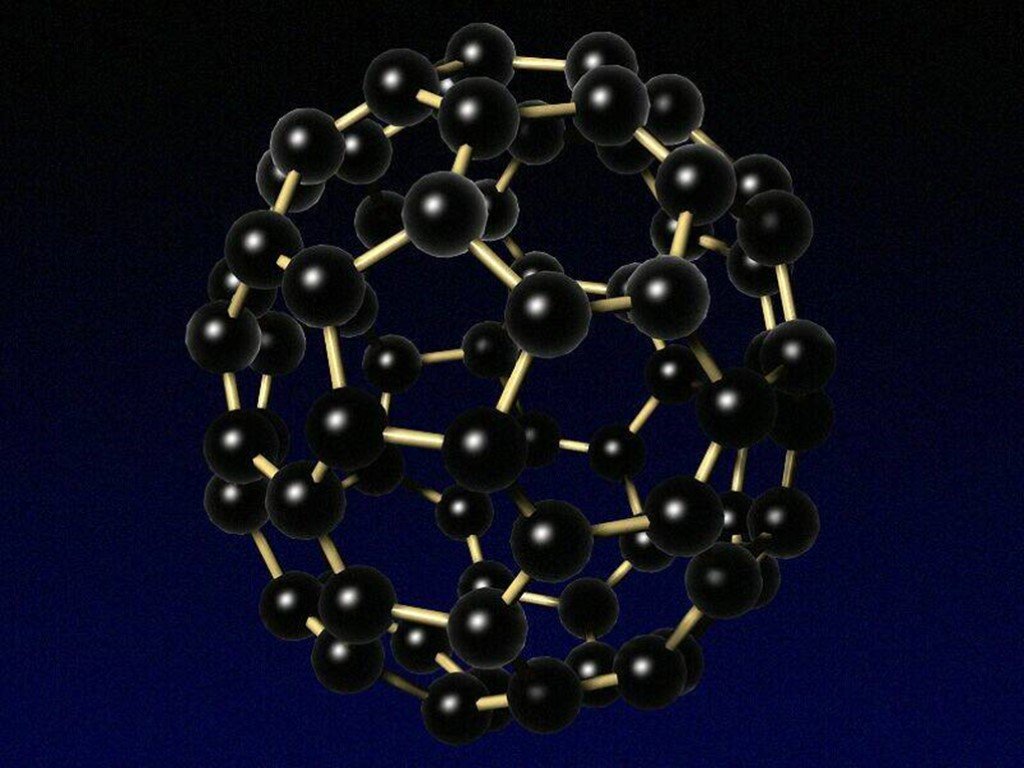
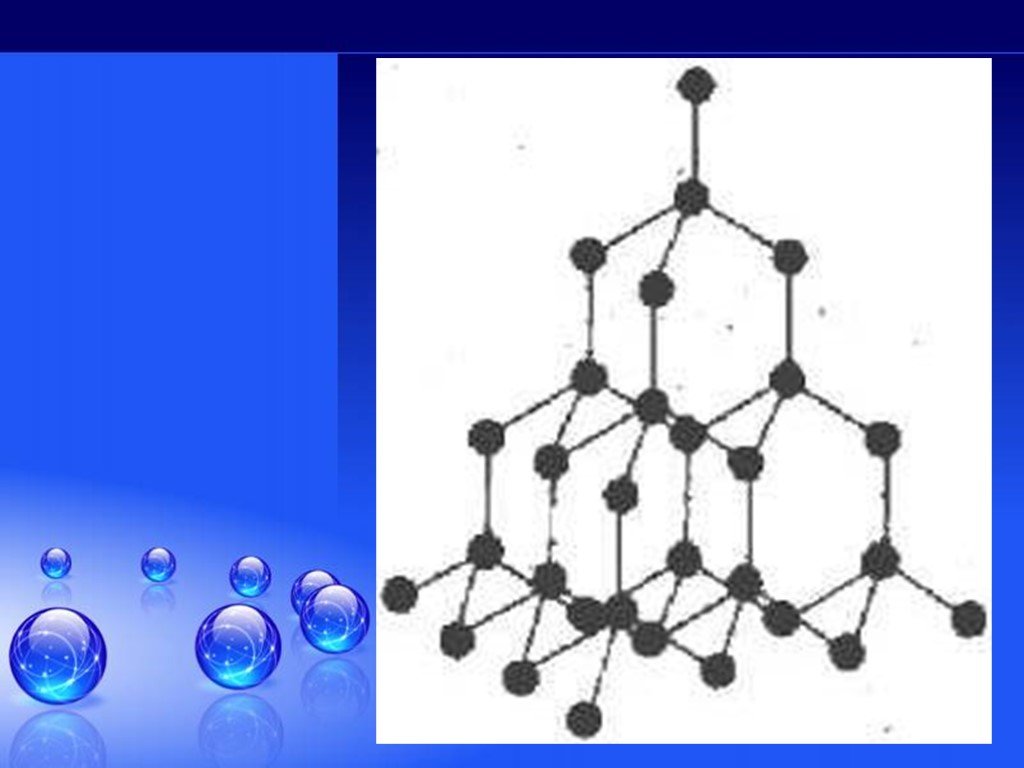
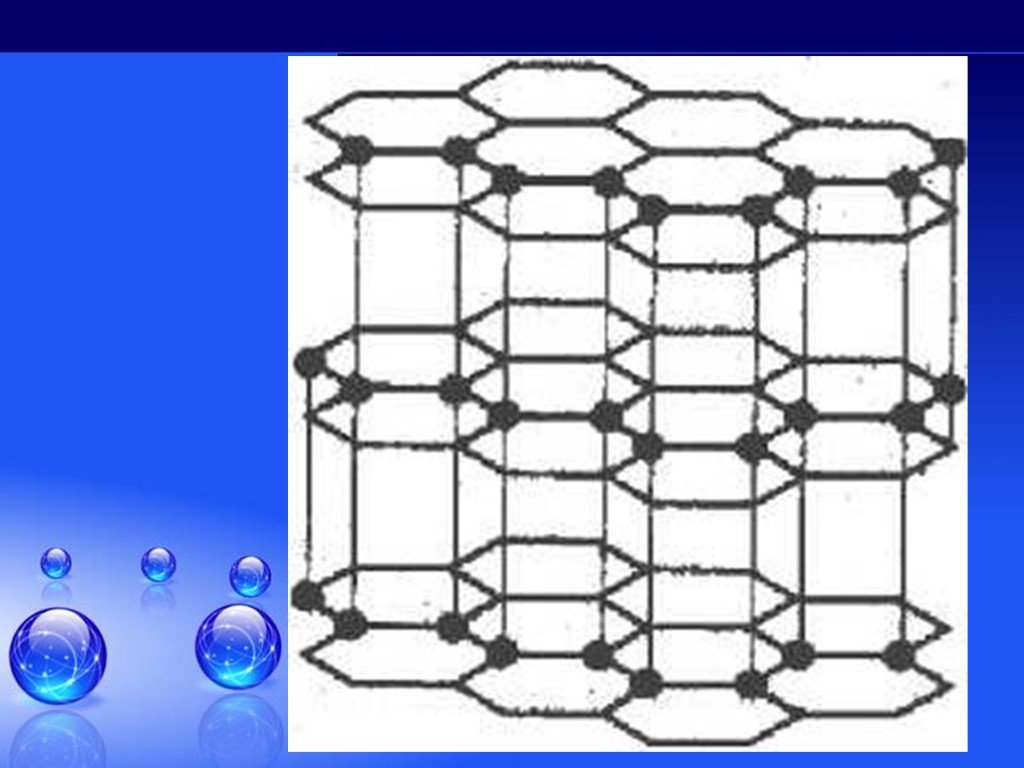
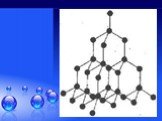
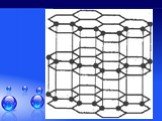
Без углерода не существует ни одного растения или животного... Кристаллическая решетка графита (плоскостная). Кристаллическая решетка алмаза (тетраэдрическая). ...Гибридизация атомов углерода
1s sp3 – ГИБРИДИЗАЦИЯ. Электронная структура атома углерода. С – 1s22s22p2 С* – 1s22s12p3. Процессы выравнивания орбиталей по форме и энергии называют. ...Подгруппа углерода
Химия. Подгруппа углерода. Положение элементов подгруппы углерода в периодической системе, строение их атомов. C, Si, Ge, Sn, Pb. Общая характеристика. ...Подгруппа углерода и азота
Цель урока:. Закрепить и обобщить знания об основных физических и химических свойствах углерода, азота и их соединений. Продолжить формировать умение ...Круговорот углерода в биосфере
цели урока. - Выяснить, какие организмы участвуют в круговороте углерода - Составить схему процесса круговорота углерода. - Проследить и уточнить ...Валентные состояния атома углерода
Первое валентное состояние атома углерода (на примере молекулы метана). СН4 Н Н С Н Н. Два «противоречия» в строении метана:. Валентность углерода ...Круговорот углерода в природе
Вся земная жизнь основана на углероде. Каждая молекула живого организма построена на основе углеродного скелета. Атомы углерода постоянно мигрируют ...Оксиды
КЛАССИФИКАЦИЯ ОКСИДОВ. Оксиды 1) несолеобразующие N2O, NO, CO 2) Солеобразующие Основные Амфотерные Кислотные CaO ZnO P2O5 соответствуют соответствуют ...Конспекты
Оксиды углерода
Цель. : сформировать знания об оксиде углерода (II) и оксиде углерода (IV). Задачи:. На основе электронного строения атома углерода определить ...Оксиды углерода (II) и (IV). Карбонаты
Открытый урок по химии в 9 классе по теме:. . . «Оксиды углерода (. II. ) и (. IV. ). Карбонаты». Учитель МКОУ СОШ с.п. Кара-Суу Жабоева Раиса ...Углерод, аллотропия углерода. Химический свойства и применение углерода
Конспект урока по теме:. «Углерод, аллотропия углерода, физические и химический свойства. . . Применение углерода.». Выполнила:. Учитель ...Кислород, его общая характеристика и нахождение в природе. Оксиды
Муниципальное бюджетное общеобразовательное учреждение. «Краснощёковская средняя общеобразовательная школа№1». Краснощековского района. . Алтайского ...Превращения углерода в природе
МУНИЦИПАЛЬНОЕ АВТОНОМНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА №5 ИМЕНИ Ю.А.ГАГАРИНА г. ТАМБОВА. Интегрированное ...Соли аммония. Оксиды азота (II) и (IV)
Урок 20. Соли аммония. Оксиды азота (II) и (IV). Цели урока:. 1. Охарактеризовать соли аммония и оксиды азота (II) и (IV) по следующей схеме: ...Оксиды
Обобщающий урок по теме « Оксиды». Цель урока:. Систематизировать знания. об оксидах. . Задачи:. . . Образовательные задачи:. . Актуализировать ...Оксиды, их классификация и свойства
Тема урока. Оксиды, их классификация и свойства. Цель:. Формирование целостного представления об оксидах, как классе неорганических соединений. ...Оксиды
Разработала : Сысоева Е.А. ,учитель химии МОУ «СОШ№9». Тема «Оксиды». 8класс. Цель. : сформировать понятие об оксидах, номенклатуре оксидов ...Оксиды
Муниципальное бюджетное общеобразовательное учреждение. «Гимназия № 7 имени Героя России С.В.Василева» г. Брянска. Технологическая ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:18 октября 2018
Категория:Химия
Классы:
Содержит:30 слайд(ов)
Поделись с друзьями:
Скачать презентацию