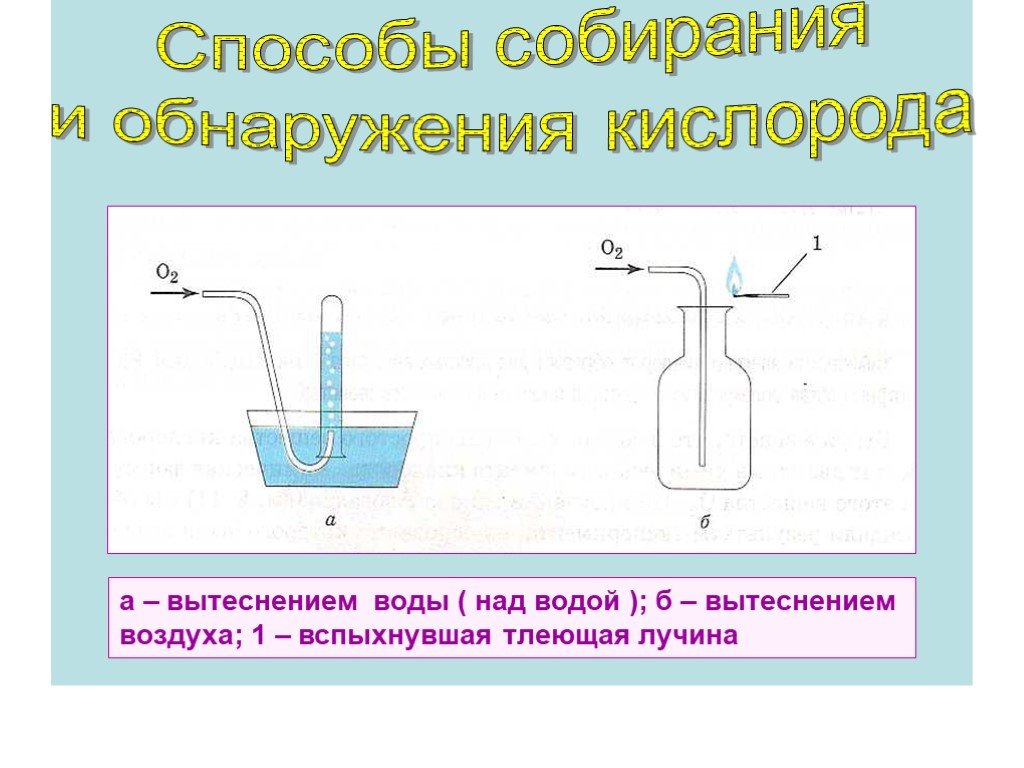
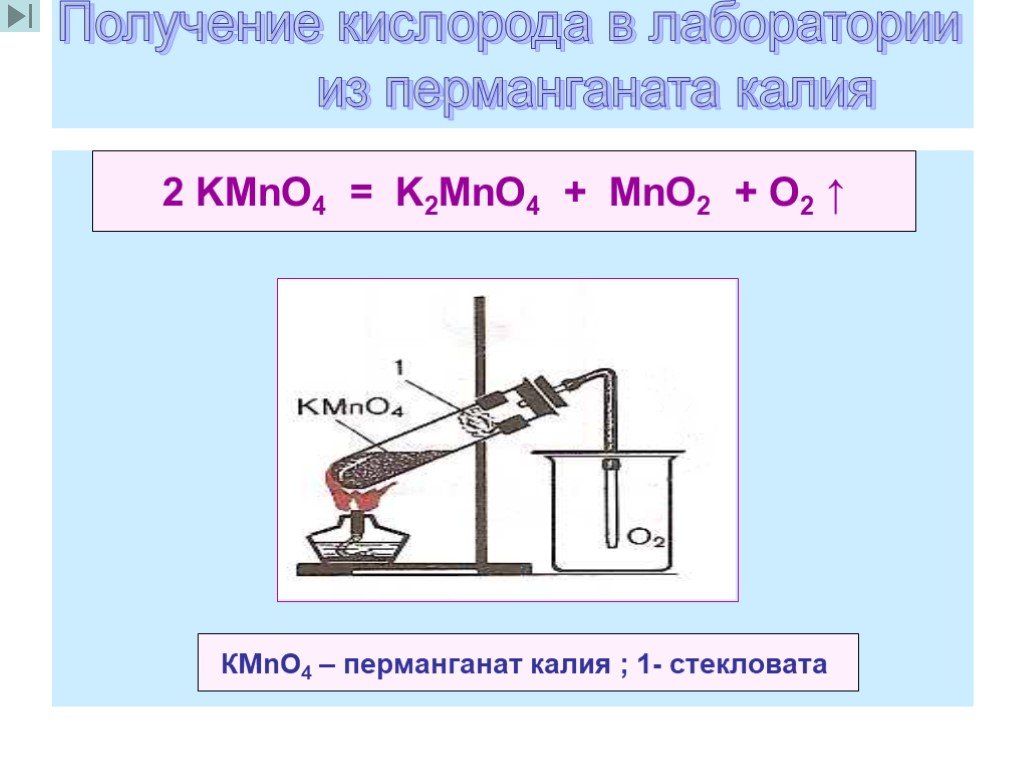
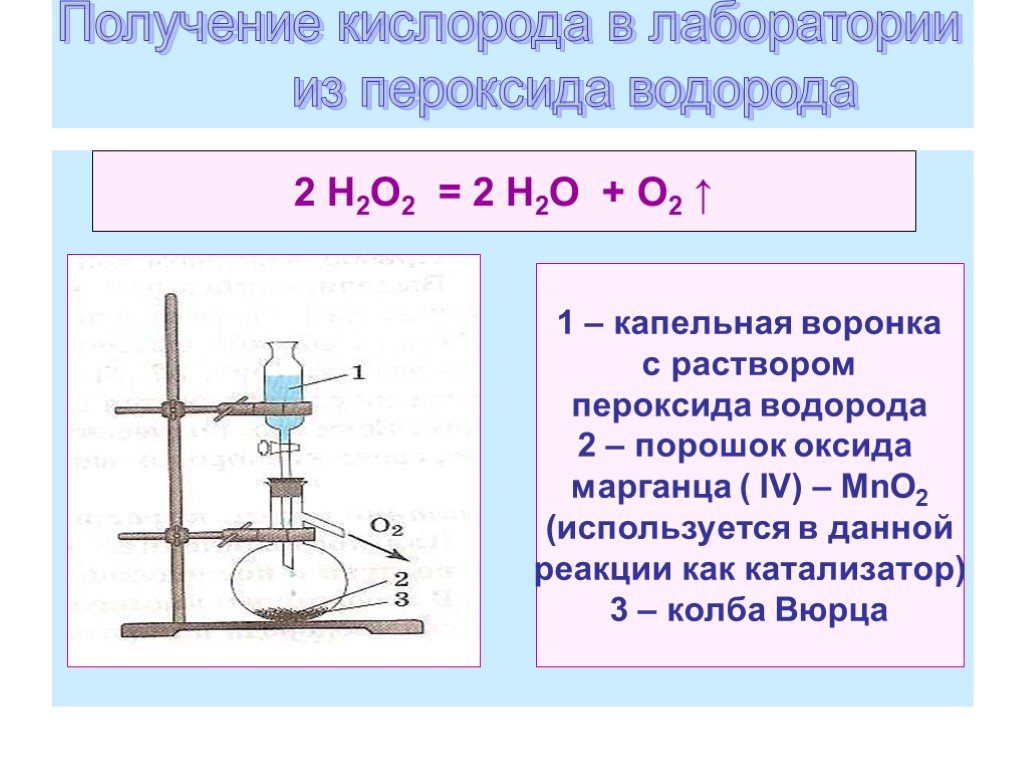
Презентация "Горение кислорода" по химии – проект, доклад
Презентацию на тему "Горение кислорода" можно скачать абсолютно бесплатно на нашем сайте. Предмет проекта: Химия. Красочные слайды и иллюстрации помогут вам заинтересовать своих одноклассников или аудиторию. Для просмотра содержимого воспользуйтесь плеером, или если вы хотите скачать доклад - нажмите на соответствующий текст под плеером. Презентация содержит 35 слайд(ов).
Слайды презентации
Список похожих презентаций
Роль кислорода
Дыхание. Кислород необходим практически всем живым существам. С помощью дыхания живые существа вырабатывают энергию, необходимую для поддержания жизни. ...Физические свойства кислорода и его получение
Цели урока. Повторение. Новый материал. Тесты на закрепление. Рефлексия. Домашнее задание. Цели: - сформировать представление о кислороде; Задачи: ...Применение кислорода
Кислород необходим практически всем живым существам. Дыхание – это окислительно-восстановительный процесс, где кислород является окислителем. С помощью ...Применение кислорода
Корнелиус Дреббель. Интересным фактом является то, что впервые кислород выделили не химики. Это сделал изобретатель подводной лодки К. Дреббель в ...Получение и химические свойства кислорода
Цели и задачи урока:. Выяснить источник кислорода в природе; познакомиться с лабораторными и промышленными способами получения кислорода Познакомиться ...Применение кислорода
КИСЛОРОД. Кислород - 16-й элемент главной подгруппы VI группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным ...Общая характеристика элементов подгруппы кислорода
ПАМЯТКА К ИЗУЧЕНИЮ ПОДГРУППЫ ЭЛЕМЕНТОВ. 1.Пользуясь Периодической системой, выпишите символы и названия химических элементов, относящихся к данной ...Подгруппа кислорода
Реактивы: сульфат натрия, сульфат меди (ll), лакмус, фенолфталеин, хлорид бария, гидроксид калия, серная кислота Оборудование: набор пробирок (ПХ-14, ...Круговорот кислорода
Цель работы: Уяснить функцию живого вещества на планете, рассмотреть как осуществляется круговорот кислорода в природе. Выяснить источники кислорода ...Круговорот кислорода в природе
Круговорот веществ – многократно повторяющийся процесс совместного, взаимосвязанного превращения и перемещения веществ в природе, имеющий более или ...Кислород. Получение кислорода и его физические свойства
Цель. сформировать понятия кислород как атом и молекула; изучить физические и химические свойства кислорода, нахождение его в природе; рассмотреть ...Задачи Подгруппа кислорода
Практическая работа№2 Решение экспериментальных задач по теме «Подгруппа кислорода» Цель: опытным путем определить растворы следующих веществ: H2SO4 ...Горение металлов
Свойства летучих горючих металлов и их оксидов. На способность металлов возгораться и гореть большое влияние оказывают химические и физические свойства ...Химические явления. Горение
Цель урока. Познакомиться с новыми понятиями: химические явления, химические реакции; Познакомиться с реакцией горения; Определить значение горения ...Воздух. Кислород. Горение
Результат теста. Верно: 15 Ошибки: 0 Отметка: 5. Время: 0 мин. 33 сек. ещё. Вопрос 1 Г). O А). Os Б). H В). K. Задание теста с единственным правильным ...Аллотропия кислорода
Оглавление. Аллотропия. Аллотропные модификации кислорода. История открытия кислорода и озона. Нахождение в природе. Строение молекулы. Физические ...Кислород химия
Общая характеристика кислорода. Химический элемент Знак элемента – О Валентность – II Относительная атомная масса - 16. Простое вещество Неметалл ...Своя игра. Физика и химия
Интегрированный урок ФИЗИКА+ХИМИЯ. Авторы: Орлова И.В., Шувалова Л.В. Муниципальное образовательное учреждение Фоминская средняя общеобразовательная ...Полезная химия во фруктах и овощах
1 3 4 5 6 7 8 9 10 11 13 14. Химический состав сока во многом схож у различных видов этих фруктов: сок плодов содержит: сахара, органические кислоты, ...Откуда ты, химия ?
Химические элементы. Роберт Бойль – впервые дал определение химического элемента. Джон Дальтон – впервые ввёл понятие атомного веса. А.М.Бутлеров ...Конспекты
Положение кислорода и серы в периодической системе химических элементов, строение их атомов. Озон – аллотропная модификация кислорода
Дата _____________ Класс ___________________. Тема: Положение кислорода и серы в периодической системе химических элементов, строение их атомов. ...Положение кислорода и серы в периодической системе химических элементов, строение их атомов. Озон-аллотропная модификация кислорода
Технологическая карта урока. . . Учитель Дьячук Е.Ю. учитель химии МБОУ СОШ №1 г.Оха Сахалинская область. Предмет. химия. . Класс. . ...Подгруппа кислорода
Урока по химии 9 класс по теме:. «Подгруппа кислорода». Составлен учителем химии. МОУ «СОШ №5 г.Кировска». Зудковой Верой Сергеевной. Цель ...Подгруппа кислорода
Дата_____________ Класс_______________. Тема:. . Практическая работа №2 Решение экспериментальных задач по теме «Подгруппа кислорода». Цели урока:. ...Химические свойства кислорода
Муниципальное казённое общеобразовательное учреждение «Тальменская средняя общеобразовательная школа №1». Тальменского района Алтайского края. ...Воздух. Горение веществ на воздухе
. Урок по теме:. . «Воздух. Горение веществ на воздухе». . . . Учитель химии МКОУ СОШ № 7. с. Величаевского Левокумского района ...Кислород. Оксиды. Горение
Урок-зачет по химии в 8 классе «Кислород. Оксиды. Горение». Цели урока:. - обобщить и систематизировать знания учащихся, полученные при изучении ...Свойства кислорода
Свойства кислорода. Цель урока. Обучающие :. способствовать формированию знаний учащихся о кислороде, его химических свойствах;. . реакция ...Кислород: химический элемент и простое вещество. Свойства, получение и применение кислорода
Тема. :. Кислород: химический элемент и простое вещество. Свойства, получение и применение кислорода. Цель: Развитие исследовательских способностей ...Кислород. Оксиды. Горение
Тема урока « Обобщение по теме: «Кислород. Оксиды. Горение.». Учитель. Наумова И. В. Класс. 8. Методическая цель:. через игровую форму показать ...Советы как сделать хороший доклад презентации или проекта
- Постарайтесь вовлечь аудиторию в рассказ, настройте взаимодействие с аудиторией с помощью наводящих вопросов, игровой части, не бойтесь пошутить и искренне улыбнуться (где это уместно).
- Старайтесь объяснять слайд своими словами, добавлять дополнительные интересные факты, не нужно просто читать информацию со слайдов, ее аудитория может прочитать и сама.
- Не нужно перегружать слайды Вашего проекта текстовыми блоками, больше иллюстраций и минимум текста позволят лучше донести информацию и привлечь внимание. На слайде должна быть только ключевая информация, остальное лучше рассказать слушателям устно.
- Текст должен быть хорошо читаемым, иначе аудитория не сможет увидеть подаваемую информацию, будет сильно отвлекаться от рассказа, пытаясь хоть что-то разобрать, или вовсе утратит весь интерес. Для этого нужно правильно подобрать шрифт, учитывая, где и как будет происходить трансляция презентации, а также правильно подобрать сочетание фона и текста.
- Важно провести репетицию Вашего доклада, продумать, как Вы поздороваетесь с аудиторией, что скажете первым, как закончите презентацию. Все приходит с опытом.
- Правильно подберите наряд, т.к. одежда докладчика также играет большую роль в восприятии его выступления.
- Старайтесь говорить уверенно, плавно и связно.
- Старайтесь получить удовольствие от выступления, тогда Вы сможете быть более непринужденным и будете меньше волноваться.
Информация о презентации
Дата добавления:18 октября 2018
Категория:Химия
Содержит:35 слайд(ов)
Поделись с друзьями:
Скачать презентацию